不同添加量的聚-β-羟基丁酸酯作为生物絮凝缓释碳源的应用效果
吴 霞,吴长胜,王国庆,罗国芝 ,2,3,谭洪新 ,2,3
(1 上海海洋大学 上海水产养殖工程技术研究中心,上海 201306;2 上海海洋大学 农业农村部淡水水产种质资源重点实验室,上海 201306;3 上海海洋大学 水产科学国家级实验教学示范中心,上海 201306)
生物絮凝技术(Bio-floc Technology,BFT)通过向养殖水体添加有机碳源来提高养殖水体的碳氮比(C/N>15)[1],培育系统自身对于氨氮的控制能力,形成细菌、原生动物、有机颗粒物等聚焦而成的生物絮团[2-3],获能的异养细菌得到较高的生长速率获得优势生长,构建了水体中稳定的微生物群落抑制病原体的生长[4-5]。
碳源的选择对养殖对象的生长、絮团营养组分及水质都可能产生影响[6-8]。传统碳源主要有葡萄糖、淀粉、糖蜜等[9-10]。可生物降解聚合物(Biological degradable polymers,BDPs)作为生物絮凝养殖模式的缓释碳源时可以避免过量添加、添加不足或难以计算等问题[11]。聚己内酯(Polycaprolactone,PCL)被证实可以成为水产养殖中进行异养反硝化的优质碳源[12]。Qiao等[13]研究表明,养殖过程中在饲料中添加4%的聚-β-羟基丁酸酯(Poly-β-hydroxybutyrate,PHB)可以显著改变养殖生物的肠道微生物结构,上调相关免疫基因表达,PHB在水体中也可作为微生物集聚的媒介。BFT形成生物絮体时水体中的粪便和残饲也得以被重新利用,形成的生物絮团也可被滤食性养殖对象摄食[14],PHB作为微生物介导的缓释碳源在水体中降解缓慢不会留下过多残余[15-17]。张楠等[18]研究了PHB与传统碳源葡萄糖作为生物絮凝碳源对罗非鱼养殖效率的影响对比,罗非鱼的生长指标并没有出现显著差异,且使用PHB代替传统碳源可以在养殖阶段维持水体C/N适宜。
目前有关PHB作为生物絮凝碳源的研究,多集中在PHB作为生物絮凝系统缓释碳源的可行性的探索阶段,缺少PHB作为生物絮凝系统缓释碳源投放策略的进一步研究。本研究以PHB作为生物絮凝的缓释碳源,研究不同添加量的PHB作为BFT碳源对罗非鱼生长及对生物絮凝系统的影响,寻求PHB作为BFT碳源的适宜添加量。
1 材料与方法
1.1 试验装置
试验在上海海洋大学养殖工程与技术实验室循环水养殖研发中心进行。养殖装置为9个白色牛筋塑料桶,其规格为上外径为65 cm,上内径58 cm、下外径51 cm、下内径50 cm、高度76 cm、质量4.5 kg。养殖桶容积150 L,试验所用工作容积120 L。所有养殖桶安置在室内环境中,养殖桶上方全程盖上配套桶盖。养殖桶连接罗茨鼓风机(型号HG-750,浙江森森森股份有限公司),桶内接入一个直径为50 mm的面包形曝气石,沉于桶底正中央使得各桶获得足够的溶氧及使絮团悬浮的搅拌力。
PHB购自广东迪捷塑化有限公司,为白色米粒状结晶颗粒,长度3~5 mm,中心横切直径约3 mm,经纯水2~3次清洗后经过45℃恒温烘箱烘干至恒重后备用。
试验用鱼为吉富罗非鱼(GIFT Oreochromis niloticus)取自上海海洋大学滨海养殖基地,运回实验室后在循环水系统中暂养至(8.97±2.53)g/尾。使用预先培育好的生物絮团。暂养及试验期间用于投喂罗非鱼的饲料皆为通威股份有限公司出产的鱼用膨化配合饲料“鱼倍健150”。
1.2 试验方法
试验周期为48 d,在9个养殖桶接种预先培好的生物絮团,调控其絮团含量为300 mg/L。养殖的罗非鱼初始质量为(8.97±2.53)g,每个养殖桶初始投放20尾鱼苗。各组通过尼龙网袋分别按照约80 g/m3、200 g/m3、320 g/m3的比例添加PHB,添加量分别为A组10 g、B组25 g、C组40 g,每组3个平行。网袋悬于水体上层区域并于袋中置入4只玻璃珠用于帮助挂袋悬浮不受水体搅拌力的影响。
试验期间每日按3.00%投饲量分早中晚3次投喂,每10 d随机称重罗非鱼,根据称重结果进行投喂量的调整。每4 d测定碱度及总固体悬浮颗粒物(TSS)质量浓度,使用碳酸氢钠以调整碱度,使碱度维持在150.00~300.00 mg CaCO3/L,将TSS维持在300~600 mg/L。
1.3 水质指标的测定
SR=(N2/N1)×100%
(1)
WGR=(W2-W1)/W1×100%
(2)
SGR=(lnW2-lnW1)/t×100%
(3)
FCR=F1/(W2-W1)
(4)
式中:SR—存活率;WGR—增重率;SGR—特定生长率;FCR—饲料系数;N1—投入养殖水体鱼的数量,尾;N2—试验结束后还存活鱼的数量,尾;W1—投入养殖水体鱼的初始质量,g;W2—养殖阶段结束后鱼的质量,g;t—养殖天数,d;F1—饲料投喂量,g。
1.4 絮团营养指标的测定
养殖阶段结束后,养殖水经过自然沉降后过800目尼龙筛布滤出絮体,将絮体进行冷冻干燥48 h,利用粉碎机研磨至粉末状,使用碳、氮元素分析仪测定絮体粉末碳氮元素的含量。粗蛋白使用凯氏定氮仪(Kjeltec2300)直接测定;取干燥恒重后的絮体粉末先在电炉进行5 min灼烧后转移至马弗炉(SR-JX3-9 箱式电炉)中,设置温度260 ℃,灼烧5 h至恒重,根据差值测定其粗灰分,水解氨基酸参照国家相关标准进行检测。
1.5 数据分析
在Excel软件内进行相关试验数据分析,并且使用 Origin2018以及Adobe Illustrator CC 2018 软件进行相关的图表绘制。试验数值采用平均值±标准差(Mean±SD)的形式表示,采用IBM SPSS Statistics 23.0统计软件对相关数据进行 ANOVA 单因素方差分析,(P<0.05)为差异性显著,(P>0.05)为差异性不显著。
2 结果
2.1 水质参数
如表1所示,试验期间各处理组溶氧为7.69~8.62,pH的范围在7.82~8.43,各组水温维持在23.18~24.50℃。PHB添加量的不同对溶解性有机碳比总氮的比值有显著影响,B组的碳氮比(DOC/TN)显著低于A组及C组(P<0.05)。
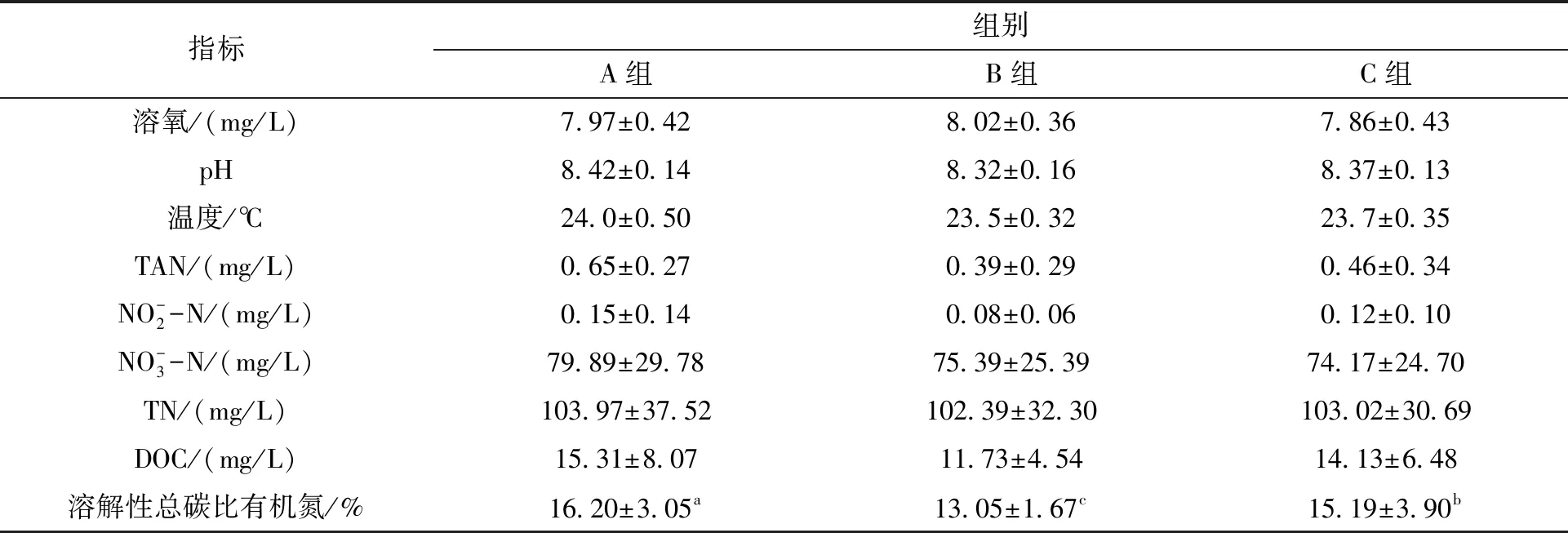
表1 试验期间各处理组水质指标的平均值Tab.1 Mean values of water quality indexes in different groups
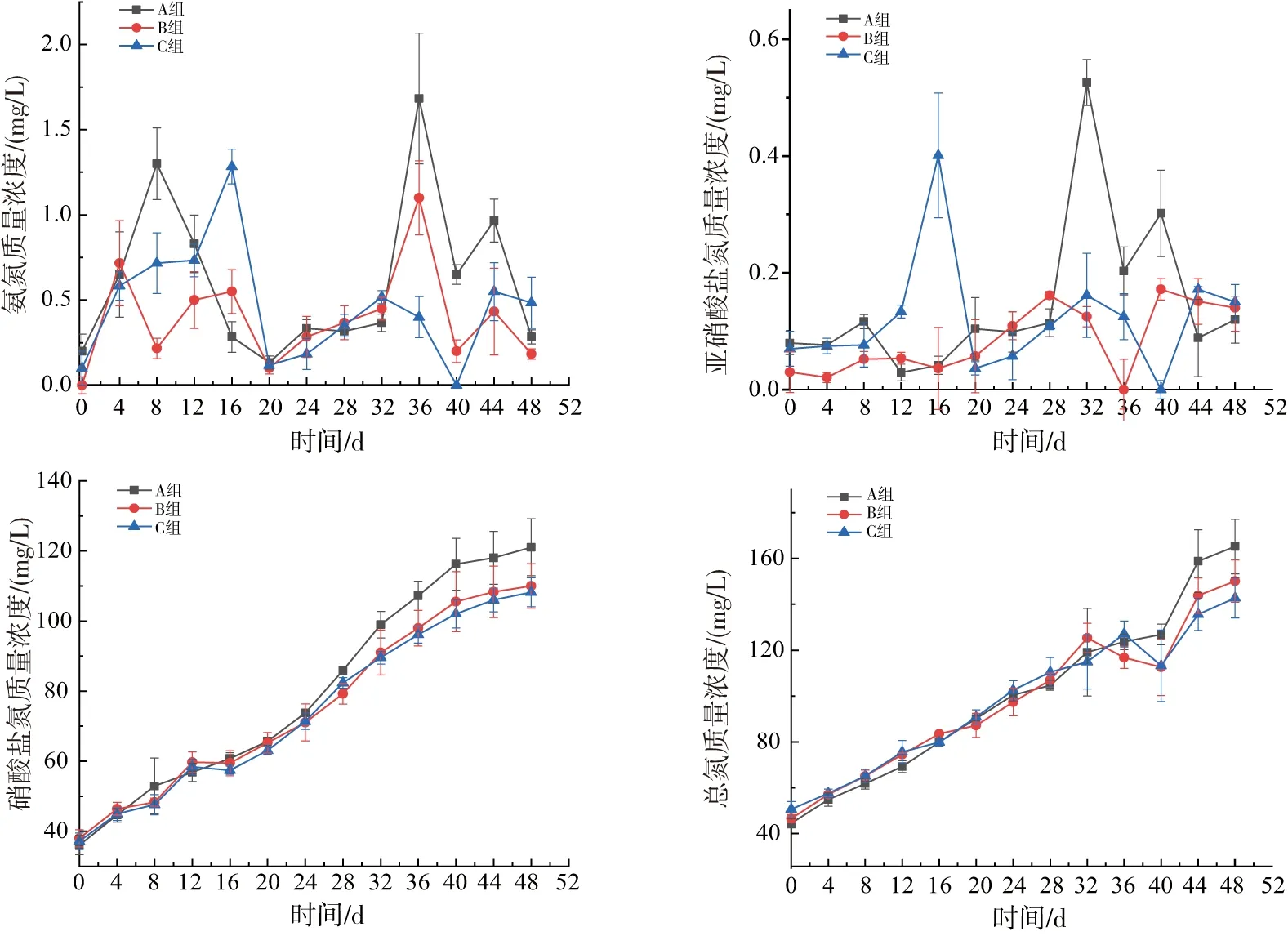
图1 养殖过程中各组三态氮及总氮的变化Fig.1 Dynamic changes of three-state nitrogen and total nitrogen in each group
由图2可知,各组DOC质量浓度随着试验的进行出现了积累,B组及C组于试验后第36 天开始出现下降后再上升的情况,B组于试验后期积累程度更小,试验结束后A组的DOC积累高于C组。随着试验的进行,A组试验后期可以将碳氮比稳定维持在15以上的较高水平,C组碳氮比波动较为剧烈,部分时期无法维持碳氮比在15以上,而B组于试验后期碳氮比无法稳定维持在15以上。
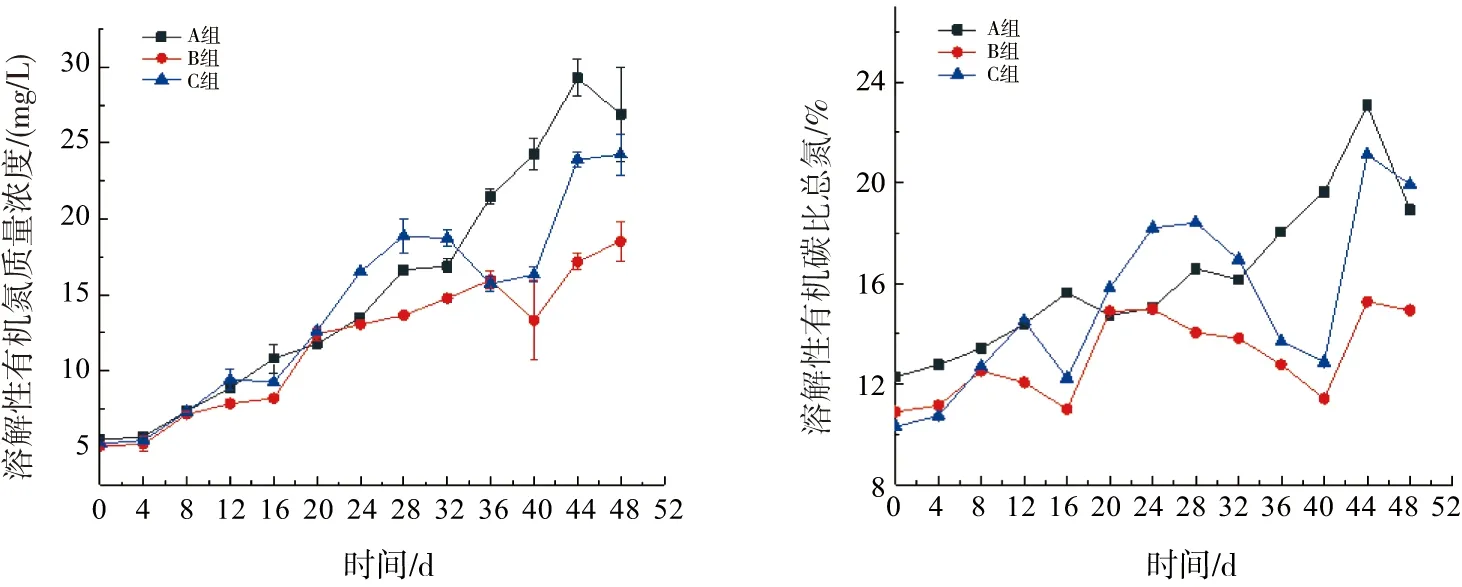
图2 各组溶解性有机碳及溶解性有机碳比总氮的变化Fig.2 Changes of dissolved organic carbon and the ratio of dissolved organic carbon to total nitrogen in each group
2.2 罗非鱼的生长指标
表2可知,各组罗非鱼的生长指标在存活率、增重率及特定增重率上,组间差异不显著(P>0.05),B组存活率相对较低(P>0.05),特定增长率相对较高(P>0.05)。C组的饲料系数显著低于A组和B组(P<0.05),不同添加量PHB对罗非鱼的生长指标并不产生显著影响。
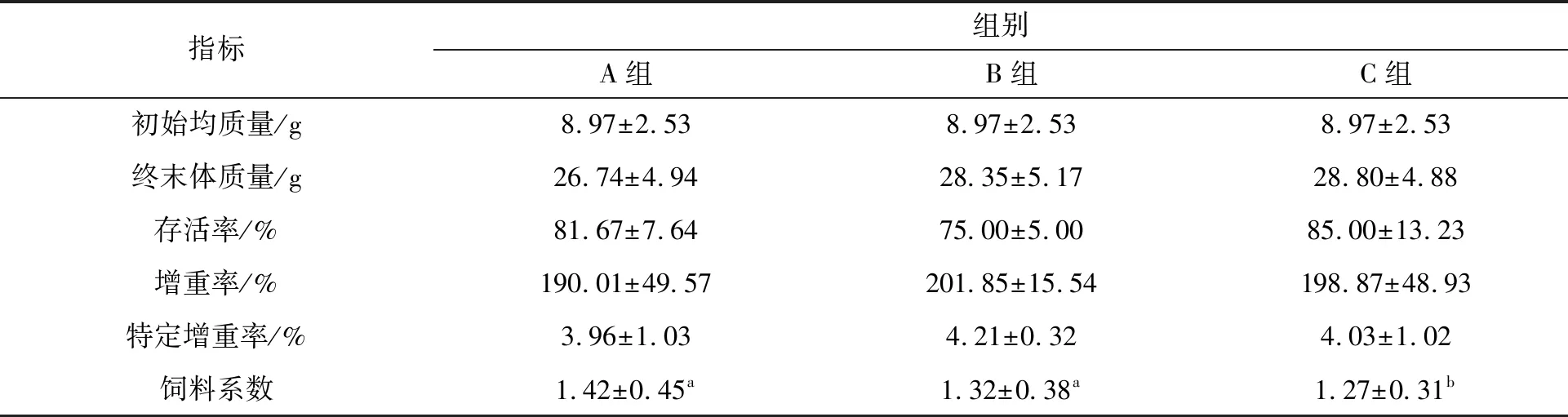
表2 罗非鱼的生长指标Tab.2 Growth indexes of tilapias during the experiment
2.3 PHB的降解情况
各组试验前后PHB的质量及耗损情况如表3所示,不同添加量的PHB作为系统碳源出现不同程度的降解耗损,降解耗损量差异显著(P<0.05),降解耗损量上整体呈现为A组
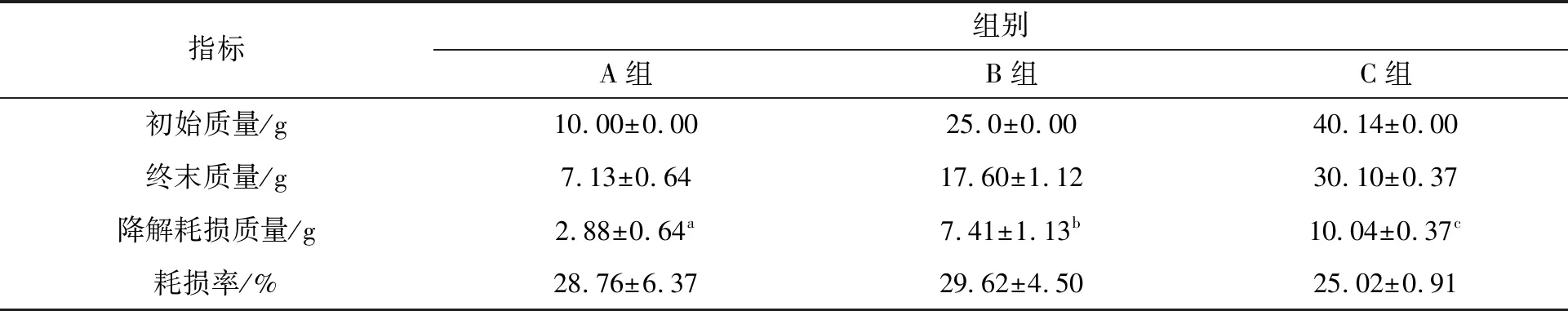
表3 各组PHB试验前后质量、试验后降解耗损质量及耗损率Tab.3 The quality of PHB before and after the experiment,the quality of degradation and loss after the experiment,and the loss rate
图3为试验前后各组PHB扫描电镜检测结果,图3d为试验前未使用的PHB通过扫描电镜对其表面进行观察,PHB表面皆呈现为光滑平坦,无明显孔径。70倍放大下,各组的PHB表面均出现的明显的蜂窝状孔径。6 k及20 k倍放大下扫描成像可见,A组的PHB表面呈现出B组及C组没有的蜂窝状凹陷,B组及C组之间PHB表面破损情况在扫描电镜放大60 k及20 k倍放大成像下差异不显著,可见随着PHB添加量的减少,较低的PHB作为碳源,PHB颗粒的降解破损程度更高。

图3 各组PHB扫描电镜图Fig.3 PHB scanning electron micrographs of each group
试验后,各组PHB及未作为碳源的PHB做红外光谱检测,检测图谱如图4所示,PHB红外谱图中1 452 cm-1和1 387 cm-1处的峰值与-CH3和-CH2基团对应,2 946 cm-1处的峰值对应的是烷基-CH3基团的延伸波段[21]。各组PHB与未经历降解的PHB主要吸收峰值基本保持一致。可见PHB作为碳源经过降解后其分子结构及主要化学键并未改变。
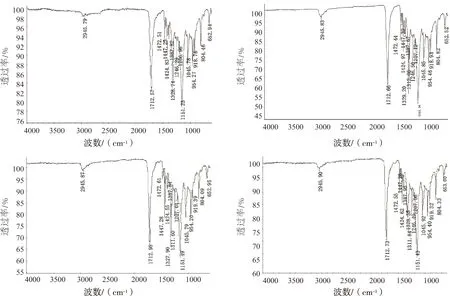
图4 各组PHB红外光谱扫描图谱Fig.4 Infrared spectrum of PHB of each group
2.4 絮团营养成分分析
如表4试验前后各组絮团组分指标所示,B组粗灰分含量(33.64±3.03)%显著低于试验前絮团中的粗灰分含量(39.25±0.45)%(P<0.05),各组之间C/N、粗蛋白及粗灰分含量无显著差异(P>0.05),C组试验后C/N相对较低而粗蛋白相对较高(P>0.05)。A、B和C组组间粗脂肪含量差异不显著(P>0.05)。试验前后,A组粗脂肪皆高于B、C组,试验后各组的粗脂肪相比与试验前出现量不同程度的升高(P>0.05)。
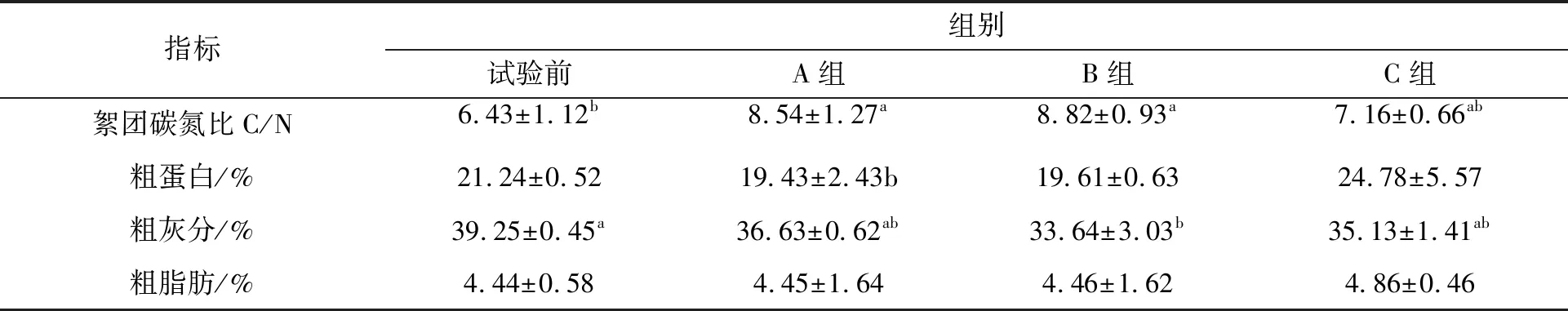
表4 试验前后各组絮团组分指标Tab.4 Index of group floccules before and after the experiment
对比试验前絮团,试验后各组生物絮团中的17种氨基酸的相对含量如表5所示。试验后的各组絮团的必需氨基酸Thr、Phe、His及非必需氨基酸Asp、Cys、Tyr较试验前出现的显著下降(P<0.05)。试验前生物絮团的非必需氨基酸Ser显著低于试验后各组生物絮团Ser的相对含量(P<0.05)。必需氨基酸Thr、Phe、His、Asp、Cys、Tyr的相对含量试验前后及组间无显著差异(P>0.05),必需氨基酸Glu、Gly、Ala试验前后及组间无显著差异(P>0.05)。试验后的B组的必需氨基酸Met的相对含量显著高于C组,A组及C组Met相对含量差异不显著(P>0.05),不同的PHB添加量对胱氨酸Cys相对含量影响显著(P<0.05)。
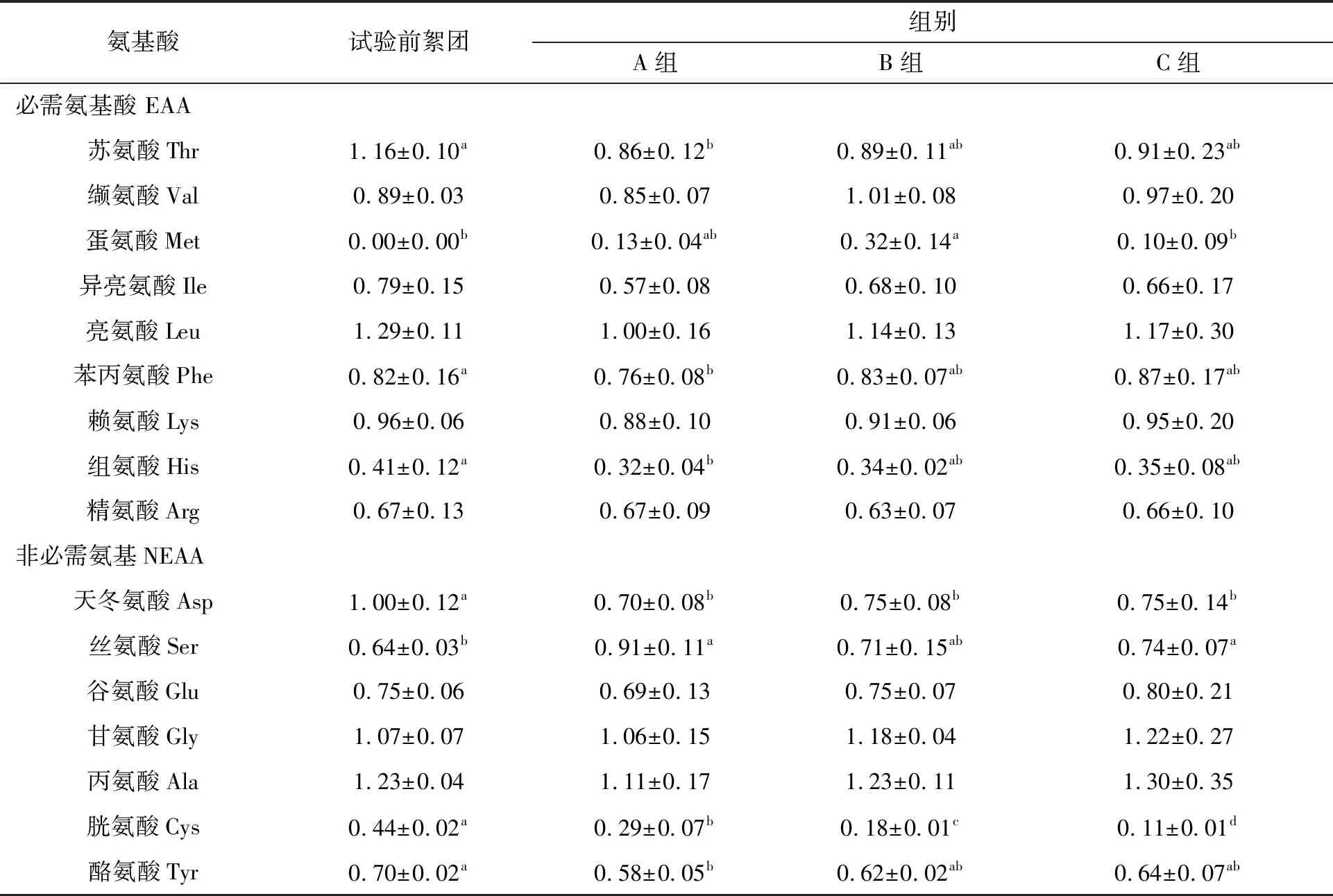
表5 试验前后各组17种氨基酸相对含量(%)Tab.5 The relative content of 17 amino acids in each group before and after the experiment(%)
3 讨论
3.1 各组PHB作为系统碳源的损耗情况
不同的投放量的PHB作为BFT系统的碳源,各组损耗质量出现显著差异,3组的降解耗损质量随着PHB的投放量增加而增大。而PHB表面的降解破损程度并不是随着添加剂添加量的提高而增高,A组的损耗质量最少但PHB表面形成了更为明显的蜂窝状孔径。陈珊等[23]研究表示,PHB是由外部的非结晶部分及内部的结晶部分组成,而内部结晶易降解程度更高。由此可知,PHB是一种内外部分结构致密程度不同的物质,微生物附着于PHB表面会首先降解表面的非结晶部分,其次是内部结晶部分,因此系统中的微生物为了获得足够的碳会优先利用到PHB内部的结晶部分,内部的结晶部分更易受到降解,形成的孔径又可在PHB表面加大与水体接触面从而附着更多的微生物,进一步促进A组的降解。因此A组的PHB表面破损程度更高。
3.2 不同PHB作为碳源对罗非鱼养殖及系统水质的影响
本试验经过48 d的养殖周期,各组存活率、增重率及特定增长率差异均不显著,与邵李娜等[15]使用BHPV作为碳源养殖斑点叉尾研究结果相同,考虑可能是养殖周期短的原因。
氨氮及亚硝酸盐氮是水产养殖的重要指标,因其对系统及养殖对象等毒害作用需要进行持续监测[23-26]。试验开始的20 d后TAN的峰值随着PHB添加量的减少而提高,C组的水质相对更加稳定,但试验期间各组TAN均处于低于2 mg/L的较低范围内。亚硝酸盐氮质量浓度各组试验期间低于0.5 mg/L。由陈伟等[27]研究表明,添加碳源有助于反应器TN的去除,各处理组之间TN的去除随着C/N的升高,去除率也逐渐升高,与本试验结果相同。
基于BFT的水产养殖系统中实时监测C/N非常困难,不论是水溶性碳源还是PHB作为碳源C/N随着碳源的添加或消耗以及鱼饲料或粪便中的氮素水平都会不断变化。因此各组PHB释碳量的差异并不是造成组间DOC、DOC/TN的组间差异的唯一原因。但鉴于C/N对于BFT养殖模式的重要意义,依旧选用DOC/TN作为考察PHB作为碳源释碳效果的重要指标。由于PHB的结构特点PHB内外部分释放碳量存在的差异性,无法为水体在试验开始的前期提供过多的碳[28-29]。试验后期各组的DOC/TN水平出现显著差异,B组的DOC/TN显著低于其他两组,A组已经开始降解内部结晶部分,释碳量加大,而C组由于投放量大,PHB与水体接触面积更高,使得C组相较于B组于同一时间时降解更充分。A组PHB降解损耗质量最小,但试验期间可以将C/N稳定维持在15以上,而B和C组于试验期间无法稳定维持C/N在较高水平。结合各组PHB降解消耗质量的结果,从使用最优化的角度出发,按80 g/m3的添加比例添加PHB为更好的选择,另外关于使用量的进一步减少是否合适也有待在后续试验中进一步进行。
3.3 不同PHB添加量对絮团的营养组分的影响
有相关研究表明絮团的粗蛋白含量在38.5%~57.4%,粗灰分<20%,粗脂肪在20%~35%,能量在 20~25 kJ/g[30]。本试验的研究结果表明不同添加量的PHB作为BFT的碳源对系统絮团的粗蛋白、粗灰分及粗脂肪的含量并不会造成显著影响。考虑本身PHB的消耗量较少无法对絮团产生显著影响,且 PHB作为中微生物介导的缓释碳源,本身在释放碳的过程中不会在水体中形成过多残留,因此各组絮团营养组分差异不显著。因此相较于水溶性的碳源只要保证适合的PHB添加量,不会产生碳源添加过量影响系统絮团稳定性。
4 结论
由于PHB自身结构特性,维持生物絮凝C/N的水平并不随着添加量的提高而升高,当PHB的添加比例为80 g/m3时,可以在养殖过程中稳定维持生物絮凝系统较高的C/N,更有利于系统水质稳定,养殖适宜。
□

