DNMT1通过下调SOX1表达参与宫颈癌生长和转移的机制研究
智艳芳,张婷,刘慧,曾宪旭,班振英,张威
宫颈癌(cervical carcinoma,CC)是女性因恶性肿瘤死亡的主要原因之一,其发生与人乳头瘤病毒(human papillomavirus,HPV)感染密切相关,然而仅HPV感染并不足以引起CC[1],因此CC发生发展的有关分子机制仍有待确定。表观遗传学修饰在肿瘤中的作用逐渐被重视,其中DNA甲基化在包括CC在内的多种肿瘤的发展中起着重要作用[2-3]。位于肿瘤抑制基因启动子区域的CpG岛高甲基化在肿瘤发生发展中具有重要作用,可通过调节基因表达影响肿瘤生长或转移[4]。CpG岛甲基化需要DNA甲基转移酶(DNA methyltransferase,DNMT)的催化,主要包括DNMT1、DNMT3a和DNMT3b[5]。研究显示,DNMT1在宫颈癌变过程中的表达强度逐渐增加,且其高表达与患者存活率密切相关[6-7]。性别决定区Y-框1(sex determining region Y-box 1,SOX1)为肿瘤抑制基因,在CC中SOX1呈现高甲基化和低表达状态[8-9]。但是,DNMT1是否通过SOX1调节CC发展进程尚未知。本研究旨在观察DNMT1在CC生长和转移中的作用并分析其对SOX1的调节作用,以期为CC的治疗提供参考。
1 材料与方法
1.1材料 SPF级7周龄BALB/c Nude雄性裸小鼠18只,体质量18~20 g,购自北京维通利华公司。CC组织及癌旁组织均来自郑州大学第三附属医院病理科,患者组织离体后,迅速置于液氮中冷冻,然后放入-80℃冰箱中保存待用(患者已签署知情同意书)。HeLa229、ME-180、SiHa、SW756宫颈癌细胞和Ect1/E6E7宫颈上皮细胞均购自美国ATCC细胞资源中心。EMEM培养基购自南京维森特生物技术有限公司;McCoy′s 5a培养基、Leibovitz L-15培养基、Keratinocyte-SFM培养基均购自南京信帆生物技术有限公司。DNA提取试剂盒、EpiTect亚硫酸氢盐试剂盒、EpiTect MethyLight PCR试剂盒购自Qiagen公司,LipofectamineTM3000试剂盒及引物购自Invitrogen公司;DNMT1-siRNA质粒及空质粒由上海吉玛公司构建;DNMT1、Cyclin D1、β-catenin兔单抗购自CST公司;山羊抗兔IgG(HRP)、c-Myc兔单抗、β-actin兔单抗、SOX1兔单抗、Histone H3兔多抗均购自Abcam公司;电泳仪、多功能酶标仪购自BioRad公司;Rotor-Gene Q PCR仪购自Qiagen公司;显微镜购自Olympus公司。
1.2细胞培养及分组 HeLa229、SiHa细胞采用EMEM培养基[含10%胎牛血清(FBS)],ME-180细胞采用McCoy′s 5a培养基(含10%FBS),SW756细胞采用Leibovitz L-15培养基(含10%FBS),Ect1/E6E7细胞采用Keratinocyte-SFM培养基[含0.1µg/L人重组表皮生长因子(EGF)和10%FBS],置于5%CO2培养箱中(37℃)培养,收集对数期以上宫颈细胞,设置为HeLa229组、ME-180组、SiHa组、SW756组和Ect1/E6E7组。HeLa229、SW756细胞DNMT1蛋白表达水平较高,收集对数生长期HeLa229、SW756细胞,采用LipofectamineTM3000脂质体将空质粒和DNMT1-siRNA质粒转染入细胞,另设不转染细胞的对照组,即DNMT1-NC组、DNMT1-siRNA组和空白组。
1.3Western blot检测DNMT1、SOX1蛋白表达 通过蛋白裂解液裂解CC组织、癌旁组织及各组细胞并提取总蛋白,BCA法测定所提蛋白的浓度。分别取40μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,随后湿法转印至PVDF膜,经奶粉封闭后与一抗DNMT1(1∶1 000)、Cyclin D1(1∶500)、β-catenin(1∶1 000)、c-Myc(1∶500)、β-actin(1∶5 000)、SOX1(1∶1 000)、Histone H3(1∶2 000)4℃过夜孵育,经TBST洗膜后与二抗羊抗兔IgG(HRP,1∶5 000)室温孵育35 min,ECL法曝光拍照并分析各检测蛋白条带的灰度值。
1.4亚硫酸氢盐定量PCR测定SOX1甲基化水平 通过DNA提取试剂盒提取CC组织、癌旁组织及各组细胞的基因组DNA,并使用EpiTect亚硫酸氢盐试剂盒对其进行修饰,将未甲基化的胞嘧啶转化为尿嘧啶。以修饰后的基因组DNA为模板,使用EpiTect MethyLight PCR试剂盒进行荧光定量PCR扩增反应,甲基化比例=[甲基化DNA的拷贝数/(甲基化+未甲基化DNA的拷贝数)]×100%。SOX1甲基化引物上游5′-GCGTTTTTTTTTTTTCGTTATTGGC-3′,下 游5′-CGC⁃GCTATCTCCTTCCTCCTACG-3′,产物大小154 bp;SOX1未甲基化引物上游5′-TGTGTTTTTTTTTTTTTGTTATTGG-3′,下游5′-TACACACTATCTCCTTCCTCCTACACTC-3′,产物大小156 bp。
1.5细胞克隆实验测定细胞增殖 收集DNMT1-NC组、DNMT1-siRNA组和空白组转染后48 h的细胞,以每孔1×103个的密度接种至6孔板,培养3周后,弃去培养基并固定细胞,用0.5%结晶紫染色后计数可见细胞克隆。
1.6Transwell实验测定细胞迁移和侵袭 收集DNMT1-NC组、DNMT1-siRNA组和空白组转染后48 h的细胞,以每孔含5×104个的密度接种至小室上层,小室下层添加500μL EMEM培养基,培养24 h后,用棉签擦去小室上层的细胞,固定后用0.5%结晶紫染色并拍照,计数穿过小室上层的细胞。侵袭实验除先在上层小室添加100μL基质胶凝固外,其余均参考迁移实验进行。
1.7裸鼠成瘤实验测定细胞在体内的生长 取DNMT1-NC组、DNMT1-siRNA组和空白组转染后48 h的HeLa229和SW756细胞,经胰蛋白酶消化分离后,计数细胞数量并制备1.0×107个/mL的细胞悬液。将上述各组细胞注射进裸小鼠的腋窝外侧皮下,裸小鼠分为DNMT1-NC组、DNMT1-siRNA组和空白组,每组6只。每3 d观察1次腋窝处肿瘤大小,3周后处死小鼠并取出肿瘤称质量。
1.8统计学方法 采用GraphPad 8.0对数据进行分析。计量数据以均数±标准差(±s)表示,2组间数据比较采用t检验,多组数据比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 CC组织及细胞中DNMT1、SOX1蛋白表达情况 CC组织中DNMT1蛋白表达水平(3.55±0.62)高于癌旁宫颈组织(1.65±0.27),SOX1蛋白表达水平(0.25±0.06)低于癌旁宫颈组织(2.85±0.74),差异有统计学意义(n=20,t分别为12.565、15.662,均P<0.01),见图1。宫颈癌HeLa229、ME-180、SiHa、SW756细胞中DNMT1蛋白表达水平分别为2.76±0.32、2.57±0.27、2.46±0.39、2.83±0.45,均高于宫颈上皮Ect1/E6E7细胞(1.13±0.04),差异有统计学意义(n=6,F=27.480,P<0.01),SOX1蛋白表达水平分别为0.28±0.04、0.37±0.05、0.35±0.07、0.31±0.05,均低于Ect1/E6E7细胞(2.08±0.19),差异有统计学意义(n=6,F=387.901,P<0.01),见图2。选择DNMT1蛋白表达水平较高的HeLa229、SW756细胞进行后续实验。

Fig.1 DNMT1 and SOX1 protein expression in CC tissues图1 CC组织中DNMT1、SOX1蛋白表达情况
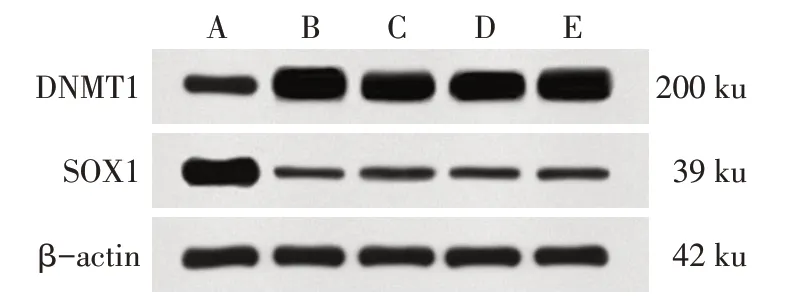
Fig.2 DNMT1 and SOX1 protein expression in CC cells图2 CC细胞中DNMT1、SOX1蛋白表达情况
2.2 CC组织及细胞中SOX1甲基化程度 CC组织中SOX1启动子区甲基化比例(%)高于癌旁宫颈组织(45.37±5.12vs.26.73±4.36;n=20,t=12.396,P<0.01)。宫颈癌HeLa229、ME-180、SiHa、SW756细胞中SOX1启动子区甲基化比例(%)分别为44.46±5.34、38.15±5.26、40.24±6.0、46.85±6.17,均 高 于Ect1/E6E7细胞(21.84±4.72),差异有统计学意义(n=6,F=18.924,P<0.01)。
2.3 敲低DNMT1可抑制CC细胞生长 与空白组、DNMT1-NC组比较,DNMT1-siRNA组HeLa229和SW756细胞体外克隆形成数减少(P<0.05),裸鼠内瘤体质量减轻(P<0.05),见表1、图3。
Tab.1 Comparison of the number of HeLa229 and SW756 cell clones and tumor mass between the three groups表1 各组HeLa229和SW756细胞克隆数及瘤体质量比较(n=6,±s)
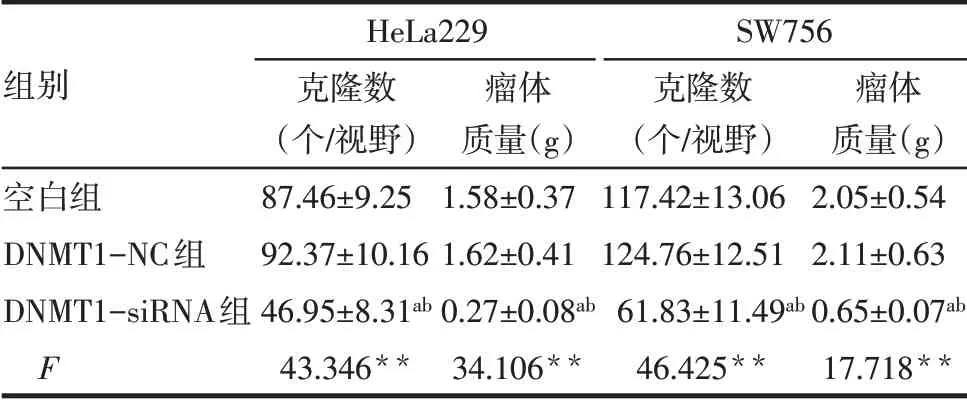
Tab.1 Comparison of the number of HeLa229 and SW756 cell clones and tumor mass between the three groups表1 各组HeLa229和SW756细胞克隆数及瘤体质量比较(n=6,±s)
**P<0.01;a与空白组比较,b与DNMT1-NC组比较,P<0.05;表2~4同
组别空白组DNMT1-NC组DNMT1-siRNA组F HeLa229克隆数(个/视野)87.46±9.25 92.37±10.16 46.95±8.31ab 43.346**瘤体质量(g)1.58±0.37 1.62±0.41 0.27±0.08ab 34.106**SW756克隆数(个/视野)117.42±13.06 124.76±12.51 61.83±11.49ab 46.425**瘤体质量(g)2.05±0.54 2.11±0.63 0.65±0.07ab 17.718**
2.4 敲低DNMT1可抑制CC细胞迁移和侵袭 与空白组、DNMT1-NC组比较,DNMT1-siRNA组HeLa229和SW756细胞迁移和侵袭数量减少(P<0.05),见表2、图4。
Tab.2 Comparison of the migration and invasion numbers of HeLa229 and SW756 cells between the three groups表2 各组HeLa229和SW756细胞迁移及侵袭数量比较(n=6,个/视野,±s)
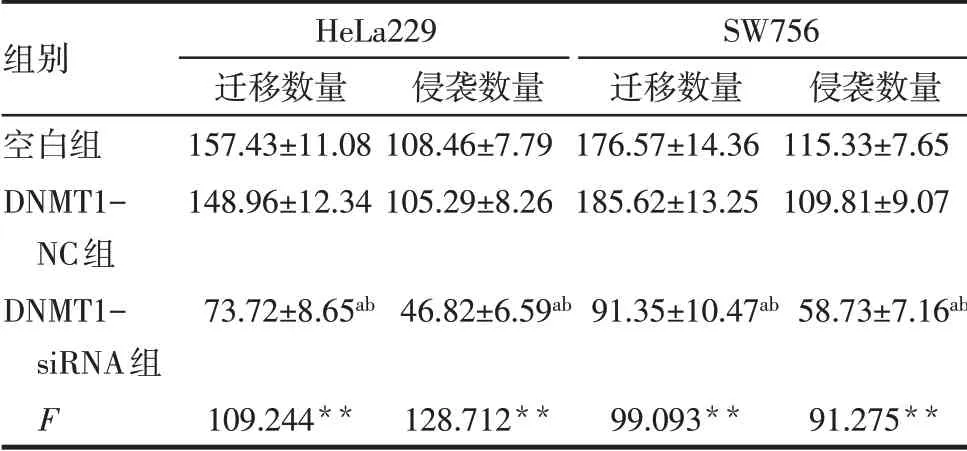
Tab.2 Comparison of the migration and invasion numbers of HeLa229 and SW756 cells between the three groups表2 各组HeLa229和SW756细胞迁移及侵袭数量比较(n=6,个/视野,±s)
组别空白组DNMT1-NC组DNMT1-siRNA组F HeLa229迁移数量157.43±11.08 148.96±12.34 73.72±8.65ab 109.244**侵袭数量108.46±7.79 105.29±8.26 46.82±6.59ab 128.712**SW756迁移数量176.57±14.36 185.62±13.25 91.35±10.47ab 99.093**侵袭数量115.33±7.65 109.81±9.07 58.73±7.16ab 91.275**
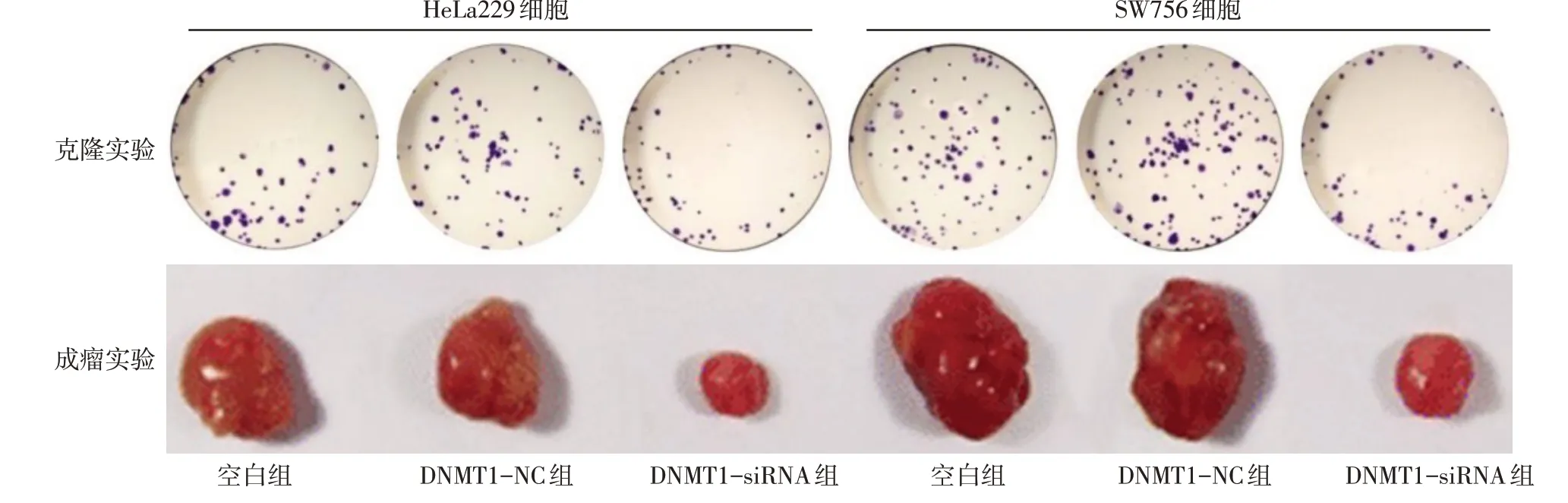
Fig.3 The cell growth detected by cell cloning and nude mouse tumor formation experiments in the six groups图3 细胞克隆和裸鼠成瘤实验检测各组细胞生长情况
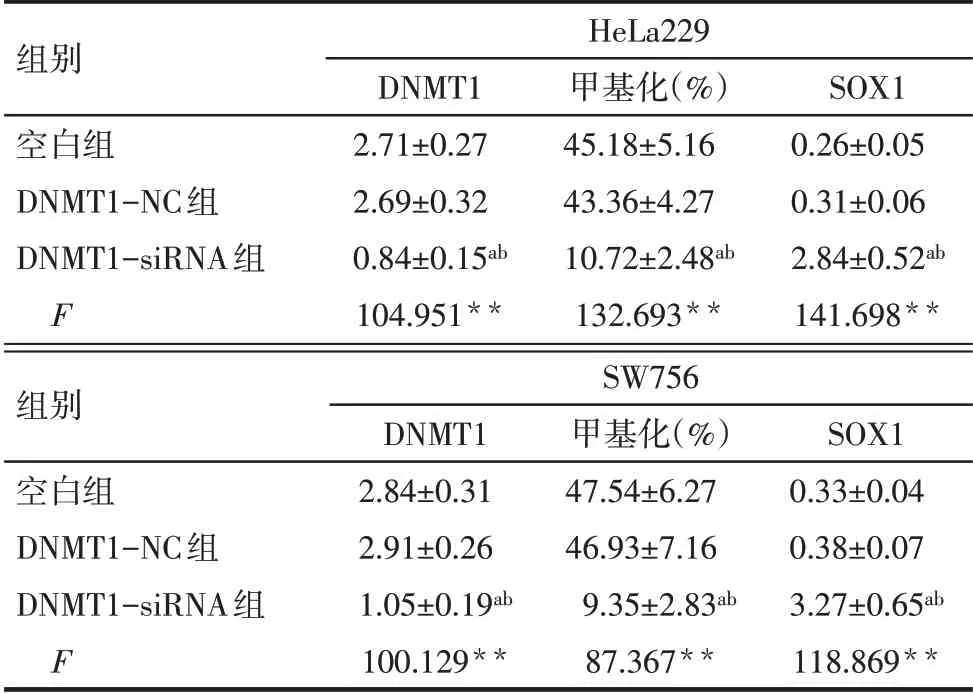
2.5 敲低DNMT1对DNMT1、SOX1蛋白表达及SOX1甲基化的影响 与空白组、DNMT1-NC组比较,DNMT1-siRNA组HeLa229和SW756细胞DNMT1蛋白表达及SOX1启动子区甲基化比例降低,SOX1蛋白表达增加(P<0.05),见图5、表3。
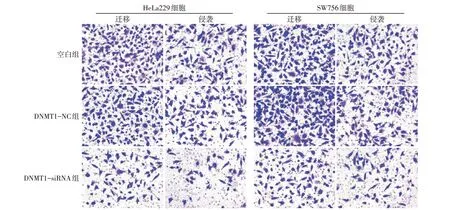
Fig.4 The cell migration and invasion detected byTranswell experiment in the three groups(crystal violet staining,×200)图4 Transwell实验检测各组细胞迁移和侵袭情况(结晶紫染色,×200)
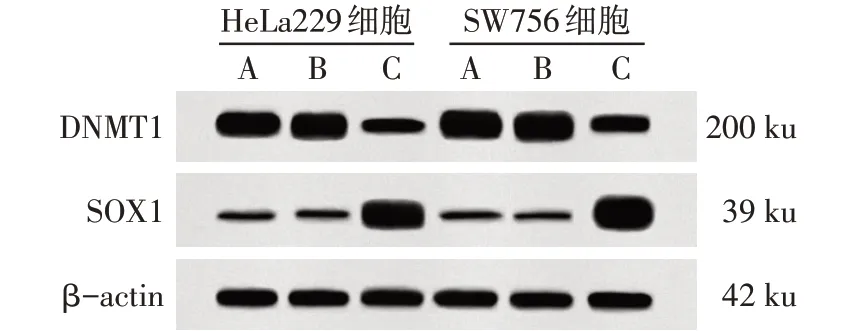
Fig.5 SOX1 and DNMT1 protein expression in each group of cells图5 各组细胞中SOX1、DNMT1蛋白表达情况
Tab.3 Comparison of SOX1 methylation and DNMT1 and SOX1 protein expression in HeLa229 and SW756 cells between the three groups表3 各组HeLa229和SW756细胞SOX1甲基化和DNMT1、SOX1蛋白表达的比较(n=6,±s)
Tab.3 Comparison of SOX1 methylation and DNMT1 and SOX1 protein expression in HeLa229 and SW756 cells between the three groups表3 各组HeLa229和SW756细胞SOX1甲基化和DNMT1、SOX1蛋白表达的比较(n=6,±s)
组别空白组DNMT1-NC组DNMT1-siRNA组F SW756 DNMT1 2.84±0.31 2.91±0.26 1.05±0.19ab 100.129**甲基化(%)47.54±6.27 46.93±7.16 9.35±2.83ab 87.367**SOX1 0.33±0.04 0.38±0.07 3.27±0.65ab 118.869**组别空白组DNMT1-NC组DNMT1-siRNA组F HeLa229 DNMT1 2.71±0.27 2.69±0.32 0.84±0.15ab 104.951**甲基化(%)45.18±5.16 43.36±4.27 10.72±2.48ab 132.693**SOX1 0.26±0.05 0.31±0.06 2.84±0.52ab 141.698**
2.6 敲低DNMT1可抑制Wnt/β-catenin通路蛋白表达 与空白组、DNMT1-NC组比较,DNMT1-siRNA组HeLa229和SW756细胞c-Myc、Cyclin D1蛋白表达减少,核/质β-catenin下降(P<0.05),见图6、表4。
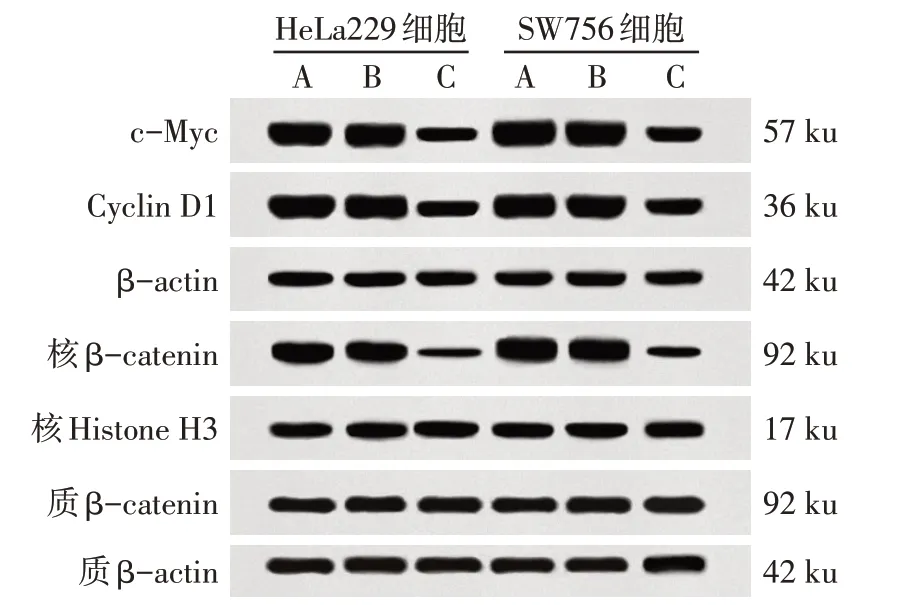
Fig.6 Expression of c-Myc,Cyclin D1 andβ-catenin protein in each group of cells图6 各组细胞中c-Myc、Cyclin D1、β-catenin蛋白表达情况
3 讨论
DNA甲基化是表观遗传修饰的重要形式,全基因组低甲基化和局部基因尤其是肿瘤抑制基因高甲基化在癌症组织中较为常见,在癌症进展过程中,启动子的高甲基化会引起不同的肿瘤抑制基因失活,进而调节基因转录表达[10]。DNMT1为维持甲基化的重要酶,目前已在多种肿瘤中检测到DNMT1的高表达,发挥肿瘤促进作用,其中DNMT1在肿瘤前病变到胰腺癌进展过程中表达逐渐增加,可通过维持肿瘤抑制基因启动子高甲基化抑制其表达,进而促进癌细胞增殖、侵袭并诱导胰腺癌干细胞的自我更新,有望成为胰腺癌的治疗靶标[11]。在由良性胃炎到早期的癌前病变,再到胃肠道癌的过程中,DNMT1也显示表达逐渐增强的趋势[12]。Tzelepi等[13]在前列腺癌中亦发现,DNMT1高表达,且在淋巴结转移病例中表达更高,参与肿瘤进展过程的调控。另有研究显示,DNMT1在大肠癌中高表达,敲除DNMT1可通过提高抑癌基因DYRK2的表达,抑制结直肠癌细胞增殖[14],也可通过降低miR-152-3p的甲基化抑制TMSB10表达,抑制结直肠癌生长[15]。与Cao等[6]研究一致,本研究也在CC组织和细胞系中检测到DNMT1高表达,敲低DNMT1可抑制HeLa229和SW756细胞的迁移、侵袭,并在体外和体内均可抑制两者的增殖,表明在CC进展中DNMT1发挥促进肿瘤作用,但其机制尚需研究。
Tab.4 Comparison of c-Myc,Cyclin D1 andβ-catenin protein expression in HeLa229 and SW756 cells between the three groups表4 各组HeLa229和SW756细胞c-Myc、Cyclin D1、β-catenin蛋白表达比较 (n=6,±s)

Tab.4 Comparison of c-Myc,Cyclin D1 andβ-catenin protein expression in HeLa229 and SW756 cells between the three groups表4 各组HeLa229和SW756细胞c-Myc、Cyclin D1、β-catenin蛋白表达比较 (n=6,±s)
组别空白组DNMT1-NC组DNMT1-siRNA组F HeLa229 c-Myc 2.53±0.16 2.46±0.23 1.02±0.09ab 150.991**Cyclin D1 2.16±0.15 2.21±0.18 0.84±0.05ab 189.293**核/质β-catenin 1.36±0.14 1.29±0.18 0.54±0.05ab 68.246**组别空白组DNMT1-NC组DNMT1-siRNA组F SW756 c-Myc 2.82±0.24 2.93±0.18 1.25±0.12ab 152.232**Cyclin D1 2.31±0.15 2.37±0.17 1.16±0.11ab 131.820**核/质β-catenin 1.57±0.16 1.46±0.21 0.73±0.15ab 40.692**
SOX蛋白为一类由SOX基因编码的调节性转录因子,可在致癌过程中充当肿瘤抑制因子[16]。SOX1在肝癌等肿瘤中发挥抑癌作用,其低表达与患者预后不良和肿瘤进展相关[17]。SOX1在鼻咽癌细胞系和组织中均表达下调,过表达SOX1可以减弱细胞增殖和迁移,促进细胞分化和衰老[18]。本研究中,SOX1启动子区甲基化比例在CC组织和细胞系中均较高,SOX1蛋白表达均下调,与Huang等[9]报道一致。敲低DNMT1后发现,HeLa229和SW756细胞中SOX1启动子区甲基化比例降低,SOX1蛋白表达增加,推测SOX1可能是DNMT1的作用靶点。SOX1在乳腺癌[19]、鼻咽癌[18]、CC[20]中可调节Wnt/β-catenin通路介导的细胞增殖和侵袭,过表达SOX1可抑制上述肿瘤发展。Lin等[20]认为,SOX1在CC中通过抑制Wnt/β-catenin信号通路发挥肿瘤抑制作用;而本研究显示,敲低DNMT1可使得HeLa229和SW756细胞中c-Myc、Cyclin D1及核/质β-catenin蛋白表达减少,提示敲低DNMT1可能抑制Wnt/β-catenin信号通路,推测下调DNMT1表达可能通过降低SOX1启动区甲基化程度并上调其蛋白表达,从而抑制Wnt/β-catenin通路介导的CC生长和转移。
综上所述,DNMT1在CC组织和细胞中高表达,可能通过维持SOX1启动区高甲基化并抑制其蛋白表达,促进CC生长和转移。然而,DNMT1不只调控单一基因的转录和表达,CC生长和转移也不只通过SOX1调节。本研究仅揭示了DNMT1可能通过调节SOX1对CC生长和转移的作用,后续还需重复验证,同时继续研究DNMT1对其他抑癌基因的作用。

