不同栽培模式对猪肚菇子实体农艺性状及品质的影响
李巧珍,沈秀芬,张美彦,尚晓冬,张 丹,于海龙,*
(1 国家食用菌工程技术研究中心,农业部应用真菌资源与利用重点开放实验室,上海市农业科学院食用菌研究所,上海 201403;2 食药用菌教育部工程研究中心,吉林农业大学,长春 130018)
猪肚菇(Pleurotus giganteus)又名大革耳,隶属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、伞菌目(Agaricales)、侧耳科(Pleurotaceae)、侧耳属(Pleurotus)[1],在中国、马来西亚、斯里兰卡、印度尼西亚、越南、老挝、泰国等均有栽培记载[2]。 其子实体含有丰富的碳水化合物、蛋白质及钾、磷等大量元素和铜、锰、铁、锌等微量元素以及必需氨基酸[3]和丰富的多糖[4],含有抗氧化[3]、抗真菌[5]、保肝[6]、抗炎症[7]、抗糖尿病[8]、抗肿瘤[9]、刺激神经突起生长[10]等活性成分。 猪肚菇是一种珍稀食药用菌种类,作为一种中高温栽培品种,具有重要的科研和应用价值。
我国猪肚菇栽培最早由福建省三明真菌研究所驯化成功,因其口感风味独特,有猪肚般的滑腻,其商品名被称为“猪肚菇”。 近年来猪肚菇栽培逐步由广东、福建等地向浙江、山东、北京等地扩大,因其可作为夏季高温季节栽培品种,且味道鲜美,越来越受到食用菌生产者的重视和消费者喜爱。 我国猪肚菇栽培主要以脱袋覆土(简称埋土)的栽培模式为主,该方法具有控温保湿效果好、管理简单等优点,但是存在土地利用率低、易受病虫害影响等劣势;近年来袋内覆土(简称覆土)模式逐步出现[11-12],该模式有利于设施立体栽培,提高空间利用率,实现工厂化栽培。 目前,关于不同栽培模式对猪肚菇子实体主要农艺性状、营养品质及安全性的评价还缺乏详细研究。 本研究以17 个猪肚菇菌株为材料,考察埋土和覆土两种栽培模式下17 个菌株的8 个子实体农艺性状,并选取具有代表性的2 个菌株进行粗蛋白、粗多糖、粗脂肪和粗纤维含量以及砷、镉含量的比较分析,以期为猪肚菇DUS 测试工作的开展以及栽培生产技术的提升提供理论依据。
1 材料与方法
1.1 试验材料
供试菌株及来源如表1 所示。

表1 供试菌株Table 1 Varieties for test
1.2 试验方法
1.2.1 子实体栽培
按照牛贞福等[11]的栽培方法,采用脱袋覆土(简称埋土)和袋内覆土(简称覆土)两种栽培模式对17个猪肚菇菌株进行栽培(图1)。
1.2.2 农艺性状测试
测试不同栽培模式下出菇过程中子实体的8 个主要农艺性状(表2),子实体各部分名称及测试方法如图2 所示。 子实体生长至商品采收期时采收,测量子实体的质量;将子实体从菌盖与菌柄连接处分开,测量菌盖部分的质量;菌盖的直径为子实体菌盖最长部位之间的长度。

表2 子实体数量性状Table 2 Quantitative characteristics investigated fruiting bodies

图2 猪肚菇子实体各部分名称及测试方法Fig.2 Definition and test method of each part of Panus giganteus fruiting body
1.2.3 营养成分及砷镉含量测定
将子实体菌盖和菌柄分别切下,放入烘箱中烘至恒重,粉碎过80 目(孔径180 μm)筛,进行各成分含量测定。 粗蛋白含量:参照 GB∕T 15673—2009《食用菌中粗蛋白含量的测定》测定[13];粗多糖含量:参照NY∕T 1676—2008《食用菌中粗多糖含量的测定》测定[14];粗脂肪含量:参照 GB∕T 5009.62016《食品中脂肪的测定》测定[15];粗纤维含量:参照 GB∕T 5009.10—2003《植物类食品中粗纤维的测定》测定[16];砷含量:参照GB∕T 5009.11—2014《食品中总砷及无机砷的测定》测定[17];镉含量:参照GB∕T 5009.15—2014《食品中镉的测定》测定[18]。
1.2.4 数据分析
运用Excel 2010 和SPSS 25 软件对数据进行分析。
2 结果与分析
2.1 不同栽培模式对子实体数量性状表达的影响
表3 结果表明,在测定的17 个菌株中,有4 个菌株(1,8,16,17)的8 个数量性状表达不受栽培模式的影响,其余菌株均有部分性状表达存在差异。 8 个菌株(2,4,7,11,12,13,14,15)的产量性状表达差异达显著水平,7 个菌株(2,4,5,10,11,12,13)的菌盖质量性状表达差异达显著水平,5 个菌株(2,3,4,10,12)的菌盖直径性状表达差异达显著水平,8 个菌株(3,4,6,7,10,12,13,14)的菌盖厚度性状表达差异达显著水平,5 个菌株(2,6,7,10,14)的菌褶宽度性状表达差异达显著水平,9 个菌株(2,4,5,7,9,11,12,13,15)的菌柄长度性状表达差异达显著水平,4 个菌株(3,4,5,11)的菌柄厚度性状表达差异达显著水平。 从菌盖质量占子实体产量的比例来看,两种栽培模式下大部分菌株的表现差异不显著,少部分菌株(2,6,10,13)在埋土的方式下菌盖所占比重更大。 埋土和覆土两种栽培模式下,17 个菌株的产量平均变异系数分别为47.44%和48.46%;菌盖质量平均变异系数分别为53.26%和53.14%;菌盖直径平均变异系数分别为25.28%和23.29%;菌盖厚度平均变异系数分别为23.03%和25.11%;菌褶宽度平均变异系数分别为29.09%和29.76%;菌柄长度平均变异系数分别为18.38%和19.67%;菌柄厚度平均变异系数分别为28.38%和28.80%;菌盖质量∕子实体产量的平均变异系数分别为29.12%和30.51%,总体来说,两种栽培模式下菌株内的各个性状的变异系数无显著性差异。
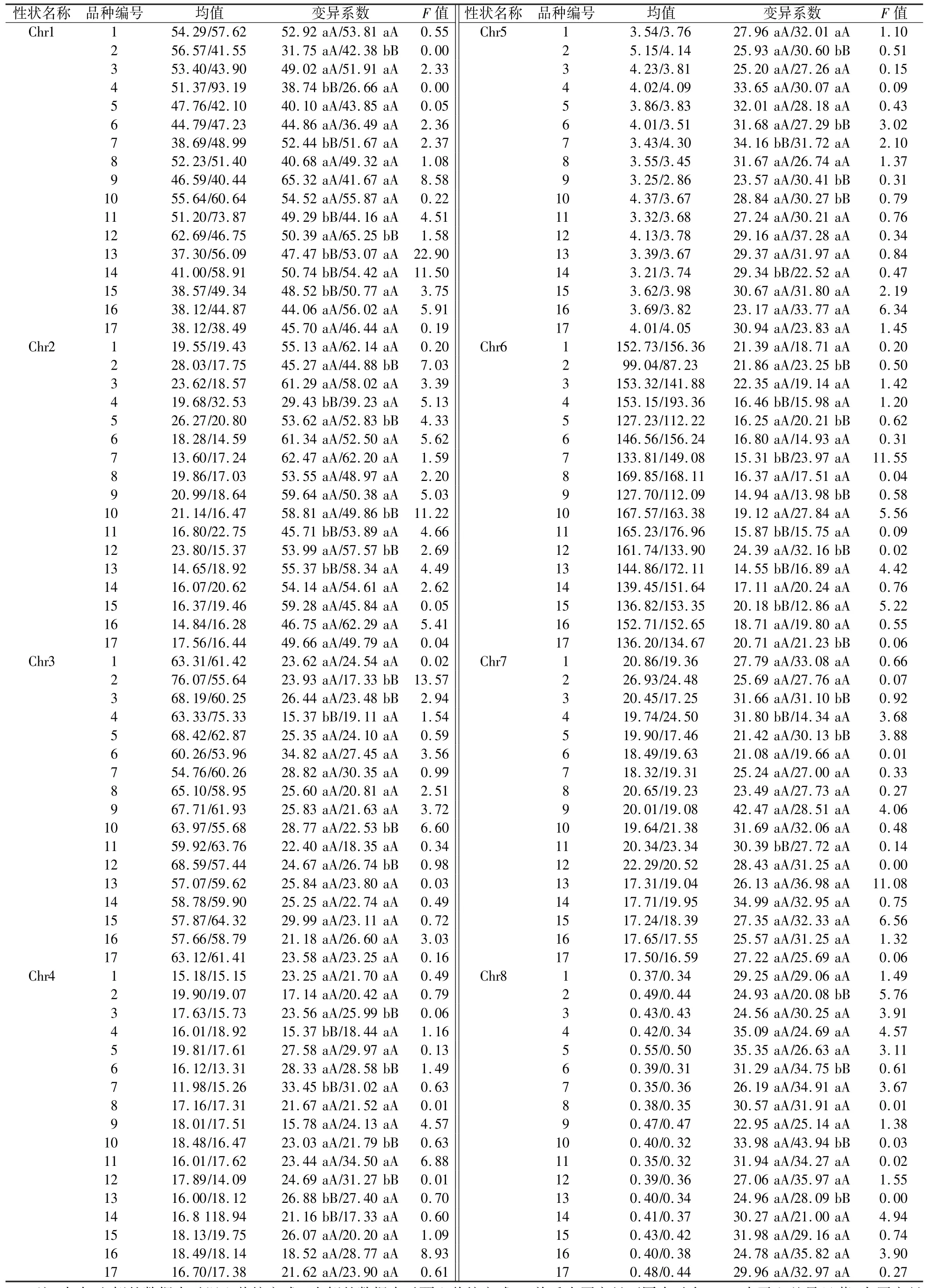
表3 埋土和覆土栽培模式下子实体数量性状表达差异Table 3 Differences in the expression of quantitative characteristics between two cultivation modes of buried soil and covered soil
2.2 不同栽培模式对子实体菌盖部位营养成分的影响
由表4 可见,两种栽培模式下菌株之间的粗纤维含量无显著性差异,覆土模式下粗纤维含量略高;在覆土模式下,菌株的粗脂肪含量显著低于埋土模式下的含量;6 号菌株的粗蛋白含量在两种栽培模式下无显著性差异,12 号菌株的粗蛋白含量在覆土模式下略低;6 号菌株的粗多糖含量在覆土模式下显著高于埋土模式下的含量,12 号菌株的粗多糖含量在两种栽培模式下无显著性差异。
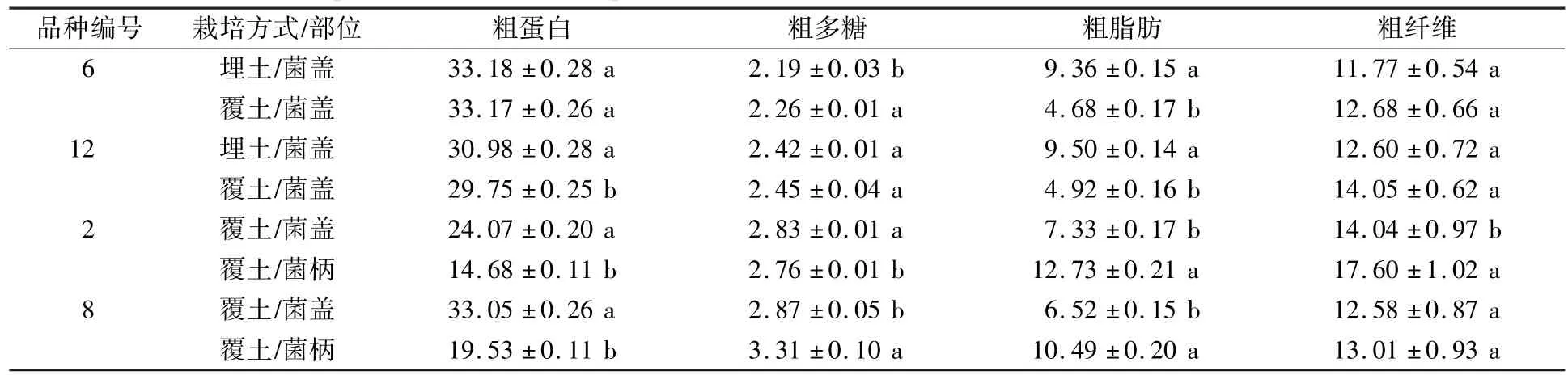
表4 埋土和覆土栽培模式下子实体营养成分比较Table 4 Comparison of nutritive components between two cultivation modes of buried soil and covered soil %
选取2 号和8 号菌株覆土模式下菌盖、菌柄部位,对其营养成分含量进行了测定。 两个菌株菌盖中的粗蛋白含量显著高于菌柄中的含量;菌盖中粗脂肪含量显著低于菌柄中的含量;菌柄中粗纤维的含量高于菌盖中的含量;2 号菌株菌盖中的粗多糖含量显著高于菌柄中的含量,而8 号菌株菌盖中的粗多糖含量显著低于菌柄中的含量。
2.3 不同栽培模式对子实体重金属含量的影响
选取6 号和8 号菌株,对两种栽培模式下菌株菌盖的砷、镉含量进行测定。 由表5 可见,两种栽培模式下菌株之间的砷含量无显著性差异;在覆土模式下,2 个菌株的镉含量显著低于埋土模式下的含量。

表5 埋土和覆土栽培模式下砷、镉含量比较Table 5 Comparison of arsenic and cadmium contents between two cultivation modes of buried soil and covered soil mg·kg -1
3 讨论
不同栽培模式对猪肚菇的生长和测试性状的表达有一定程度的影响,在测试的17 个菌株中有4 个菌株的测试农艺性状表达不受栽培模式的影响,大部分菌株的农艺性状表达均会受栽培模式的影响。 两种栽培模式下菌株内各个性状的变异系数无显著性差异,说明两种栽培模式的环境对菌株的数量性状表达的影响是相同的。 两种模式下菌株内的产量和菌盖质量的变异系数较大,这两个形状在作为DUS 测试性状时应谨慎选择或作为选测性状。 由于目前猪肚菇生产存在多种模式,品种性状DUS 测试可以选择其中任何一种栽培模式,但是在研制指南的过程中必须指定一种栽培模式,才能保证性状表达的一致性。
不同栽培模式对猪肚菇的营养品质和安全性均会产生一定的影响,栽培模式对猪肚菇子实体菌盖中粗脂肪的积累影响最大,覆土栽培模式有利于降低猪肚菇中粗脂肪的含量,提高粗纤维含量,且在覆土模式下,菌盖相比菌柄更具有高蛋白、低脂肪的特点,菌柄相比菌盖更具有高纤维的特点。 两种栽培模式下子实体对重金属砷和镉均有一定的富集,且猪肚菇对镉的富集能力要高于砷,在生产中应引起重视。 覆土和埋土两种模式猪肚菇子实体对砷的富集水平相同,但覆土模式能有效降低子实体中镉的含量,另外,覆土栽培更易于实现立体栽培,有利于提高单位面积栽培数量,提高出菇产量。

