摄碘阳性的分化型甲状腺癌淋巴结转移灶131I疗效分析
梅晓然,冯 方,王 辉,韦智晓
1.广西医科大学第一附属医院核医学科,广西 南宁 530021;
2.上海交通大学医学院附属新华医院核医学科,上海 200092
甲状腺癌是内分泌系统最常见的恶性肿瘤,近年来,甲状腺癌的发病率逐年增高,其中,分化型甲状腺癌(differentiated thyroid carcinoma,DTC)占90%以上[1]。大多数DTC预后良好,通过手术切除+131I治疗+促甲状腺激素(thyroid stimulating hormone,TSH)抑制治疗可以治愈,但约35%的DTC患者在初次诊断时存在淋巴结转移(lymph node metastasis,LNM),而残余的转移淋巴结是疾病持续及复发的最常见风险因素[1]。此外,肿瘤通过转移淋巴结向外延伸与疾病持续状态及复发风险的增加有关[1]。
LNM的治疗方式首选手术清扫,但对于首次术后残留的LNM,特别是在首次清甲之后发现的具有摄取131I能力的LNM,其治疗方式尚存在争议。二次手术必然增加局部损伤的风险,影响生活质量。进一步大剂量131I治疗是一个可选的方式,但效果及长期预后尚不明确。还有一部分无法完全手术切除的患者,只能选择131I治疗或其他治疗手段。因此,本研究通过筛选首次清甲过程中发现具有摄碘阳性LNM的DTC患者,进一步进行大剂量131I治疗,明确疗效并分析相关的影响 因素。
1 资料和方法
1.1 研究对象
在2015年1月—2019年6月于上海交通大学医学院附属新华医院核医学科住院接受131I治疗的DTC患者中,筛选首次131I治疗后全身扫描(whole body scan,WBS)+单光子发射计算机体层成像(single photon emission computed tomography,SPECT)/计算机体层成像(computed tomography,CT)发现存在单个或多个摄碘阳性LNM的患者。所有患者均已经行甲状腺全切除术或次全切除术,伴或不伴颈部淋巴结清扫。病理学检查证实为甲状腺乳头状癌(papillary thyroid carcinoma,PTC)或滤泡状癌(follicular thyroid carcinoma,FTC)。摄碘阳性淋巴结诊断标准:131I治疗后WBS发现甲状腺床外有碘浓聚病灶,行SPECT/CT明确为LNM。对于无法明确分辨是否为残留甲状腺或LNM的病例,本研究予以排除。在纳入研究的90例患者中,共有161个摄碘阳性淋巴结。对患者信息、原发肿瘤/淋巴结的特征及131I治疗的细节等相关临床资料及影像学特征进行分析。
1.2 疗效分类方法
根据2015年美国甲状腺协会(American Thyroid Association,ATA)指南[2],结合生化和影像学结果,将患者分为4种治疗反应类型:
①疗效满意(excellent response,ER):抑制性甲状腺球蛋白(thyroglobulin,Tg)< 0.2 ng/mL或刺激性Tg<1.0 ng/mL,影像学检查结果均为阴性;② 疗效不确切(indeterminate response,IDR):抑制性Tg<1.0 ng/mL或刺激性Tg<10.0 ng/mL,在无结构性病变或功能性病变时Tg抗体(Tg antibody,TgAb)稳定或呈下降趋势,影像学检查未见特异性病变,治疗后诊断性131I全身显像可见甲状腺床轻度摄碘;③生化疗效不佳(biochemical incomplete response,BIR):抑制性Tg≥1.0 ng/mL或刺激性Tg≥ 10.0 ng/mL或TgAb呈上升趋势,影像学检查结果均为阴性;④ 结构性疗效不佳(structural incomplete response,SIR):血清Tg或TgAb呈任何水平,影像学检查证实或功能性病灶存在。根据治疗结果将随访患者分为两组:131I有效组包括ER和IDR患者,131I无效组包括BIR和SIR 患者。
1.3 随访
131I治疗后每6~ 9个月随访1次,并对患者的病情进行评估,在进行相关的影像学和血清学检查后,如有必要,患者将接受再次的131I治疗。在第4次治疗后,随访间隔时间将延长至12个月。评估结果良好的患者也在最后1次治疗后每年复查1次。
1.4 统计学处理
采用SPSS 24.0软件对数据进行分析。使用χ2检验、t检验和logistic多因素回归分析来评估有效组和无效组之间的特征差异。建立多个定量指标与131I无效之间关系的受试者工作特征(receiver operating characteristic,ROC)曲线,确定最佳诊断阈值。P<0.05为差异有统计学意义。
2 结果
2.1 患者及原发肿瘤灶的特征
本研究共纳入90例患者,中位年龄为43.52岁,其中女性54例,男性36例。患者最后1次手术至首次131I治疗之间的间隔时间为(2.2±1.4)个月(1~ 10个月)。患者所接受的131I治疗次数有所不同:其中22例患者接受过1次131I治疗,43例患者接受过2次131I治疗,20例患者接受过3次131I治疗,4例患者接受过4次131I治疗,仅1例患者接受了6次131I治疗。
研究共纳入161枚摄碘阳性淋巴结,其中131I治疗有效淋巴结71枚(44.10%),131I治疗无效淋巴结90枚(55.90%)。有效组与无效组在年龄、性别、原发病灶病理学类型、原发病灶个数、有无远处转移及血清Tg水平等方面差异均有统计学意义(P<0.05,表1)。

表1 患者及原发肿瘤灶的特征Tab.1 Characteristics of patients and primary tumor
在131I有效组的71枚淋巴结中,44枚(62%)来自女性患者。24枚(34%)来自年龄低于45岁的患者,47枚(66%)来自45岁及以上的患者。65枚(92%)来自原发病灶病理学类型为PTC的患者,6枚(8%)来自原发病灶病理学类型为FTC的患者。
在131I无效组的90枚淋巴结中,42枚(47%)来自女性患者。45枚(50%)来自年龄低于45岁的患者,45枚(50%)来自45岁及以上的患者。89枚(99%)来自原发病灶病理学类型为PTC的患者,仅1枚(1%)来自原发病灶病理学类型为FTC的患者。
统计结果显示,原发病灶累及双侧甲状腺叶或伴有直径<1 cm的微小癌的患者,其131I治疗无效的可能性明显高于原发肿瘤位于单侧甲状腺叶或不伴有微小癌的患者(χ2分别为0.015和0.025),差异均有统计学意义(P<0.01)。同时,来自无远处转移的患者的淋巴结对131I治疗有更好的反应(P<0.001)。
131I治疗无效患者的血清Tg水平[(341.17± 377.94)ng/mL]明显高于131I治疗有效患者[(121.41±247.27)ng/mL,P<0.001]。
2.2 转移淋巴结对131I治疗反应的预测因素
本研究结果显示,患者的性别、年龄、原发病灶病理学类型、原发肿瘤的位置和数量都是影响治疗结果的潜在因素。根据患者的血清Tg水平和患者是否有远处转移也可以预测疗效。因此,本研究进一步分析并找出了多种因素与疗效间的相关性,详见表2。
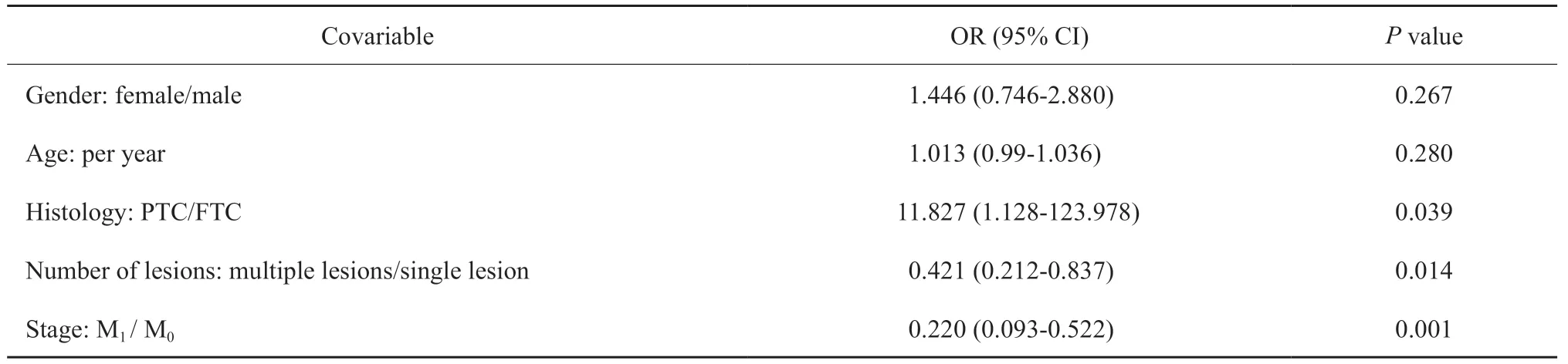
表2 有效治疗概率的logistic回归分析Tab.2 Logistic regression analysis of the probability of effective treatment
多因素logistic回归分析显示,原发病灶病理学类型(OR=11.827,95% CI:1.128~ 123.978,P=0.039)、有无远处转移(OR=0.220,95% CI:0.093~ 0.522,P=0.002)和原发病灶数量(OR=0.421,95% CI:0.212~ 0.837,P=0.014)与131I治疗反应密切相关。
阳性治疗反应在FTC患者中更为普遍,FTC患者实现有效治疗的可能性是PTC患者的11.8倍。目前已知存在远处转移是DTC复发的危险因素[3-4],与本研究结果一致:远处转移患者131I治疗失败的风险是无远处转移患者的近4倍。多因素分析还显示,原发肿瘤为单灶性的DTC患者治疗失败的风险明显低于多灶性甲状腺癌患者。综上所述,131I治疗LNM有效的积极因素是原发肿瘤为单个病灶、原发肿瘤病理学类型为FTC和患者无远处转移。
2.3 血清Tg水平对131I治疗效果的预测价值
虽然某些可能具有临床意义的因素在多因素分析中没有得到差异有统计学意义的结果,但我们不能忽视其重要作用。其中一个因素就是血清Tg水平。因此,本研究进行了队列内分层后重新分析数据,并在此基础上描绘并利用ROC曲线计算出有效队列与无效队列之间的诊断阈值。所得ROC曲线结果见图1。
血清Tg水平的ROC曲线如图1A所示。ROC曲线的曲线下面积(area under curve,AUC)为0.77(95% CI:0.688~ 0.853)。当血清Tg水平为66.67 ng/mL时,最大约登指数为0.541,相应的灵敏度和特异度分别为79.5%和74.6%。
考虑到伴有远处转移的患者平均血清Tg水平普遍明显较高,我们将每个队列又分为有远处转移和无远处转移两组。分析发现,当患者不伴有远处转移时,有效队列和无效队列患者的血清Tg值有显著性差异。ROC曲线如图1B所示。AUC为0.68(95% CI:0.688~ 0.853)。当血清Tg值为43.51 ng/mL时,最大约登指数为0.504,相应的灵敏度和特异度分别为74.5%和75.9%。

图1 患者血清Tg水平的ROC曲线Fig.1 ROC curve of serum Tg level in patients
根据上述分析结果,我们可以用66.67 ng/mL作为血清Tg诊断阈值,粗略估计131I对LNM的治疗效果。当1个淋巴结来自血清Tg>66.67 ng/mL的患者时,该淋巴结的131I疗效不佳可能性较高。对于来自无远处转移患者的DTC转移淋巴结,用43.51 ng/mL作为诊断阈值可能更准确。在此基础上,患者血清Tg水平越高,此患者来源的DTC转移淋巴结疗效不佳的风险越高。
2.4 18F-FDG PET/CT对131I治疗效果的预测价值
本研究测量了一些18F-FDG PET/CT的影像学相关指标,包括淋巴结的最大直径、SUVmax、淋巴结的位置和数目。通过ROC曲线的描绘和计算,发现一个有意义的指标:PET/CT中测量出的淋巴结直径ROC曲线如图2所示,AUC为0.587(95% CI:0.497~ 0.677)。以16.8 mm为淋巴结直径的诊断阈值时,灵敏度为32.1%,特异度为85.5%(阳性实际状态:治疗无效)。对此,本研究进一步用该界值为分组标准进行χ2检验,发现以16.8 mm为诊断阈值时,差异有统计学意义(P=0.03)。

图2 18F-FDG PET/CT中测得的转移淋巴结最大径的ROC曲线Fig.2 ROC curve of maximum diameter of metastatic lymph nodes measured by 18F-FDG PET/CT
获得该诊断阈值后,我们用χ2检验对本研究的两个队列进行了验证,结果差异有统计学意义(P<0.05)。因此,我们推测PET/CT所测得的淋巴结最大直径可以作为预判转移淋巴结的疗效标准,当最大径大于16.8 mm时,转移淋巴结治疗结果偏向于无效。并且伴随淋巴结最大径的增大,治疗无效的可能性也同时增大。
3 讨论
本研究发现,摄碘阳性淋巴结131I治疗总体有效率为44.1%。Ilhan等[5]研究显示,88%的DTC摄碘阳性LNM被放射性碘成功治疗。但该研究中的残余甲状腺和转移淋巴结的判断仅基于治疗后的WBS显像,SPECT/CT和超声均未应用到,因此存在假阳性可能[6]。且在该研究中,有1个以上LNM的患者较少,无法分析淋巴结数量这一变量的价值。Schmidt等[7]曾对首次放射消融时131I-SPECT/CT显示的碘阳性LNM患者和非碘阳性LNM患者进行过5个月随访,其中碘阳性LNM(n=19)或未确定病变(n=1)的17例患者中,5个月后未检测到131I阳性LNM(有效率为80%)。与本研究相比,该研究的随访时间较短且样本量较少,可能是造成其有效率较高的原因。
本研究发现,131I治疗无效与原发病灶为多灶性、伴有远处转移、病理学类型为PTC、血清Tg水平、LNM的长径等因素有关。
Tg可以用于反映滤泡细胞的负荷[8],较高的Tg水平也可能间接表明了转移淋巴结内肿瘤细胞的高度活跃状态,或反映出更广泛的微观疾病[9],导致对低活性131I的反应减弱。有研究[10]发现,治疗前刺激性Tg水平升高和伴有远处转移与131I清灶的疗效不佳有关。Ren等[11]研究显示,伴有远处转移的患者治疗前刺激性Tg水平高于无远处转移组,且治疗前刺激性Tg水平与远处转移呈正相关(r=0.599,P=0.000),这一结论与本研究结果一致。随后ROC曲线分析显示,治疗前刺激性Tg在治疗远处转移中具有良好的诊断性能(AUC=0.964,P=0.000),最佳阈值为61.87 ng/mL。本研究根据远处转移情况分组后发现的Tg阈值为66.67 ng/mL(有/无远处转移)和43.51 ng/mL(无远处转移)也与之相符。
在本研究中,PTC与FTC相比,摄碘阳性LNM显现出了疗效不佳的倾向,FTC尽管预后相对较差,更容易发生血行转移如骨转移,但转移早、摄碘能力较好,因此仅发生LNM时131I治疗效果要优于PTC。BRAF突变是PTC中最常见的遗传事件[12],最常见的是BRAFV600E突变[13]。研究证实,PTC中BRAF突变可能是导致其肿瘤体积较大[14]、多灶性生长[15]、倾向于肺部转移[2]的原因。有研究[16]发现,BRAFV600E突变会导致PTC细胞钠碘同向转运体(Na/I symporter,NIS)启动子的转录活性明显下降,导致摄碘能力下降。另一分化标志蛋白Tg的下降幅度较小,出现细胞的碘亲和力降低,对131I的抵抗力增强,但Tg生成相对保留,这种差异性可以解释WBS阴性患者可检测Tg的情况[17]。
临床上,PTC患者甲状腺内出现≥2个解剖学上分离的病灶被定义为多灶性PTC,多表现为多发性微癌(肿瘤直径不超过1 cm)[18]。多灶性瘤体可能来自于单个恶性克隆体的甲状腺内转移,也可能是伴随着甲状腺内转移的多个独立肿瘤源[19]。与正常的甲状腺滤泡上皮细胞相比,PTC细胞的碘摄取能力下降,转移淋巴结中肿瘤细胞的摄碘能力可能下降更为明显。因此,当LNM体积较大时,由于射线的作用距离有限,131I的吸收量又不足,灶内的恶性细胞并不能完全消除。另外,由于不同病灶间基因背景的不同,不同区域之间的细胞可能在NIS表达、Tg分泌等功能上均有不同程度的差别,从而造成131I的吸收和分布不均匀,使射线的物理杀伤过程存在死角。
在本研究中,有效组与无效组患者原发DTC病灶在18F-FDG PET/CT中SUVmax的差异无统计学意义,可能与甲状腺癌中碘与FDG摄取成反比的触发现象有关。但在PET/CT中测得,当以 16.8 mm为淋巴结直径的诊断阈值时,两组间的疗效差异有统计学意义,淋巴结越大,疗效越差。卢承慧等[20]的相关研究,也表明显影淋巴结的大小是反映预后的指标。然而该研究发现,显影淋巴结长径>5.5 mm者不易达到ER,与我们计算出的阈值相比明显较小,可能是由于该研究中均为治疗前刺激性Tg阴性的LNM,其研究对象在肿瘤的恶性程度上与本研究不同。
利益冲突声明:所有作者均声明不存在利益冲突。

