MAML2基因表达及临床参数与低级别胶质瘤(LGG)患者的诊断及预后价值
李文才,夏少怀,夏学巍,王文波,陈 力
(桂林医学院附属医院 神经外科,广西 桂林 541001)
据2015年国家癌症中心统计,2015年全国新发恶性肿瘤约392.9万例,脑恶性肿瘤发病率位于第10位[1],脑胶质瘤(Glioma)是最常见的中枢系统恶性肿瘤,约占脑恶性肿瘤的30%[2],神经胶质瘤的新发病例和死亡病例分别约为101 600和61 000,新发男女比例约为1∶1,死亡男女比例约为3∶2[1]。胶质瘤患者通常预后差,其发病可归因于遗传或环境因素的不同[3],已有相关研究报道,遗传因素促进神经胶质瘤的发展,并与神经胶质瘤的预后相关[4]。
Mastermind-like转录共激活因子2(MAML2)是mastermind-like蛋白家族的成员,该家族是NOTCH信号通路的共激活因子,在许多不同的肿瘤中,NOTCH信号激活与癌变有关,其主要在细胞增殖,转移和上皮间质转化中起着至关重要的作用[5,6]。本研究旨在通过癌基因组数据库(TCGA)分析验证MAML2基因表达与低级别胶质瘤(Low-grade glioma,LGG)的诊断与预后关系,并分析TCGA数据库的相关临床参数与胶质瘤患者诊断与预后价值。
1 资料与方法
1.1 资料来源
从癌基因组数据库(TCGA,https://cancergenome.nih.gov)下载胶质瘤低级别胶质瘤(LGG)队列的MAML2基因表达量数据及相关临床参数数据,并将基因表达量数据与患者编号及临床参数数据匹配,得到具有患者编号、临床参数、基因表达量相对应的数据。从基因型-组织表达数据库(GTEx,https://commonfund.nih.gov/gtex)下载正常组织中MAML2基因表达量数据。在TCGA数据库LGG数据中下载LGG患者529个,将基因表达量数据匹配后纳入256例患者,256例患者均有总体生存率(OS)及生存时间数据。在GTEx数据库中下载具有MAML2基因表达量患者1 152个。将MAML2基因表达数据进行lg2(X+1)标准化转化,并计算MAML2的中位表达量,将高于中位数定义为高表达组,低于中位数定义为低表达组。
1.2 统计学方法
使用IBM SPSS Statistics 20(SPSS,Inc,Chicago,IL,USA)将LGG队列及GBM队列的MAML2基因表达量数据进行方差齐性验证,若方差齐,使用独立样本T检验验证两者表达量差异,若方差不齐,使用秩和检验验证两者表达量差异。使用GraphPad Prism 8.0 软件(GraphPad Software,Inc,La Jolla,CA)绘制Kaplan-Meier生存曲线。使用COX单因素及多因素分析对各相关临床参数及基因表达与LGG队列患者预后关系进行验证,计算风险比 (Hazard Ratio,HR)与 95%置信区间(95% Confidence Interval,95% CI)。以P<0.05为差异有统计学意义。
2 结果分析
2.1 MAML2在低级别胶质瘤中的表达
将正常组织及低级别胶质瘤(LGG)组织的MAML2基因表达量分组,进行秩和检验,结果显示LGG组织中的MAML2基因较正常组织明显上调,具有统计学差异(P<0.001)(见图1),同时使用ROC曲线评估MAML2基因差异在低级别胶质瘤中的诊断价值,提示具有良好的诊断价值(P<0.000 1,AUC=0.997 8)(见图2)。

图1 MAML2在LGG组织正常组织中的表达Fig.1 MAML2 gene expression in LGG and normal tissues

图2 MAML2诊断ROC曲线Fig.2 ROC curve of MAML2
2.2 Kaplan-Meier 生存分析验证MAML2基因表达与低级别胶质瘤患者预后关系
以患者生存状态(生存或死亡)分组,分为死亡组与生存组,并使用秩和检验验证MAML2在两组间的表达量存在差异,死亡组患者MAML2表达量低于生存组(P=0.025 2)(见图3)。同时,以MAML2表达量为自变量,以总体生存时间为因变量,以生存状态(生存或死亡)为终点事件,进行Kaplan-Meier 生存分析,结果显示在LGG队列中,MAML2低表达组的总体生存率低于高表达组,差异具有统计学意义(P=0.005 2)(见图4)。
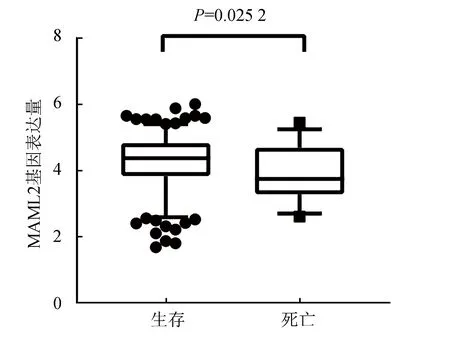
图3 低级别胶质瘤中生存组与死亡组的基因表达量Fig.3 Gene expression levels of survival and death groups in LGGs

图4 MAML2基因高表达组与低表达组的生存分析Fig.4 Survival analysis of high and low expression groups of MAML2 gene
2.3 MAML2基因表达与临床参数的关系
低级别胶质瘤患者有男性142名,女性114名,平均年龄为40岁。纳入TCGA数据库的256个临床数据,并分析性别、年龄、肿瘤分级、初治后肿瘤再发时间4个临床参数与MAML2基因表达进行分析,结果显示年龄与MAML2基因表达差异密切相关(P=0.011),其余3个临床参数无统计学差异(见表1)。

表1 MAML2基因表达量与临床参数的关系Table 1 Relationship between MAML2 gene expression and clinical parameters
2.4 COX单因素及多因素分析验证MAML2基因及各临床参数与低级别胶质瘤的预后关系
将性别、年龄、组织学类型、肿瘤患侧、肿瘤分级、初治后肿瘤再发或进展事件、术前抗癫痫药物史、术前糖皮质激素史,MAML2基因表达等相关临床因素纳入LGG队列患者的COX单因素分析,结果显示,年龄>=40岁、肿瘤分级为G3级、初治后肿瘤有再发或进展事件发生及MAML2基因低表达与患者总体生存率降低相关(P<0.05),将P<0.01的临床因素纳入多因素分析,结果显示,肿瘤分级为G3级、初治后肿瘤有再发或进展事件发生、MAML2基因低表达均为低级别胶质瘤患者预后差的独立危险因素(P<0.05)(见表2)。

表2 影响低级别胶质瘤患者总体生存率的临床参数单因素及多因素分析Table 2 Univariate and multivariate analyses of clinical parameters affecting the overall survival rate of patients with LGG
3 讨 论
脑胶质瘤包括胶质母细胞瘤(WHO 4级)及低级别胶质瘤(WHO 2级及3级)[7],由于遗传或环境因素导致胶质瘤临床行为的异质性,从而对医生的治疗提出挑战,并且其预后是可变的,不同级别之间,胶质瘤的生存范围广泛[8]。本研究旨在TCGA数据分析研究遗传相关因素MAML2基因表达及相关临床因素与胶质瘤的预后关系。
MAML2(Mastermind-like transcriptional co-activator 2),位于11q21,通常作为Notch受体的共活化剂激活Notch靶基因,参与形成的Notch相关RBP-J /CBF的复合物[9-10]。Tonon G等人[11-12]最早在粘液表皮样癌中发现了MAML2的致癌作用,MECT1-MAML2融合可破坏细胞正常周期,诱导肿瘤发生。Kuma Y等人[13]在研究中验证了CRTC1/3-MAML2融合基因可以作为诊断淋巴结瘤的有用方法。Yang Shen等人[14]研究发现MECT1-MAML2高表达的膀胱癌患者预后明显较差。这些研究为MECT1-MAML2在可能的致癌分子机制和与肿瘤预后关系中所发挥的作用提供了一些生物学证据。在一项基于神经胶质瘤微阵列数据的差异表达基因分析中提出MAML2在神经胶质瘤中异常表达[15]。
通过TCGA数据库分析,发现与正常组织相比,MAML2基因表达在LGG队列患者中明显上调,ROC曲线结果显示MAML2基因具有良好的诊断潜力(P<0.000 1,AUC=0.997 8)。同时我们将MAML2进行了KM生存分析,结果表明MAML2低表达与低级胶质瘤的总体生存率差有关(P=0.005 2)。
在表1中,以中位数40岁分界将年龄进行分组,发现>=40岁与<40岁的患者之间MAML2存在表达差异,MAML2与年龄密切相关(P=0.011),另外在COX单因素分析中,年龄及MAML2基因表达与总体生存率差均有关系,存在统计学意义,但是进一步的COX多因素分析中,年龄不具有统计学差异,从而明确MAML2低表达是低级别胶质瘤患者总体生存率的独立危险因素。
近些年来,胶质瘤的靶向治疗越来越受关注[16-18],已有许多学者关注胶质瘤的治疗靶点[19],本研究以生物信息学数据分析验证MAML2 在胶质瘤的发展和预后中起着重要的作用,但是还需要更多的前瞻性实验验证。
4 结 论
MAML2基因可能有助于判断胶质瘤患者诊断及预后情况,有可能成为一个潜在的分子标记物,但仍需进一步的前瞻性实验验证。

