黄独胚性悬浮细胞的小滴玻璃化法超低温保存
尹明华,李诚欣,李祥媛,刘凯盈,封 昀,卢 霞,柯维忠*
(1.上饶师范学院生命科学学院,江西 上饶 334001;2.上饶市药食同源植物资源保护与利用重点实验室,江西 上饶 334001;3.上饶市薯芋类作物种质保存与利用重点实验室,江西 上饶 334001;4.上饶农业技术创新研究院,江西 上饶 334001)
【研究意义】黄独(DioscoreabulbiferaL.)为薯蓣科薯蓣属(Dioscorea)植物[1],广泛分布于世界各地,其地下块茎又名黄药子,是传统的中药材,性凉,味苦,能清热解毒、凉血止血、化痰消瘿[2],具有抗菌、抗炎和抗肿瘤作用,临床上一般用于治疗食道癌、胃癌、直肠癌、乳腺癌、宫颈癌、膀胱癌、肺癌及肉瘤等[3]。近年来,由于中药市场对黄药子的极大需求,黄独野生资源遭受乱采滥挖造成野生资源急剧减少;此外,长期的零余子无性繁殖和自然退化等原因促使黄独种质资源即将面临大量丢失的危险[4],无法从根本上解决黄药子供需矛盾问题。【前人研究进展】植物细胞培养技术为大量生产药用次生代谢产物开辟了新途径[5],前人通过筛选高产细胞系、优化培养条件和培养技术等方法来提高目标代谢产物的合成[6]。黄独胚性悬浮细胞具有增殖快,再生强,体胚多等优点[7],并可通过生物反应器进行大规模培养生产黄独药用成分[8]。黄独胚性细胞悬浮细胞也是通过生物技术进行种质创新的基础。但是黄独胚性细胞悬浮细胞的建立非常困难,且建立后要定期继代。频繁的继代不仅耗费大量的人力和物力,易受细菌和真菌的污染,还会导致体细胞变异和植株再生能力下降甚至完全丧失。因此,研究黄独胚性细胞悬浮细胞的保存方法具有重要意义。【本研究切入点】目前,约有150~200种不同的植物可采用超低温保存程序,但到目前为止,每种植物和每种组织类型的超低温保存程序都需要根据所调查物种的脱水能力、外植体大小、外植体类型和含水量进行经验调整[9]。Kartha等[10]开发的小滴玻璃化法超低温保存是材料经过装载液及玻璃化液处理后,然后将材料放在含有玻璃化液滴的铝箔纸再放入冷冻管内投入液氮冻存的一种高效超低温保存法,具有存活率和再生率高,具有广适性,处理量大,操作简易等优点[11]。【拟解决的关键问题】本研究将以黄独胚性悬浮细胞为材料,从预培养、装载、脱水、化冻、洗涤和冻后培养等方面进行单因子试验,旨在建立和优化黄独胚性悬浮细胞小滴玻璃化法超低温保存的技术体系,为后续依赖体细胞胚发生体系的黄独试管苗再生和药用成分提取提供材料供给平台。
1 材料与方法
1.1 材料
黄独试管苗微型块茎由上饶师范学院生命科学学院植物组织培养室提供。
1.2 方法
1.2.1 胚性愈伤组织诱导 参考本课题组的方法[12]对黄独试管苗微型块茎进行胚性愈伤组织的诱导。
1.2.2 胚性悬浮细胞体系建立 将黄独试管苗微型块茎的胚性愈伤组织接种到胚性悬浮细胞增殖液体培养基上。培养基配方为MS+ 2 mg/L TDZ +1 mg/L 6-BA + 0.5 mg/L 2,4-D +0.09 mol/L蔗糖,pH 5.8~6.0。接种完后置于光照培养箱内进行振荡培养,温度为(25±1)℃,光强2000 lx,光照时间14 h/d。
1.2.3 小滴玻璃化法超低温保存 上述培养10 d后,取胚性悬浮细胞用于小滴玻璃化法超低温保存试验。0.2 g黄独胚性悬浮细胞在(25±1)℃下进行预培养。预培养进行2次单因子试验:①预培养时间:将黄独胚性悬浮细胞转入MS+ 2 mg/L KT + 0.5 mg/L NAA + 0.5 mg/L 2,4-D +0.8 mol/L蔗糖的液体培养基,预培养设置为0~5 d;②蔗糖浓度:将黄独胚性悬浮细胞转入MS+ 2 mg/L KT + 0.5 mg/L NAA + 0.5 mg/L 2,4-D +0~1.2 mol/L蔗糖的液体培养基中预培养4 d。预培养条件:温度为(25±1)℃,光强2000 lx,光照时间14 h/d。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照。
预培养完毕的黄独胚性悬浮细胞在(25±1)℃和0 ℃下进行装载。装载液为MS+2 mol/L甘油+0.4 mol/L蔗糖(pH 5.8),装载时间设置为0~90 min。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;装载完毕的黄独胚性悬浮细胞用100%PVS2(300 g/L甘油+150 g/L乙二醇+150 g/L二甲基亚砜+0.4 mol/L蔗糖,pH 5.8)进行脱水。脱水温度设置为0 ℃和(25±1)℃,脱水时间设置为0~120 min。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;用移液枪吸取20 μL PVS2滴于铝箔条上,将脱水完毕的黄独胚性悬浮细胞转入铝箔条PVS2液滴中,铝箔条在液氮罐口停留数秒使铝箔条PVS2冻凝,然后迅速将铝箔条(附有黄独胚性悬浮细胞PVS2冻凝珠)放入装满液氮的冷冻管中,最后将冷冻管投入液氮保存,保存时间设置为1 d。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;液氮保存1~180 d后,取出冷冻管铝箔条,浸入恒温预热过的培养液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+30 g/L蔗糖,pH 5.8)进行化冻。化冻温度设置为0、25、32、37和42 ℃。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;化冻完毕的黄独胚性悬浮细胞在(25±1)℃下用洗涤液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+0~1.6 mol/L蔗糖的液体培养基,pH 5.8)进行洗涤,洗涤3次,每次洗涤时间为10 min。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;化冻完毕的黄独胚性悬浮细胞转入增殖培养基(MS+ 2 mg/L TDZ +1 mg/L 6-BA + 0.5 mg/L 2,4-D +蔗糖30 g/L+7.5 g/L琼脂粉,pH 5.8~6.0)上进行冻后黑暗培养。冻后黑暗培养方式设置为:①直接置于光周期(光照14 h/d;光照强度2000 lx;温度[(25±1)℃]下培养;②先黑暗[(25±1)℃]条件下培养5 d,然后转至光周期(光照14 h/d;光照强度2000 lx;温度[(25±1)℃]下培养。以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞为对照;冻后培养完毕的黄独胚性悬浮细胞按Towill等[13]方法用TTC(氯化三苯基四氮唑还原法)法检测其生活力。细胞相对存活率=(超低温保存后细胞的TTC值/超低温保存前细胞的TTC值)×100。其中TTC值测量方法如下:称取洗涤后的黄独胚性悬浮细胞20 mg,放入具刻度的10 d 试管中,加入5 mL TTC试剂,在黑暗、22~25 ℃下静止培养18~20 h,吸去TTC溶液,用蒸馏水洗涤 2~3 次,然后加入5 mL 95%乙醇,将试管放入60 ℃水浴中加热20~30 min,提取氯化三苯基四氮唑被脱氢酶还原后生成的红色的三苯基甲(TTF)。最后用型分光光度计在485 nm波长处测试提取液的吸收值。用这种吸收值(TTC值)表示各处理的黄独胚性悬浮细胞在超低温保存后的细胞存活力。
1.2.4 冻后植株遗传稳定性检测 将在上述增殖培养基上形成胚性愈伤组织后,30 d后将胚性愈伤组织块接入分化培养基(MS+KT 2 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+5 g/L琼脂粉)上,50 d后将胚性愈伤组织分化的胚状体再次转入分化培养基(MS+KT 2 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+5 g/L琼脂粉)上,60~70 d后黄独胚状体形成完整黄独试管苗。采用本课题组的方法[14]对黄独胚性悬浮细胞冻后再生苗进行遗传稳定性的RAPD分子标记检测[CTAB 法提取样品基因组 DNA;PCR 扩增体系(20 μL)为 DNA模板 2 μL,引物 1 μL,蓝色 Mix 10 μL,去离子水 7 μL。PCR 扩增程序为 94 ℃预变性 3 min,然后进行40 个循环:94 ℃变性 30 s,36 ℃复性 50 s,72 ℃延伸 1.5 min;循环结束后 72 ℃延伸 10 min,4 ℃保存;PCR 产物在 2.0%的琼脂糖凝胶电泳中检测。 XZJ-17(3’-5’:ACGGATCCTG)、XZJ-18(3’-5’:GGCTGCAGAA)和XZJ-19(3’-5’:ACGCGCATGT)]。对照组设置为2个:一是以仅未投入液氮保存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞再生苗;二是常温继代培养的黄独胚性悬浮细胞再生苗。
1.2.5 数据统计 以上实验均重复3次,本实验所有数据表示为平均值±标准差。以上实验数据均用SPSS19.0软件进行One-Way ANOVA分析,再进行LSD法检验,P<0.05为有统计学差异显著性。
2 结果与分析
2.1 预培养对胚性悬浮细胞冻后存活率的影响
从图1可知,未经过预培养,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均处于最低值;经过预培养后,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率显著增加,当预培养时间继续提高到4 d时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率达到最高值。预培养液蔗糖浓度为0 mol/L,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均较低;当预培养液蔗糖浓度逐渐增加时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均显著增加,当预培养液蔗糖浓度为0.8 mol/L时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均处于最高值。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳预培养方式为(25±1)℃下在MS+ 2 mg/L KT + 0.5 mg/L NAA + 0.5 mg/L 2,4-D +0.8 mol/L蔗糖的液体培养基中预培养4 d。
2.2 装载对胚性悬浮细胞冻后存活率的影响
从图2可知,未经过装载,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均处于最低值;经过装载后,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率显著增加,装载时间为70 min时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均达到最高值。与0 ℃下装载相比较,(25±1)℃下装载可以显著提高液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳装载方式为(25±1)℃下在装载液(MS+2 mol/L甘油+0.4 mol/L蔗糖,pH 5.8)中装载70 min。

图1 预培养时间和蔗糖浓度对黄独胚性悬浮细胞相对存活率的影响Fig.1 The effect of preculture time and sucrose concentration on the relative survival rate of D.bulbifera L.suspension cells

图2 装载时间和装载温度对黄独胚性悬浮细胞相对存活率的影响Fig.2 The effect of loading time and loading temperature on the relative survival rate of D.bulbifera L.suspension cells
2.3 PVS2脱水对胚性悬浮细胞冻后存活率的影响
从图3可知,未经过装载,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均处于最低值;经过PVS2脱水后,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率显著增加,PVS2 100 min脱水后,未液氮冻存和液氮冻存黄独胚性悬浮细胞的相对存活率均均达到最高值。与(25±1)℃下PVS2脱水相比较,0 ℃下PVS2脱水可以显著提高液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳PVS2脱水方式为0 ℃下在PVS2(300 g/L甘油+150 g/L乙二醇+150 g/L二甲基亚砜+0.4 mol/L蔗糖,pH 5.8)中脱水100 min。
2.4 液氮保存时间对胚性悬浮细胞冻后存活率的影响
从图4可知,液氮保存时间为1、30、60、90、120、150和180 d时,黄独胚性悬浮细胞冻后存活率基本维持在89%~95%之间,相互之间无显著性差异。因此,小滴玻璃化法超低温保存可以保证黄独胚性悬浮细胞的冻后存活率。
2.5 化冻对胚性悬浮细胞冻后存活率的影响
从图5可知,随着化冻温度升高,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率也显著提高,当化冻温度至37 ℃时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率达到最高值。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳化冻方式为冻后铝箔条浸入37 ℃恒温预热过的培养液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+30 g/L蔗糖,pH 5.8)中化冻。
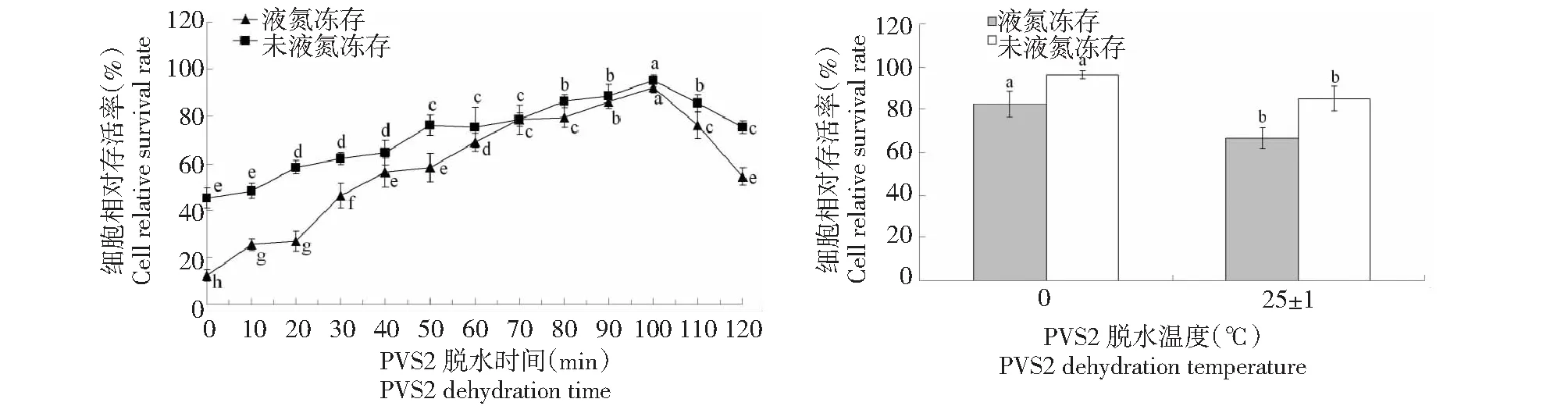
图3 PVS2脱水时间和脱水温度对黄独胚性悬浮细胞相对存活率的影响Fig.3 The effect of PVS2 dehydration time and dehydration temperature on the relative survival rate of D.bulbifera L.suspension cells

图4 液氮保存时间对黄独胚性悬浮细胞相对存活率的影响Fig.4 The effect of conservation time in LN on the relative survival rate of D.bulbifera L.suspension cells
2.6 洗涤对胚性悬浮细胞冻后存活率的影响
从图6可知,洗涤液蔗糖浓度为0时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均处于最低值;随着洗涤液蔗糖浓度逐渐升高,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率显著提高,洗涤液蔗糖浓度为1.2 mol/L时,液氮冻存和未液氮冻存黄独胚性悬浮细胞的相对存活率均达到最高值。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳洗涤方式为在(25±1)℃下用洗涤液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+1.2 mol/L蔗糖的液体培养基,pH 5.8)进行洗涤,洗涤3次,每次洗涤时间为10 min。
2.7 冻后培养对胚性悬浮细胞冻后存活率的影响
从图7可知,冻后直接置于光周期下培养,液氮冻存黄独胚性悬浮细胞的相对存活率较低;冻后先黑暗培养5 d再置于光周期下培养,液氮冻存黄独胚性悬浮细胞的相对存活率显著增加。而对于未液氮冻存的黄独胚性悬浮细胞,冻后直接置于光周期下培养以及冻后先黑暗培养5 d再置于光周期下培养均不会显著影响其冻后存活率。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存的较佳冻后培养条件为先黑暗培养5 d再置于光周期下培养。

图5 化冻温度对黄独胚性悬浮细胞相对存活率的影响Fig.5 The effect of thawing temperature on the relative survival rate of D.bulbifera L.suspension cells
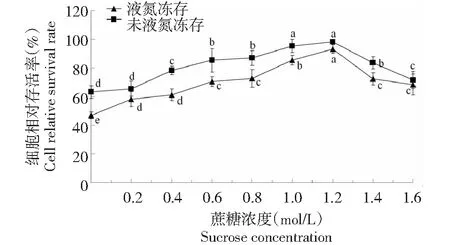
图6 洗涤液蔗糖浓度对黄独胚性悬浮细胞相对存活率的影响Fig.6 The effect of sucrose concentration of washing solution on the relative survival rate of D.bulbifera L.suspension cells
2.8 黄独胚性悬浮细胞小滴玻璃化法超低温保存程序的验证
为了验证黄独胚性悬浮细胞小滴玻璃化法超低温保存程序的可靠性,黄独胚性悬浮细胞(25±1)℃下在MS+ 2 mg/L KT + 0.5 mg/L NAA + 0.5 mg/L 2,4-D +0.8 mol/L蔗糖的液体培养基中预培养4 d;(25±1)℃下在装载液(MS+2 mol/L甘油+0.4 mol/L蔗糖,pH 5.8)中装载70 min;0 ℃下在PVS2(300 g/L甘油+150 g/L乙二醇+150 g/L二甲基亚砜+0.4 mol/L蔗糖,pH 5.8)中脱水100 min;冻后铝箔条浸入37 ℃恒温预热过的培养液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+30 g/L蔗糖,pH 5.8)中化冻;(25±1)℃下用洗涤液(MS+KT 2 mg/L+NAA 0.5 mg/L+2,4-D 0.5 mg/L+1.2 mol/L蔗糖的液体培养基,pH 5.8)进行洗涤,洗涤3次,每次洗涤时间为10 min;洗涤后先黑暗培养5 d再置于光周期下培养。结果表明:黄独胚性悬浮细胞冻后相对存活率为90.5%±4.4%。因此,黄独胚性悬浮细胞小滴玻璃化法超低温保存程序较为可靠。
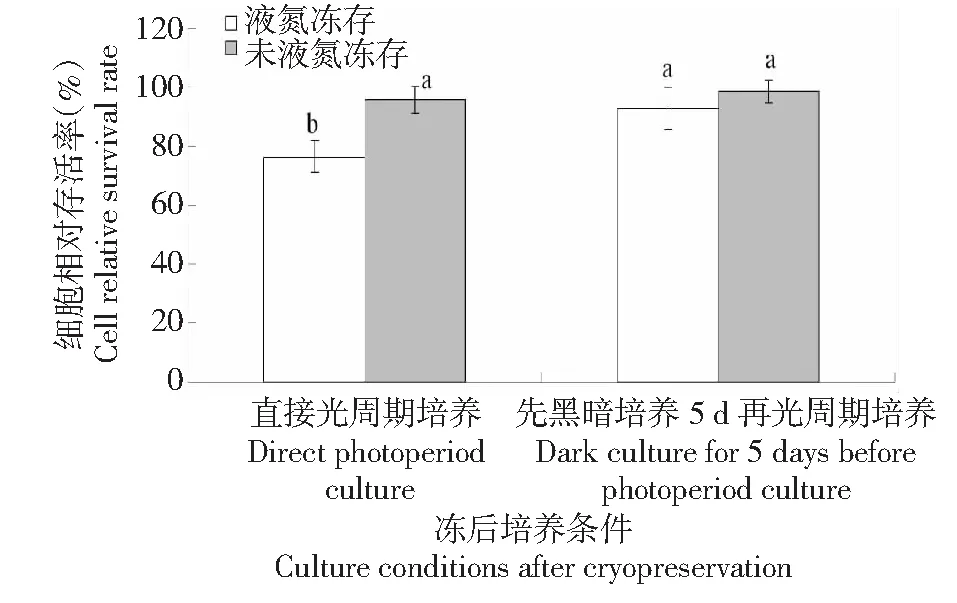
图7 冻后培养条件对黄独胚性悬浮细胞相对存活率的影响Fig.7 The effect of culture conditions after cryopreservation on the relative survival rate of D.bulbifera L.suspension cells
2.9 冻后植株遗传稳定性的RAPD检测
将液氮冻存和未液氮冻存黄独胚性悬浮细胞转入增殖培养基上形成胚性愈伤组织(图8)后,30 d后将胚性愈伤组织块接入分化培养基(MS+KT 2 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+5 g/L琼脂粉)上,50 d后将胚性愈伤组织分化的胚状体再次转入分化培养基(MS+KT 2 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+5 g/L琼脂粉)上,60 d后黄独胚状体形成完整黄独试管苗(图9)。以仅未液氮冻存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞再生苗以及黄独胚性悬浮细胞常温继代培养再生苗为对照,对黄独胚性悬浮细胞液氮冻存再生苗进行遗传稳定性的RAPD分子标记检测(图10)。结果表明黄独胚性悬浮细胞液氮冻存再生苗、黄独胚性悬浮细胞未液氮冻存再生苗和黄独胚性悬浮细胞常温继代培养再生苗的条带数一致(图11),说明黄独胚性悬浮细胞的小滴玻璃化法超低温保存可以保证其遗传稳定性。
3 讨 论
超低温保存的细胞自由水含量显著影响冷冻细胞的存活率[15]。使用高浓度的蔗糖进行预培养可以增强细胞分裂与分化的同步化,减少胞内自由水含量,减少超低温保存的冰晶生长对细胞膜的伤害[16]。山药[17]、ByrsonimaintermediaA.Juss[18]、百合[19]、月季[20]、白芨[21]和野生马铃薯[22]小滴玻璃化法超低温保存实验结果表明,预培养蔗糖浓度取决于基因型,蔗糖预培养浓度在0.3~1.0 mol/L之间,蔗糖预培养时间数小时到十几天不等。本试验中,黄独胚性悬浮细胞(25±1)℃下在MS+ 2 mg/L KT + 0.5 mg/L NAA + 0.5 mg/L 2,4-D +0.8 mol/L蔗糖的液体培养基中预培养4 d,小滴玻璃化法冻后存活率可达90%以上。

A.液氮冻存;B.未液氮冻存A.Cryopreservation with liquid nitrogen;B.Cryopreservation without liquid nitrogen 图8 黄独胚性悬浮细胞的增殖Fig.8 Proliferation from D.bulbifera L.suspension cells

A.液氮冻存;B.未液氮冻存A.Cryopreservation with liquid nitrogen;B.Cryopreservation without liquid nitrogen 图9 黄独胚性悬浮细胞再生Fig.9 Regeneration from D.bulbifera L.suspension cells

A.常温继代;B.未液氮冻存;C.液氮冻存A.Subculture in normal temperature;B.Cryopreservation without liquid nitrogen ;C.Cryopreservation with liquid nitrogen图10 黄独胚性悬浮细胞再生植株Fig.10 Plantlets regenerated from D.bulbifera L.suspension cells

左1:常温继代;左2:未液氮冻存;左3:液氮冻存;左4:Marker;上:引物XZJ-17;中:引物XZJ-18;下:引物XZJ-19Left No.1:Subculture in normal temperatur;Left No.2:Cryopreservation without liquid nitrogen;Left No.4:Cryopreservation with liquid nitrogen;Left No.4:Marker Upper:Primer XZJ-17;Middle:Primer XZJ-18;Lower:Primer XZJ-19图11 黄独胚性悬浮细胞再生植株PCR 扩增产物检测结果Fig.11 PCR amplification product detection results of plantlets regenerated from D.bulbifera L.suspension cells
超低温保存脱水一般有2步,一是装载,二是植物玻璃化液脱水。3个百合品种[19]、4种月季离体植株[20]、白芨3 d萌发的种子和6 d生原球茎[21]以及天竺葵[23]小滴玻璃化法装载时间分别为20~40、20、15和20 min。在本试验中,(25±1)℃下在装载液(MS+2 mol/L甘油+0.4 mol/L蔗糖,pH 5.8)中装载70 min,可显著提高黄独胚性悬浮细胞的冻后存活率。究其原因,可能是冻存的植物材料不一样所致。
在进行小滴玻璃化法超低温保存脱水时,植物玻璃化液的处理时间和处理温度是细胞小滴玻璃化法超低温保存的关键[24]。植物玻璃化液的处理温度一般采用0 ℃,因为在0 ℃时植物玻璃化液对细胞的毒害较轻[25]。4种月季离体植株茎尖在0 ℃下用植物玻璃化液2(PVS2)处理20或30 min,小滴玻璃化法冻后存活率在78.3%~95.1%之间[20]。采用小滴玻璃化冷冻技术,木萨属和合欢属离体茎尖在0 ℃下PVS2处理的最佳时间为30~50 min,与常规冷冻方案相比,这个环节的PVS2处理可增加冻后存活率23%~46%[26]。亚太地区国家芋种质茎尖在0 ℃下暴露20~40 min的PVS2,这种新的小滴玻璃化法将解冻后的平均再生率从先前的玻璃化法的21%~30%提高到73%~100%[27]。3个百合品种不定芽顶端分生组织在0 ℃下在PVS2溶液中浸泡90~120 min,小滴玻璃化法冻后存活率最高[19]。白芨3 d萌发的种子和6 d生原球茎在25 ℃下暴露于PVS2溶液中60 min,小滴玻璃化法冻后种子发芽率最高,小滴玻璃化法冻后6 d生球茎存活率最高[21]。天竺葵茎尖用植物玻璃化液2(PVS2)装载20 min,成活率在55.6%~96.2%之间,再生率在9.1%~70.6%之间[23]。在本试验中,黄独胚性悬浮细胞0 ℃下在PVS2(300 g/L甘油+150 g/L乙二醇+150 g/L二甲基亚砜+0.4 mol/L蔗糖,pH 5.8)中脱水100 min,可获得较高的冻后细胞存活率。究其原因,可能还是冻存的植物材料不一样所致。
在小滴玻璃化法超低温保存中,冰冻保护剂中的二甲基亚砜(DMSO)对植物材料有毒害作用,会引起材料遗传稳定性的改变[28]。4种月季离体植株茎尖小滴玻璃化法冻后再生植株没有表现出形态变化[20]。海岛棉XH33胚性细胞小滴玻璃化法冻存的细胞和正常细胞在基因组倍性和核酸组成上没有明显差异,未造成遗传变异[29]。牛大力腋芽小滴玻璃化法再生植株与对照的ISSR 和 SSR 两种分子标记无差异性条带[30]。马铃薯茎尖小滴玻璃化法超低温保存再生植株的SSR 稳定性分析也表明无变异[31]。在本试验中,以仅未液氮冻存(其他处理步骤与投入液氮保存一致)的黄独胚性悬浮细胞再生苗以及黄独胚性悬浮细胞常温继代培养再生苗为对照,对黄独胚性悬浮细胞液氮冻存再生苗进行遗传稳定性的RAPD分子标记检测。结果表明黄独胚性悬浮细胞液氮冻存再生苗、黄独胚性悬浮细胞未液氮冻存再生苗和黄独胚性悬浮细胞常温继代培养再生苗的条带数一致。
4 结 论
在玻璃化冷冻技术中,小滴玻璃化法超低温保存具有较高的冻后存活率率。本试验提出了一套利用标准程序进行黄独胚性悬浮细胞小滴玻璃化的处理方法,对其各个关键环节进行优化,并对其遗传稳定性进行了RAPD检测,取得了不错的冻存效果,可为其他药用植物胚性悬浮细胞的小滴玻璃化法超低温保存提供借鉴和参考。

