不同连栽代次桉树人工林土壤真菌群落结构和多样性研究
林忠鑫,王志超,竹万宽,杜阿朋,许宇星*
不同连栽代次桉树人工林土壤真菌群落结构和多样性研究
林忠鑫,王志超,竹万宽,杜阿朋,许宇星
(1. 岭南师范学院,广东 湛江 524048;2. 国家林业和草原局桉树研究开发中心,广东 湛江 524022)
为了研究不同连栽代次桉树人工林土壤真菌群落结构和多样性的变化,选取广西七坡林场不同连栽代次桉树人工林作为研究对象,在调查9项化学指标基础上,应用高通量测序平台、冗余分析对不同连栽代次桉树人工林土壤真菌多样性进行研究。结果表明:多代连栽经营模式对土壤化学性质及真菌群落产生显著影响。连栽模式引起土壤养分含量、真菌多样性及丰富度在第2代桉树人工林显著升高后,在第3代和第4代人工林土壤中显著下降。同时,多代连栽导致真菌群落结构的显著变化,第3、4代人工林土壤优势真菌担子菌门相对丰度显著下降,而子囊菌门相对丰度显著升高。速效钾和硝态氮作为土壤关键因子驱动土壤真菌群落结构的演变过程。
桉树人工林;高通量测序;土壤真菌;群落结构;多样性
桉树()原产地为澳大利亚,我国广东、广西、四川、云南、福建等地均有种植。桉树生长快、周期短,在一定程度上缓解了全球范围内的木材供需矛盾。由于桉树萌芽更新能力强,成林时间短,造林成本低,留萌连栽成为了国有林场及林农的主要营林措施。在华南地区,近60%的桉树林地选择连栽经营模式,部分林场甚至连栽4 ~ 5代桉树人工林仍未改变林地用途,导致人工林地面临养分流失、甚至地力衰退的风险,由多代经营模式所带来的生产力及生态问题已引起社会及相关专家的广泛关注。
微生物作为土壤养分循环和土壤质量改善的核心驱动力,在生态系统调控土壤生物地球化学过程中起着重要作用。土壤微生物群落结构对环境质量变化高度敏感,其多样性及群落结构常被用于评估生态系统对环境扰动的响应。在人工林经营中,林业实践过程对人工林生态系统植被结构及土壤养分可利用性造成显著影响,而这些扰动会被土壤微生物记录下来。多代连栽模式被广泛应用于速生人工林经营中,然而针对多代连栽模式对土壤真菌群落结构变化的研究报道较少。本文通过高通量测序分析对广西4个不同连栽代次桉树人工林土壤化学性质及真菌群落进行对比研究,将传统土壤评价指标与微生物群落结构及其多样性相结合,以期更深入地探索连栽桉树人工林土壤质量演变过程。
1 材料与方法
1.1 研究区概况
研究区位于广西国有七坡林场(21°85' ~ 22°10' N,107°61' ~ 107°96' E)。属南亚热带季风气候,年平均温度21.7 ℃,年平均降雨量为1 200 ~ 1 300 mm。试验地选取林场内海拔416 ~ 583 m、坡度15 ~ 21°的丘陵地带。以具有相同起源、直线分布距离小于1 km 的4片5年生尾巨桉()人工林作为研究对象(包含4个代次)。人工林代次即1种经营措施,5年为1个轮伐期,皆伐后萌芽更新形成新一代桉树人工林,依次循环。所有桉树人工林植苗造林前,均为20年生马尾松()人工林。
1.2 样品采集
2019年7月,在4片桉树人工林中分别设置4个20 m × 20 m 标准样地。沿各样地对角线利用土钻随机采集18个0 ~ 10 cm表土样本,去除腐殖质与根系并均匀混合形成土壤样本,每代次桉树人工林得到4个重复土壤样本。从每个样品中取10 g土壤(过筛2 mm)置于10 ml冷存管中,立即浸泡在液氮中,用于后续微生物分析。剩余土壤风干后用于土壤化学分析。
1.3 土壤化学性质分析
土壤pH值采用pH计进行测定(1:2.5土水比);土壤有机质采用重铬酸钾-硫酸-比色法测定。全氮、全磷和全钾分别采用凯氏定氮法、碱熔-钼锑抗比色法以及碱熔-火焰光度法测定;铵态氮和硝态氮分别采用2 mol·LKCL浸出-靛酚蓝比色法和紫外分光光度法测定;有效磷和速效钾分别采用硫酸-盐酸双酸法和火焰光度法测定。
1.4 土壤真菌DNA提取与测序
根据 E.Z.N.A.® soil DNA kit (Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总 DNA 抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA 浓度和纯度;真菌ITS 序列使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')-ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。梯度PCR采用PCR仪(T100 Thermal Cyeler)进行,将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并使用QuantusFluorometer(Promega, USA)对回收产物进行检测,定量。使用DNA快速建库试剂盒(NEXTFLEX Rapid DNA-Seq Kit)进行建库后利用Illumina公司的Miseq PE300平台进行测序。为了减少测序深度对后续群落组成分析的影响,将每个样本的序列数量细化到最小样本量。利用Usearch 7.0 (http://www.drive5.com/usearch/)将所有样本序列按照序列间的距离进行聚类,后根据序列之间的相似性将序列分成不同的操作分类单元(OTU),通常对97%相似水平下的OTU进行生物信息统计分析。调用Mothur软件(v1.30.2)计算各个样本Chao1、Ace、Shannon、Simpson指数值。
1.5 统计方法
土壤化学性质的数据利用EXCEL和SPSS 26.0软件进行ANOVA单因素方差分析(LSD)完成。利用R语言进行真菌群落结构和土壤化学性质的冗余分析(RDA)。利用SPSS 26.0软件进行真菌群落多样性和土壤化学性质的相关性分析。对土壤真菌群落结构进行基于Unweighted_unifrac距离的主坐标分析(PCoA),并通过置换多元方差分析PERMANOVA (Permutational Multivariate Analysis of Variance) 确定群落结构的差异水平。
2 结果与分析
2.1 土壤化学性质
不同连栽代次桉树人工林之间土壤化学性质存在显著差异(<0.05,图1)。其中,第2代桉树人工林的pH值最高并达到显著水平,至3 ~ 4代后有所下降,说明连栽代次的增加可能改变了林地土壤的酸度。随着连栽代次的增加,土壤有机质含量显著下降,表现为第1代桉树人工林>第2代桉树人工林>第3代桉树人工林>第4代桉树人工林(图1)。土壤全氮、全磷、全钾、铵态氮、硝态氮、速效钾含量均表现为第1、2代人工林显著高于第3、4代人工林土壤。该结论同王嘉琛等对桂北不同连栽代次桉树人工林土壤养分研究的部分结果一致。
2.2 测序数据结果
对不同连栽代次桉树人工林进行测序,经筛选后获得的各个样品的可注释序列总数Counts,按照97%的相似度进行OTUs划分,结果见表1。根据测序数量Counts可知,每个样品的测序数量均在3万条左右,说明测序的质量高,测序可信度高。

图1 不同连栽代次桉树人工林土壤化学性质
注:柱形图中不同小写字母表示<0.05。

表1 不同连栽代次桉树人工林土壤OTU测序结果
注:First:第1代,Second:第2代,Third:第3代,Fourth:第4代。
2.3 真菌OTU分析
将测序得出的有效序列按照97%的相似性聚类为操作分类单元(OTU)后,统计出不同连栽代次桉树人工林共有654个OTU,数量由高到低依次为:第2代桉树人工林493个、第3代桉树人工林451个、第1代桉树人工林406个、第4代桉树人工林294个。使用韦恩图将OTUs进行划分及可视化。不同连栽代次桉树人工林共有OTU数目为150个,特有OTU数目由高到低依次为:第2代桉树人工林54个、第3代桉树人工林40个、第1代桉树人工林32个、第4代桉树人工林25个(图2)。
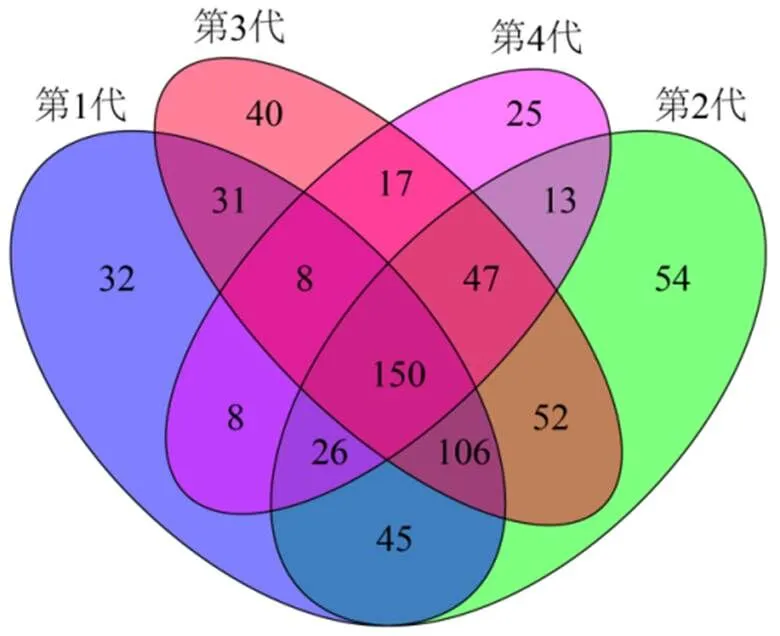
图2 真菌OTU的韦恩图
2.4 真菌群落PCoA分析
整体系统真菌群落组成在不同连栽代次桉树人工林之间存在显著差异(<0.05,图3)。第1代桉树人工林、第2代桉树人工林、第3代桉树人工林、第4代桉树人工林之间距离较远,差异性较大。根据不同连栽代次桉树人工林土壤的OTU,构建了一个主坐标排序,说明不同连栽代次桉树人工林土壤群落的系统发育差异。主坐标分析(PCoA)结果表明,PC1的贡献率为58.82%,PC2的贡献率为16.19%,两者共解释了75.01%的方差变化。从不同连栽代次桉树人工林的真菌群落组成来看,不同连栽代次桉树人工林组内真菌组成较为相似,组间差异较大。
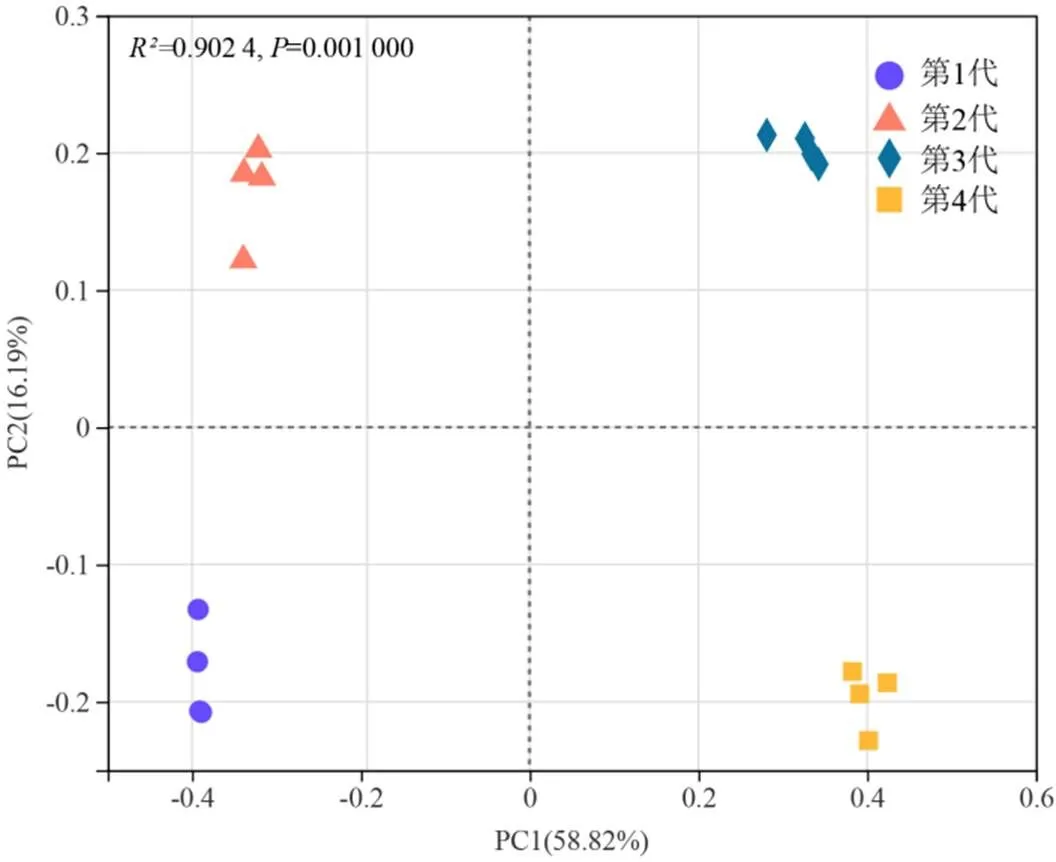
图3 真菌OTU主坐标分析
2.5 真菌群落结构分析
为了研究不同连栽代次桉树人工林土壤样品中真菌物种组成的多样性,进行OTU聚类分析,根据OTUs聚类结果,对每个OTU的代表序列做物种注释,共统计得到11门。与其森林土壤相似,担子菌门()和子囊菌门()为土壤优势真菌菌门类,占据总真菌丰度的88.85% ~ 93.63%。此外,第3代和第4代桉树人工林的担子菌门相对丰度均显著高于第1、2代人工林,占据63.98% ~ 76.08%;第1、2代桉树人工林的子囊菌门相对丰度显著高于第3、4代人工林,其值为36.25% ~ 54.54%。桉树人工林土壤担子菌门相对丰度的显著增加,可能同担子菌门通常与根系形成共生关系有关。相关研究证实,外生菌根真菌与营养受限植物的养分吸收密切相关,其相对丰度增加被认为与它们从腐真菌物种的活菌丝或死菌丝捕获和转移营养物质有关。因此,本研究推测第3代和第4代桉树人工林的养分胁迫可能通过增加树木对真菌共生体的依赖来补偿。此外,球囊菌门、壶菌门、单毛壶菌门、梳霉门在不同连栽代次中含量极少(图4,表2)。
2.6 真菌群落多样性
多代连栽模式显著影响了桉树人工林土壤真菌多样性及丰富度(<0.01,表3)。Ace指数和Chao1指数可以衡量土壤真菌群落物种数量的多少,指数数值越大说明真菌物种数量越高。本研究中,第2代桉树人工林的Ace指数和Chao1指数均显著高于第1代人工林。然而,随着连栽代次的增加,第3代和第4代桉树人工林丰富度指数显著下降。Simpson指数和Shannon指数反映土壤真菌群落物种多样性,Simpson指数越小,Shannon指数越大,说明样品的物种多样性越高,同时前者侧重于均匀度对优势OTU更敏感,而后者侧重于群落的丰富度以及对稀有的OTU更敏感。与群落丰富度一致,随着连栽代次的增加,土壤真菌多样性表现为在第2代显著升高后,在第3、4代人工林土壤中显著下降(<0.01,表3)。原因可能在于:由前茬松树树种转变为桉树人工林,伴随着大量新鲜的高质量有机物质的累积,这为第1、2代桉树人工林土壤真菌的定殖提供了良好的栖息条件。随着连栽代次增加,土壤含水量及养分状况显著下降,且分解进入后期阶段的低质量凋落物大量累积,这些因素均导致真菌群落多样性受到显著负面影响。本文结论与ZHU等研究结果存在差异,该研究表明连栽第2、3、4代人工林土壤间真菌多样性并未产生显著变化。这可能归因于采样地地理位置,气候海拔及采样时间的差异。
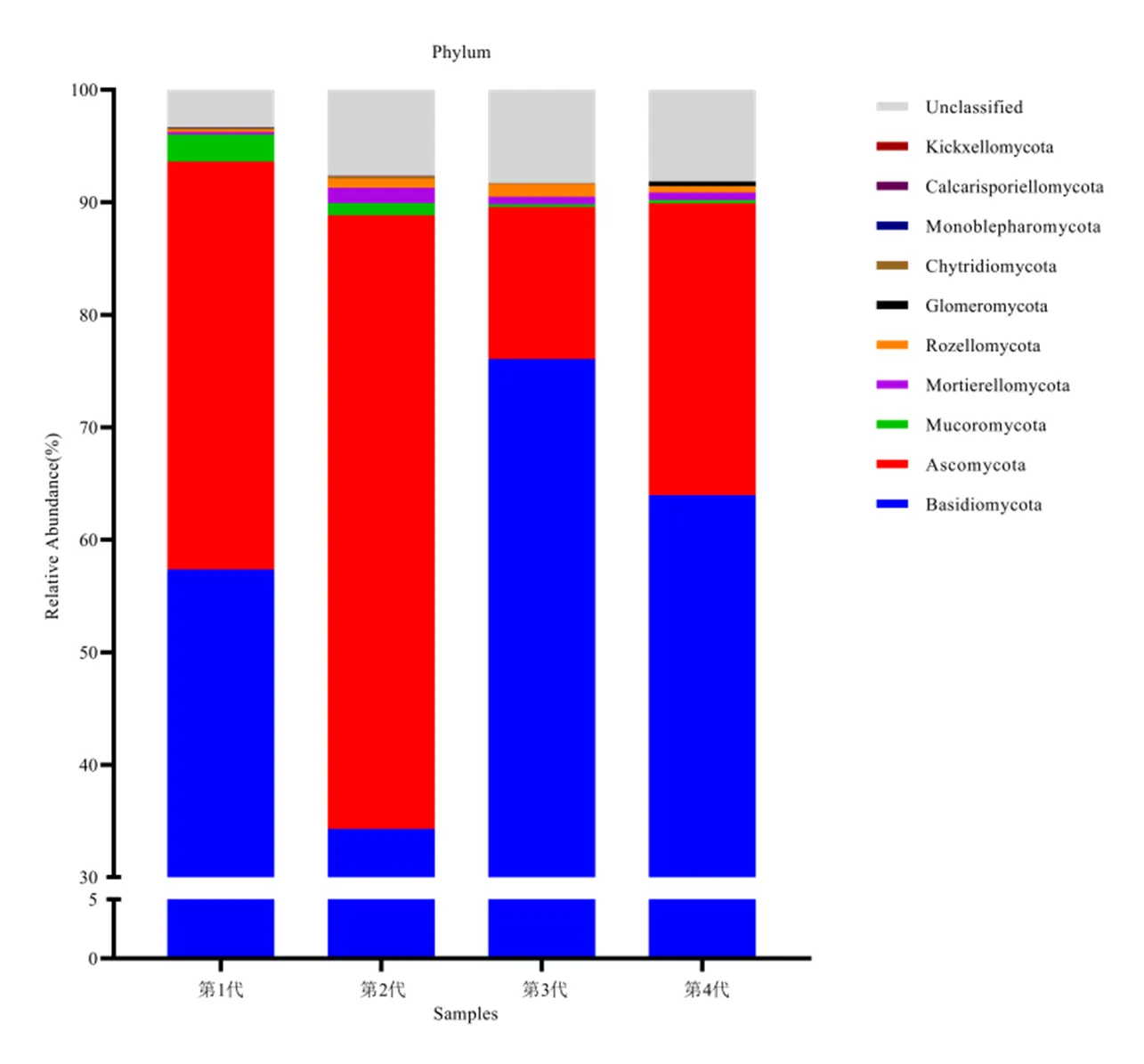
图4 不同连栽代次桉树人工林土壤真菌群落结构

表2 不同连栽代次桉树人工林土壤真菌主要菌门
注:同行数据后不同小写字母表示<0.05。
2.7 土壤真菌群落多样性及结构与土壤化学性质的关系
对真菌群落多样性与土壤化学性质进行相关性分析发现,真菌群落丰富度指数Ace和Chao1同土壤pH值、全磷、全钾、硝态氮、铵态氮、有效磷和速效钾呈显著正相关关系,真菌群落多样性指数Shannon同所有化学性质(除pH值)呈显著正相关关系,而Simpson指数与大多数化学性质呈负相关(表4)。
RDA结果显示,土壤真菌群落结构受到土壤速效钾和硝态氮的驱动,进一步Monte Calo Permutation检验证实了其显著性(图5)。RDA1解释了98.15%的变化,RDA2解释了1.72%的变化,两者共解释了99.87%的方差变化。速效钾与RDA1负相关性最强,相关系数为−0.96,主要表现在与子囊菌门和毛霉菌门呈现正相关性,与担子菌门呈现负相关性。pH值与RDA2正相关性最强,相关系数为0.82,主要表现在与隐真菌门、被孢霉门和球囊菌门呈现正相关性,与担子菌门、子囊菌门和毛霉菌门呈现负相关性。根据不同连栽代次桉树人工林的欧几里得距离,不同连栽代次桉树人工林的采样点存在一定的差异性,第3代桉树人工林和第4代桉树人工林之间的距离较小,表明其真菌群落较为相似。总体而言,不同连栽代次桉树人工林之间距离存在显著差异,速效钾对土壤真菌群落结构的影响最大。

表3 不同连栽代次桉树人工林土壤真菌群落多样性分析
注:同列数据后不同大写字母表示<0.01。

表4 真菌群落多样性与土壤性质的相关性
注:**在0.01水平(双侧)上显著相关;*在0.05水平(双侧)上显著相关。

图5 土壤真菌群落结构与土壤化学性质的RDA分析
注:担子菌门,子囊菌门,毛霉菌门,被孢霉门,隐真菌门,球囊菌门,壶菌门,单毛壶菌门,,梳霉门,pH:pH 值,SOM:有机质,NO-N:硝态氮,NH-N:铵态氮,TN:全氮,TP:全磷,TK 全钾,AP:有效磷,AK:速效钾。
3 结论
通过在不同连栽代次桉树人工林内布置16块标准地,结合9项化学指标,应用高通量测序平台、冗余分析和相关性分析,对不同连栽代次桉树人工林土壤真菌多样性进行研究,得出主要结论如下:
(1)不同连栽代次桉树人工林之间土壤化学性质存在显著差异。其中第2代桉树人工林的大多数化学指标的含量均显著高于其他连栽代次桉树人工林。而在不同连栽代次桉树人工林土壤中pH值、全磷、全钾、铵态氮、硝态氮含量均表现出第2代桉树人工林显著高于其他连栽代次桉树人工林,且到第3代桉树人工林、第4代桉树人工林后显著降低。有机质含量随着连栽代次的增加而逐代减少。这些结果说明,随着连栽代次的增加会导致大多数化学指标出现降低的趋势。
(2)测序结果表明真菌OTU在不同连栽代次桉树人工林之间存在差异。PCoA结果显示整体系统真菌群落组成在不同连栽代次桉树人工林之间存在显著差异,不同连栽代次桉树人工林组内真菌组成较为相似,组间差异较大。高通量测序结果表明:担子菌门和子囊菌门为桉树人工林的优势真菌菌门类,随着连栽代次的增加,担子菌门的相对丰度是先减少后增加再减少,而子囊菌门的相对丰度是先增加后减少再增加。
(3)土壤真菌群落丰富度指数(Ace、Chao1)和多样性指数(Simpson、Shannon)在不同连栽代次之间存在极显著差异。土壤真菌群落丰富度和多样性表现为在第2代显著升高,后随着连栽代次的增加显著下降,且真菌各项多样性指数与土壤化学性质之间存在密切相关性。冗余分析结果表明速效钾和硝态氮是驱动土壤真菌群落结构变化的关键环境因子。
[1] ARNOLD R J, XIE Y J, LUO J Z, et al. A tale of two genera: exotictus andspecies in China 1. Domestication and research[J]. International Forestry Review,2020,22:1-18.
[2] CHEN S X, ARNOLD R J, LI Z H, et al. Tree and stand growth for clonal×across a range of initial stockings in southern China[J]. New Forests,2011,41:95-112.
[3] 叶绍明,温远光,杨梅,等.连栽桉树人工林生产力和植物多样性及其相关性分析[J].西北植物学报,2010,30(7):1458-1467.
[4] CHEN F, ZHENG H, ZHANG K, et al. Soil microbial community structure and function responses to successive planting of[J]. Journal of Environmental Sciences,2013,25(10):2102-2111.
[5] 苏贻攀.桉树连栽对土壤养分含量的影响及应对措施[J].福建林业科技,2016,43(2):206-211,246.
[6] JANSSENS I A, DIELEMAN W, LUYSSAERT S, et al. Reduction of forest soil respiration in response to nitrogen deposition[J]. Nature Geoscience,2010,3(5):315-322.
[7] BANNING N C, GLEESON D B, GRIGG A H,et al. Soil microbial community successional patterns during forest ecosystem restoration[J]. Applied and environmental microbiology, 2011,77(17):6158-6164.
[8] XU Y X, DU A P, WANG Z C, et al. Effects of different rotation periods ofplantations on soil physiochemical properties, enzyme activities, microbial biomass and microbial community structure and diversity[J]. Forest Ecology and Management, 2020,456:117683.
[9] XU Y X, REN S Q, LIANG Y F, et al. Soil nutrient supply and tree species drive changes in soil microbial communities during the transformation of a multi-generationplantation[J]. Applied Soil Ecology,2021,166:103991.
[10] WALKLEY A. An Examination of methods for determining organic carbon and nitrogen in soils(with one text-figure.)[J]. Journal of Agricultural Science,1935,25(4): 598-609.
[11] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[12] WU L K, LI Z F, LI J, et al. Assessment of shifts in microbial community structure and catabolic diversity in response to Rehmannia glutinosa monoculture[J]. Applied Soil Ecology,2013,67:1-9.
[13] 王嘉琛,赵隽宇,黄康庭,等.桂北土壤肥力质量对尾叶桉人工林连栽连作的响应[J].西南林业大学学报,2019,39(1):106-113.
[14] WUBET T, CHRIST S, SCHÖNING I , et al. Differences in soil fungal communities between European beech(L.) dominated forests are related to soil and understory vegetation[J]. PloS one, 2012, 7(10): e47500.
[15] LI Y F, L Y F, CHANG S X, et al. Linking soil fungal community structure and function to soil organic carbon chemical composition in intensively managed subtropical bamboo forests[J]. Soil Biology and Biochemistry, 2017, 107:19-31.
[16] LINDAHL B, STENLID J A N, OLSSON S, et al. Translocation of 32P between interacting mycelia of a wood-decomposing fungus and ectomycorrhizal fungi in microcosm systems[J]. The New Phytologist,1999, 144(1): 183-193.
[17] 杨钙仁,张秀清,蔡德所,等.广西主要人工林凋落物分解过程及其对淋溶水质的影响[J]. 应用生态学报,2012,23(1):9-16.
[18] BERG B. Litter decomposition and organic matter turnover in northern forest soils[J]. Forest Ecology and Management, 2000,133(1):13-22.
[19] BALDRIAN P. Microbial activity and the dynamics of ecosystem processes in forest soils[J]. Current Opinion in Microbiology,2017,37:128-134.
[20] ZHU L Y, WANG X H, CHEN F F, et al. Effects of the successive planting ofon the soil bacterial and fungal community structure, diversity, microbial biomass, and enzyme activity[J]. Land Degradation & Development, 2019, 30(6):636-646.
Structure and Diversity of Soil Fungal Communities Under Successive Rotations of
LIN Zhongxin, WANG Zhichao, ZHU Wankuan, DU Apeng, XU Yuxing
(1.2.)
This study examined changes of soil fungal community structure and diversity inplantations over successive rotations in Qipo Forest Farm, Guangxi. The soil fungal communities and their diversity were analysed using a high-throughput sequencing platform and redundancy analysis to evaluate nine chemical indicators. The results showed that multiple successive rotations had significant effects on soil chemical properties and fungal communities. Successive rotations caused a significant increase in nutrient content, fungal diversity and richness in the soil of second rotationplantations, followed by a significant decrease in these soil parameters in the third and fourth rotations. At the same time, multiple successive rotations led to significant changes in fungal community structures, with the relative abundance of the dominant fungal phylumdecreasing significantly and the relative abundance of phylumincreasing significantly in the soils by the third and fourth rotation of. The development and changes in soil fungal community structure appeared to be driven by the key soil factors of available potassium and nitrate nitrogen.
plantation; high-throughput sequencing; soil fungi; community structure; diversity
10.13987/j.cnki.askj.2021.04.001
S718.5
A
广东省自然科学基金面上项目(2020A1515011404);雷州半岛多功能人工林构建技术及综合效益评价(2018KJCX014);广东林业生态监测网络平台建设项目及广东省湛江桉树森林生态系统国家定位观测研究站运营项目
林忠鑫(2000— ),男,在读本科,E-mail:1205003260@qq.com
许宇星(1987— ),男,助理研究员,主要从事桉树可持续经营研究,E-mail:cercxuyx@caf.ac.cn

