唾液lnc-JAKMIP2-1∶1对早期肝细胞癌的诊断价值
谢子钧 雷一鸣 刘慧玲 江洁
【摘要】目的 探讨唾液中可作为协诊早期肝细胞癌的lncRNA标志物。方法 首先利用Agilent基因芯片技术,在3份正常肝组织和3份肝细胞癌组织中挑选表达差异最明显的一种lncRNA。然后扩大样本量,利用定量PCR技术检测这种lncRNA在肝细胞癌和对照正常组织、血浆和唾液中的表达水平。结果 lncRNA-JAKMIP2-1∶1在肝细胞癌患者的癌组织、血浆和唾液中均明显升高(P均< 0.05),在肝细胞癌患者的癌组织、血浆和唾液中3种样本中的表达显示两两呈正相关,同時lnc-JAKMIP2-1∶1在早期(Ⅰ/Ⅱ期)肝细胞癌患者的唾液中表达就已经明显升高,在接受手术后,其表达又明显下降。通过受试者工作特征曲线分析,唾液lnc-JAKMIP2-1∶1诊断早期肝细胞癌的灵敏度为100%,特异度为86%。结论 唾液lnc-JAKMIP2-1∶1是协诊早期肝细胞癌的理想标志物。
【关键词】唾液;长链非编码核糖核酸-JAKMIP2-1∶1;肝细胞癌;诊断;生物标志物
Diagnostic performance of salivary lnc-JAKMIP2-1∶1 for early hepatocellular carcinoma Xie Zijun, Lei Yiming, Liu Huiling, Jiang Jie. Department of Gastroenterology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Xie Zijun, E-mail: stephenxzj@qq.com
【Abstract】Objective This study was designed to explore lncRNA biomarkers in the saliva for detecting early hepatocellular carcinoma(HCC). Methods The most aberrantly-expressed lncRNAs were identified by Agilent microarray in 3 normal liver tissues and 3 HCC tissues. The most aberrantly-expressed lncRNA was selected as a candidate biomarker. Subsequently, the expression level of the candidate lncRNA was measured by qPCR in the tissue, plasma and saliva of HCC patients and controls. Results The expression level of lncRNA-JAKMIP2-1∶1 was significantly up-regulated in the HCC tissue, plasma and saliva of HCC patients compared with that of controls. The expression levels of lnc-JAKMIP2-1∶1 were positively correlated in any two of these three samples. In addition, the expression level of lnc-JAKMIP2-1∶1 was significantly up-regulated in the saliva of patients with early HCC (stage Ⅰ/Ⅱ), whereas it was significantly down-regulated after hepatectomy. According to the analysis of receiver operating characteristic curve, the diagnostic sensitivity of salivary lnc-JAKMIP2-1∶1 for early HCC was 100% and 86% for the specificity. Conclusion Salivary lnc-JAKMIP2-1∶1 shows great potential as a biomarker for detecting early HCC.
【Key words】Saliva; lnc-JAKMIP2-1∶1; Hepatocellular carcinoma; Diagnosis; Biomarker
据统计,90%以上的肝癌为肝细胞癌(以下简称肝癌)。就全球范围而言,肝癌的致死率在男性中排第二,女性中排第六,5年总体生存率约在5%~9%。中国肝癌患者占全球新发和死亡病例的一半以上[1]。若早期肝癌(分期为Ⅰ/Ⅱ)患者接受根治性肝癌切除术,5年的总体生存率可达69%,但大约80%的肝癌患者在诊断时已属晚期,失去了根治性手术的机会[2]。
多项研究发现,多种长链非编码RNA(lncRNA,长度≥200 bp)在肝癌的癌组织和肝癌患者的血液中对肝癌展示出良好的诊断价值[3]。组织细胞通过坏死和凋亡将lncRNA释放到血液循环中,由于人体的唾液腺有广泛血供,唾液被认为是血液循环的终产物。血液循环中的分子物质可以通过唾液腺细胞重吸收然后释放到唾液中,也可以通过唾液腺细胞中的间隙直接释放到唾液中。所以唾液含有血液中的大部分分子物质[4]。因此,唾液可能代替某些血液检测协诊各类疾病。本研究旨在从唾液中找出协诊早期肝癌的lncRNA标志物。
材料与方法
一、患者与样本
样本于2011年5月至2016年6月在中山大学附属第三医院收集。本研究共选取3组研究对象:健康对照组、早期肝癌组、中晚期(Ⅲ/Ⅳ)肝癌组,每组各50例。癌症分期按文献[5]中美国癌症联合会癌症分期第8版划分。健康对照个体定义为常规体检中X线胸片、口腔检查、腹部超声等无异常发现;粪便潜血、血清甲胎蛋白、癌胚抗原、HBsAg、丙型肝炎病毒抗体、HIV抗体、梅毒抗体均为阴性或正常。肝癌患者在收集样本前未接受过放射化学治疗、生物治疗或靶向治疗。同时没有并发如糖尿病、SLE、肾衰竭等器質性疾病和其它癌症。早期肝癌患者均接受了根治性肝癌切除术,癌症分期按病理划分。中晚期肝癌由肿物活组织检查或CT/MRI确定。正常肝组织来源于肝血管瘤患者血管瘤旁5 cm以上的肝组织。正常肝组织、肝癌组织由2位专业的病理学医师确定。
二、方 法
1.样本的收集
手术切除组织离体后立即放入液氮,后置于-80℃冰箱保存。血浆的收集使用5 mL规格EDTA抗凝管,收集患者约3 mL静脉全血后在4℃离心机使用3000×g离心10 min,收集上清后转移至2 mL无酶EP管,后再在4℃中使用12 000×g离心10 min,最后再次收集上清转移至新的EP管中,置于-80℃冰箱保存。在收集唾液前受检个体须禁食、禁烟、禁止喝水2 h以上,后将唾液吐入20 mL规格无酶离心管。收集大概3 mL唾液,先在4℃离心机使用3000×g离心10 min,收集上清后转移至2 mL无酶EP管,后再在4℃中使用
12 000×g离心10 min,最后再收集上清转移至新的EP管中,置于-80℃冰箱保存。
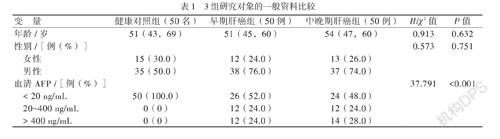
2.候选标志物的挑选
利用Agilent芯片高通量检测并比较已发现的lncRNA在正常肝组织和肝癌组织中的差异性表达。原始结果已上传至美国国家生物技术信息中心(NCBI)中的高通量基因表达(GEO)数据库中,提取码为GSE98269。根据芯片结果,选择一种在正常肝组织及肝癌组织中表达差异最显著,且P <
0.001的lncRNA作为候选的标志物。随后选10份肝癌组织样本和10份正常肝组织样本、10份肝癌患者和10份健康对照者的血浆、10份肝癌患者和10份健康对照者的唾液,利用qPCR对候选lncRNA标志物在这些样本中的表达进行更精确地定量。检验2组间的差异性,若此种lncRNA在3种样本中的表达都显示出一致的差异性,将扩大样本量,进一步验证该样本是否在肝癌患者的唾液中存在显著差异性表达。
3. lnc-JAKMIP2-1∶1表达水平的测定
组织总RNA使用TRIzol (Thermo Fisher Scientific, 美国)试剂提取,血浆和唾液总RNA使用mirVana PARIS Kit (Thermo Fisher Scientific,美国)试剂盒提取。具体提取方法严格按照厂家说明书。使用ReverTraAce qPCR RT Kit (Toyobo, 日本)对RNA进行逆转录成cDNA,后使用Maxima SYBR Green qPCR master mixes (Thermo Fisher Scientific, 美国)对lnc-JAKMIP2-1∶1和内参β-actin进行定量PCR(qPCR)反应,测定两者在样本中的表达水平。qPCR使用ABI 7500 Real-Time PCR System (Thermo Fisher Scientific, 美国),反应设置为95℃孵育10 min,然后95℃反应15 s后再60℃反应32 s,共40个循环。设置溶解曲线以确定反应的特异性。每个样本设立3个重复。lnc-JAKMIP2-1∶1的表达量使用β-actin做内参校正。lnc-JAKMIP2-1∶1引物:上游5’-CCATTCCCAATGCCTGAACTTC-3’,下游5’-
ACAAAGTGCATACCTACCCAATG-3’;β-actin:
5’-GTCTTCCCCTCCATCGTG-3’,下游5’-AGGGTG
AGGATGCCTCTCTT-3’。lnc-JAKMIP2-1∶1的表达水平使用2-ΔΔCt计算。
三、统计学处理
采用SPSS 22.0处理数据。所有数据均不符合正态分布,采用M(QL,QU)表示,2组间比较采用Mann Whitney U 检验,多组间比较采用Kruskal-Wallis 检验,两两比较采用Bonferroni法校正检验水准,术前术后比较采用Wilcoxon 符号秩和检验。定性资料用例(%)表示,其中无序分类资料组间比较采用卡方检验,等级资料组间比较采用Kruskal-Wallis检验。描绘受试者工作特征(ROC)曲线,并根据该曲线获得唾液lnc-JAKMIP2-1∶1对早期或总体肝癌诊断的灵敏度和特异度。2组间的相关性采用Spearman秩相关分析。α= 0.05。
结 果
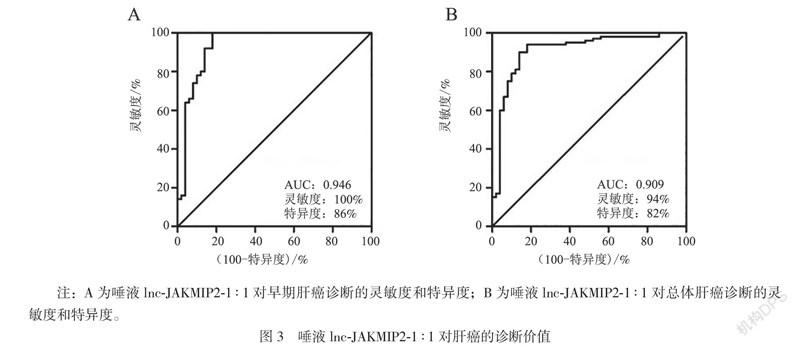
一、3组研究对象的一般资料比较
3组研究对象的年龄(χ2 = 0.573,P = 0.632)、性别比较差异无统计学意义(H = 0.917,P = 0.632);早期、中晚期肝癌中位发病年龄分别为51、54岁左右,男女比例为73∶27。50%的肝癌患者的血清AFP正常(< 20 ng/mL),26%的患者超过提示肝癌的底限400 ng/mL,见表1。
二、候选lncRNA标志物的挑选
基因芯片发现lnc-JAKMIP2-1∶1在肝癌组织中最显著高表达(在肝癌组织的信号表达是正常肝组织的2450.3倍,P =0.0002)。因此其初步被选定为候选lncRNA标志物。接着在肝癌组织、肝癌患者血浆、肝癌患者唾液均发现其显著高表达,见图1。同时,由于肝癌组织、血浆和唾液都来自同一批患者,利用Spearman秩相关性分析对lnc-JAKMIP2-1∶1在3种样本中进行两两比较,发现其在任意两种标本中的表达都显著正相关。在同一批肝癌患者中,癌组织lnc-JAKMIP2-1∶1与血浆lnc-JAKMIP2-1∶1中的表达量呈两两显著正相关,秩相关系数为0.806(P = 0.005);血浆lnc-JAKMIP2-1∶1与唾液lnc-JAKMIP2-1∶1中也两两正相关,秩相关系数为0.891(P = 0.005)。同样,癌组织lnc-JAKMIP2-1∶1与唾液lnc-JAKMIP2-1∶1中也两两正相关,秩相关系数为0.697(P = 0.025)。
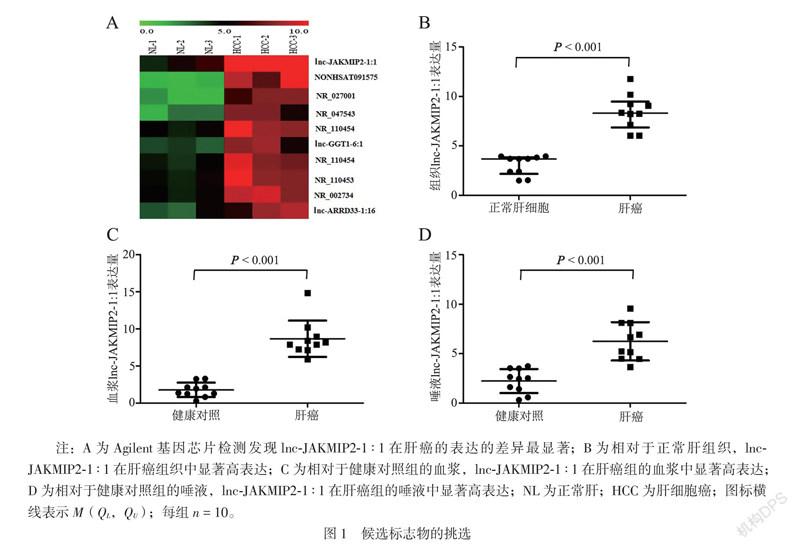
三、候选lncRNA标志物的验证
扩大样本量,选取3组,每组50例个体——健康对照组、早期肝癌组、中晚期肝癌组。然后利用qPCR对lnc-JAKMIP2-1∶1对3组个体的唾液中的表达量进行精确定量。3组间比较差异有统计学意义(H = 66.499,P < 0.001),两两比较发现相对于健康对照组,唾液lnc-JAKMIP2-1∶1在早期肝癌组(Z = -7.500, P < 0.05/3)、中晚期肝癌组(Z = -6.597,P < 0.05/3)中均明显高表达,平均升高倍数分别为2.3倍和2.4倍;唾液lnc-JAKMIP2-1∶1在早期肝癌组和中晚期肝癌组的表达水平比较差异无统计学意义(Z = -0.193,P = 0.847),见图2A。在早期肝癌患者接受根治性肝癌切除术后7 d以上再收集患者唾液,检测术后患者lnc-JAKMIP2-1∶1的表达,利用Wilcoxon 符号秩和检验发现唾液lnc-JAKMIP2-1∶1在根治性肝癌切除术后的表达下调(Z = -5.970,P < 0.001),见图2B。
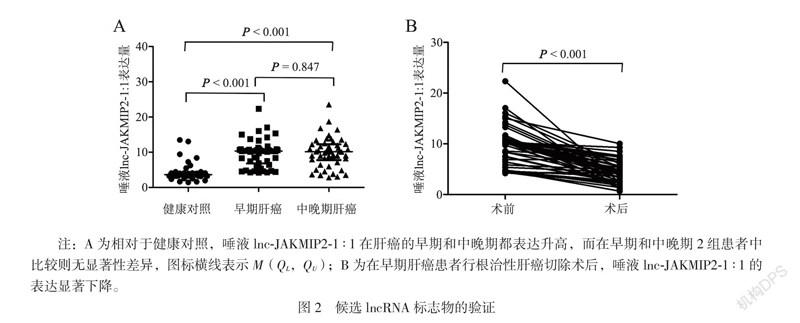
四、唾液lnc-JAKMIP2-1∶1对肝癌的诊断价值
通过ROC曲线分析,发现唾液lnc-JAKMIP2
-1∶1对早期肝癌诊断的灵敏度为100%,特异度为86%,曲线下面积(AUC)为0.946,而不论癌症分期,唾液lnc-JAKMIP2-1∶1对整体肝癌诊断的灵敏度为94%,特异度为82%,AUC 0.909,见图3。
讨 论
本研究初步提示唾液lnc-JAKMIP2-1∶1对肝癌的早期诊断有提示作用。lnc-JAKMIP2-1∶1在肝癌患者中的癌组织、血浆和唾液中都明显高表达,且它们的表达水平在每两种样本中都显著相关。同时,在肝癌患者行根治性肝癌切除术后,唾液lnc-JAKMIP2-1∶1显著下降,初步提示了唾液lnc-JAKMIP2-1∶1来源于肝癌的分泌,然后通过血液循环释放到唾液中。因此,唾液lnc-JAKMIP2-1∶1对肝癌起到“液体活检”的作用。通过ROC曲线分线,唾液lnc-JAKMIP2-1∶1诊断早期和整体肝癌的灵敏度和特异度均在80%以上。现时,血清甲胎蛋白是美国FDA唯一批准协诊肝癌的分子标志物,非妊娠个体的血清甲胎蛋白值大于400 ng/mL,可高度怀疑罹患肝癌。但在多项研究中均发现,血清甲胎蛋白对肝癌的诊断价值较低,而在本研究中,无论早期还是晚期肝癌,只有不到30%的患者高于此值。因此,虽然血清甲胎蛋白对肝癌有提示作用,但灵敏度有限。所以在亚太肝癌临床实践和美国肝病研究协会的指南中均不推荐甲胎蛋白作为筛查肝癌的检测手段[6-7]。
而此研究初步表明唾液lnc-JAKMIP2-1∶1对肝癌的诊断价值优于血清甲胎蛋白,这对日后寻找更理想的肝癌标志物提供了新的方向。此外,唾液lnc-JAKMIP2-1∶1在早期肝癌和中晚期肝癌的表达水平无显著差异。这提示唾液lnc-JAKMIP2-1∶1的高表达是肝癌的早期事件,与肝癌的进展无关,有利于肝癌的早期筛查。
唾液是由数千个大小不等的唾液腺分泌的产物,唾液腺被毛细血管网广泛包裹缠绕,接受血液循环物质的分泌,血液中的各种物质,例如DNA、RNA、蛋白及代谢性产物等都可见于唾液。因此,唾液被认为是血液循环的终产物。越来越多的研究发现,lncRNA调控着人体各种生理和病理生理过程,包括癌症的发生、发展。有研究者发现,lncRNA不像普通的mRNA,它高度稳定,即使经过多重冰冻/解冻循环、强酸强碱的腐蚀、RNA酶的消化以及处于超高温环境中,lncRNA可依然保持完好无损[8]。同时,采集唾液无创、简便,操作者无需特别培训,且不会引起受试者的不适,受试者依从性更好,因此唾液lncRNA作为协诊疾病的分子标志物有巨大的优势。多种分子物质,已经证明了它们在唾液中的表达,与其在血液和组织中的表达呈正相关性,例如,CRP、IL-6、HIV抗体、微RNA、前列腺特异性抗原等[9-12]。特别是HIV抗体,由于其表达与血液表达成高度正相关性,美国FDA已经批准了多款用唾液代替血液检测HIV感染的试剂盒,并且在美国已广泛使用[13]。因此,有理由相信唾液lncRNA有望取代血液,成为“液体活检”的新方向。
该研究属于癌症标志物的1期单中心研究,且参与的个体数量较少,因此,需要大样本、多中心的研究以证实该发现。但此前期研究为未来寻找协助早诊肝癌的分子標志物提供了新的思路。
综上所述,唾液lnc-JAKMIP2-1∶1对早期肝癌的诊断具有良好的灵敏度和特异度,它有可能在将来对罹患肝癌的高危人群,例如慢性肝炎、肝硬化患者起到早期筛查的目的。
参 考 文 献
[1] Torre L A, Bray F, Siegel R L, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin,2015, 65(2):87-108.
[2] Llovet J M, Zucman-Rossi J, Pikarsky E, Sangro B, Schwartz M, Sherman M, Gores G. Hepatocellular carcinoma. Nat Rev Dis Primers,2016,2:16018.
[3] Huang Z, Zhou J K, Peng Y, He W, Huang C. The role of long noncoding RNAs in hepatocellular carcinoma. Mol Cancer,2020,19(1):77.
[4] Wang X, Kaczor-Urbanowicz K E, Wong D T. Salivary biomarkers in cancer detection. Med Oncol,2017,34(1):7.
[5] Park S, Choi S, Cho Y A, Sinn D H , Kim J M , Park C K , Ha S Y. Evaluation of the American Joint Committee on Cancer (AJCC) 8th edition staging system for hepatocellular carcinoma in 1,008 patients with curative resection. Cancer Res Treat,2020, 52(4): 1145-1152.
[6] Omata M, Cheng A L, Kokudo N, Kudo M, Lee J M, Jia J,Tateishi R, Han K H, Chawla Y K, Shiina S, Jafri W, Payawal D A, Ohki T, Ogasawara S, Chen P J, Lesmana C R A, Lesmana L A, Gani R A, Obi S, Dokmeci A K, Sarin S K. Asia-pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update. Hepatol Int,2017,11(4):317-370.
[7] Bruix J, Sherman M; American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology,2011,53(3):1020-1022.
[8] Tong Y S, Wang X W, Zhou X L, Liu Z H, Yang T X, Shi W H,Xie H W, Lv J, Wu Q Q, Cao X F. Identification of the long non-coding RNA POU3F3 in plasma as a novel biomarker for diagnosis of esophageal squamous cell carcinoma. Mol Cancer,2015,14:3.
[9] Dekker R L, Lennie T A, Moser D K, Miller C S, Ebersole J L, Chung M L. Salivary biomarkers, oral inflammation, and functional status in patients with heart failure. Biol Res Nurs,2017,19(2):153-161.
[10] Fransen K, Vermoesen T, Beelaert G, Menten J, Hutse V, Wouters K,Platteau T, Florence E. Using conventional HIV tests on oral fluid. J Virol Methods, 2013 ,194(1-2):46-51.
[11] Sazanov A A, Kiselyova E V, Zakharenko A A, Romanov M N, Zaraysky M I. Plasma and saliva miR-21 expression in colorectal cancer patients. J Appl Genet,2017,58(2):231-237.
[12] Shiiki N, Tokuyama S, Sato C, Kondo Y, Saruta J, Mori Y,Shiiki K, Miyoshi Y, Tsukinoki K. Association between saliva PSA and serum PSA in conditions with prostate adenocarcinoma. Biomarkers,2011,16(6):498-503.
[13] Lee Y H, Wong D T. Saliva: an emerging biofluid for early detection of diseases. Am J Dent,2009,22(4):241-248.
(收稿日期:2021-08-25)
(本文編辑:杨江瑜)

