肺岩宁方对Lewis肺癌小鼠肿瘤浸润性髓样细胞的调控作用研究
张琦君,殷书敏,车勇,祝利民,罗振东,郭玉刚,徐振晔*
(1.上海市虹口区江湾医院/上海健康医学院附属第一康复医院,上海 200434;2.上海中医药大学附属龙华医院,上海 200032)
原发性支气管肺癌是当前全球最常见的恶性肿瘤之一,居恶性肿瘤病死率第1位。我国肺癌发病率近几十年来呈现激增的趋势,五年患病率已达130.2(1/10万),其中男性患病率居恶性肿瘤第2位;女性患病率居恶性肿瘤第4位[1]。目前肺癌的治疗除了手术、放化疗、靶向治疗外,随着抗PD-1/PD-L1等免疫疗法药物的出现,让人们看到了肺癌治疗的新突破,同时也认识到在肿瘤发生及恶性进展的过程中,肿瘤浸润性髓样细胞(Tumor-infiltrating myeloid cells, TIMs)发挥了重要的作用,这些细胞一旦被招募到肿瘤微环境中,可以促进肿瘤细胞向恶性发展,发生免疫逃逸,最终促进肿瘤的进展,还可以导致抗肿瘤治疗失败或耐药发生,成为目前肿瘤研究的热点。肿瘤浸润性髓样细胞表现为髓系起源,分化不成熟的特点,包括髓源性抑制细胞(Myeloid-derived suppressor cells, MDSCs)、肿瘤相关性巨噬细胞(Tumor-associated macrophages, TAMs)等一类粒系或单核系来源的细胞群,大量存在于实体瘤基质中,在受到肿瘤、炎症等刺激后,在肿瘤细胞、各种细胞因子、趋化因子等作用下,通过内源性基因驱动或外源性途径激动,被招募至肿瘤组织,分化成具有免疫抑制活性的一类髓样细胞,对T淋巴细胞产生潜在的免疫抑制作用,表现出明显的免疫抑制活性,使得肿瘤细胞获得干扰宿主免疫功能的作用,导致了肿瘤免疫逃逸的出现,刺激肿瘤细胞增殖,促进肿瘤侵袭转移[2-3]。无论在动物实验还是临床研究中均证实MDSCs、TAMs的数量与肿瘤的恶性程度及患者的不良预后相关,通过对MDSCs、TAMs的阻断可在一定程度上恢复机体抗肿瘤反应,抑制肿瘤的生长[4]。
肿瘤免疫治疗,与手术切除肿瘤、放化疗或靶向药物杀伤肿瘤细胞不同,通过人体自身的免疫系统来调节干预肿瘤微环境的方式以消灭癌细胞。中医药整体观念的思路与肿瘤免疫治疗的理念不谋而合,通过对机体免疫微环境的调节及重塑,逆转肿瘤免疫逃逸的状态,改善肿瘤微环境中的关键细胞及其功能,从而发挥抗肿瘤、抗转移复发的作用。徐振晔教授根据长期临床观察,基于现代肺癌患者发病特点,结合中医基础理论中“金水相生”的概念,发挥张景岳补肾学术思想,在国内首次提出肺癌治疗的“精气理论”,根据“益气养精,解毒散结”的治疗大法,研制中药复方肺岩宁方,临床研究提示使肺癌患者生存期、临床症状方面获益明显[5],体外实验证实肺岩宁方颗粒剂具有调节TAMs极化及其分泌的细胞因子,抑制Lewis肺癌细胞迁移的作用[6]。本实验通过动物体内实验,进一步观察肺岩宁方对肺癌局部肿瘤微环境中肿瘤浸润性髓样细胞MDSCs、TAMs的调控作用,挖掘其抑瘤作用的免疫基础,深入探索其内在机制,为其今后临床开发应用提供研究基础。
1 材料
1.1 细胞与动物
小鼠Lewis肺癌细胞株购自中国科学院上海生命科学研究院细胞资源中心。SPF级C57BL/6纯系小鼠38只,雄性,体质量(20±2)g,由上海中医药大学动物实验中心代购于上海斯莱克实验动物有限责任公司,许可证号:SYXK(沪)-2014-008。小鼠在动物实验中心SPF级动物房饲养,室温(25±2)℃,采用食饲料饲养方式,自由进食与饮水。动物实验经上海中医药大学实验动物福利与伦理委员会审查,符合实验动物福利与伦理相关规范,伦理编号:PZSHUTCM190628010。
1.2 药品及试剂
肺岩宁方组方:生黄芪30 g,白术9 g,石见穿30 g,山慈菇12 g,蜂房9 g,干蟾皮6 g,仙灵脾15 g,黄精30 g,山茱萸15 g,灵芝15 g,七叶一枝花9 g,14贴中药共计生药2 520 g,于上海中医药大学附属龙华医院中药房进行标准化水煎提,水煎液经醇提后将药物浓缩至生药含量为2 g/mL、4 g/mL[7],-80 ℃保存备用。IL-4 ELISA试剂盒(Cat:SD0168,Lot:20190315)、IL-10 ELISA试剂盒(Cat:SD0170,Lot:20190315)购自上海司鼎生物科技有限公司;小鼠CD16/32单抗(Cat:553142)购自BD公司;小鼠F4/80-PE-cy5(Cat:123110)、CD86-PE(Cat:105008)、CD206-FITC(Cat:141704)、CD11b-APC(Cat:101212)、Gr1-PE(Cat:108408)单克隆抗体购自Biolegend公司;PD-1(Cat:ab214421)、PD-L1(Cat:ab238697)蛋白Marker购自Abcam公司;PI3K(Cat:5405S)、C/EBPβ(Cat:3082S)蛋白 Marker购自CST公司。
1.3 实验仪器
DMI3000B荧光倒置显微镜(Leica公司);RM2235型病理切片机(上海徕卡仪器有限公司);HS1125型组织摊片机(浙江省金华市华速科技有限公司);5810R型冷冻离心机(Eppendorf 公司);F50型酶标检测仪(Tecan公司);FACSVerse流式细胞仪(BD公司);qRCR仪Stepone plus型(ABI公司);1645050 型电泳仪(BIO-RAD 公司);V370型扫描仪(EPSON 公司)。
2 实验方法
2.1 造模与分组
小鼠在动物实验中心SPF级动物房饲养,适应性喂养1周后开始实验。采用随机数字表法取8只C57BL/6小鼠分为正常组,取余下30只C57BL/6小鼠进行造模,造模方法:取对数生长期小鼠Lewis肺癌细胞,消化、离心、重悬后制备成细胞密度为5.0×106/mL的细胞悬液,取0.1 mL注射于C57BL/6小鼠尾静脉,建立Lewis小鼠肺癌模型,接种7 d后随机抽取6只小鼠处死剥取肺组织,福尔马林液中固定,镜下观察肺组织肿瘤细胞转移情况。判断造模成功后,余下24只小鼠随机分为模型组、肺岩宁低剂量组、肺岩宁高剂量组,每组8只。造模成功后开始给药干预,正常组、模型组给予生理盐水0.4 mL灌胃,每日1次;肺岩宁低剂量组给予肺岩宁方0.4 mL 40 g/(kg· d)灌胃,每日1次;肺岩宁高剂量组给予0.4 mL肺岩宁方80 g/(kg·d)灌胃,每日1次。各组小鼠实验干预2周,末次灌胃后禁食12 h后2%异氟烷吸入麻醉,摘眼球取血,断颈处死,迅速剥离肺组织,分别保存备用。
2.2 小鼠肺组织病理学检测
剥取小鼠肺组织进行包埋、切片、脱水、染色,中性树脂胶封片,显微镜下观察小鼠肺组织瘤灶。
2.3 流式细胞仪检测肺组织中MDSCs、M1及M2型TAMs细胞水平
肺组织研磨后,制备小鼠肺组织单细胞悬液,1 500 r/min离心5 min,弃上清,加入PBS重悬细胞,将细胞数调整至1 × 107/mL。取100 μL细胞悬液至标记好的流式上样管中,每管加入 2 μL(1 mg) CD16/CD32单抗,冰上避光封闭10 min。加红细胞裂解液3 mL,冰上静置20 min,1 500 r/min离心5 min,弃上清,加入PBS 300 μL重悬细胞。一管加入F4/80-PE-cy5、CD11b-APC、CD86-PE、CD206-FITC 各 5 μL;另一管加入CD11b-FITC、Gr1-PE各5 μL,冰上避光孵育20 min。1 500 r/min离心5 min,弃上清,PBS 300 μL重悬细胞,避光4 ℃保存,1 h内上机检测。
2.4 ELISA法检测血清IL-4、IL-10浓度
1.5 mL EP管收集各组小鼠血液标本,3 000 r/min,4 ℃离心20 min,收集血清,2~8 ℃保存,48 h内进行检测。根据IL-4、IL-10试剂盒中步骤操作,样本酶标仪下450 nm处测吸光值(OD) 。以标准品2 000、1 000、500、250、125、62.5、31.2、0 pg/mL为横坐标,OD值为纵坐标,使用软件作图,画出标准曲线。根据样品OD值计算出相应IL-4、IL-10含量。
2.5 实时荧光PCR检测
采用Trizol提取总RNA,利用紫外分析测定所抽提RNA的浓度,取1.0 μg总RNA利用TB Green qPCR试剂盒逆转录为c-DNA,逆转录条件为37 ℃反应15 min,85 ℃变性5 s,4℃保存。引物序列由上海生工生物工程技术服务有限公司设计并合成,以GAPDH为内参,小鼠iNOS上游引物:GTTCTCAGCCCAACA ATACAAGA-3’,下游引物:5’-GTGGACGGGTCGAT GTCAC;小鼠Arg上游引物:GAGCC ACCGTTTTACATT GTGA-3’,下游引物:5’-CTCGCCCACTAGGCAGTTC。反应条件: 95 ℃,30 s;95 ℃,5 s;60 ℃ 34 s,共40个循环,检测荧光信号。每样本重复3孔,各个基因的相对表达水平以2-ΔΔCt进行统计分析。
2.6 Western blot检测
每组小鼠肺组织进行检测,提取肺组织总蛋白样品,经SDS-PAGE分离蛋白后,将蛋白转印于PVDF膜上,5%的脱脂牛奶封闭1 h,加入一抗(1∶1 000) 4 ℃过夜,TBST洗膜3次后加入二抗(1∶3 000)室温孵育1 h,TBST洗膜3次后显影曝光,图像扫描。采用Image J图像分析软件计算条带灰度值,将目标条带灰度值与内参灰度值对比表示目标蛋白相对表达量。
2.7 统计学方法
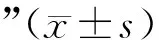
3 结果
3.1 造模小鼠大体及肺组织HE染色结果
接种后7 d随机挑选处死的6只小鼠中有2只小鼠肺表面有明显肉眼结节形成,其中1只小鼠同时出现了肝脏远处转移;其余4只小鼠未发现肺表面肉眼结节形成,但病理HE染色镜下可见肺内小结节形成,肿瘤细胞形成大小不等、排列不规则的癌巢,判断造模成功,见图1。
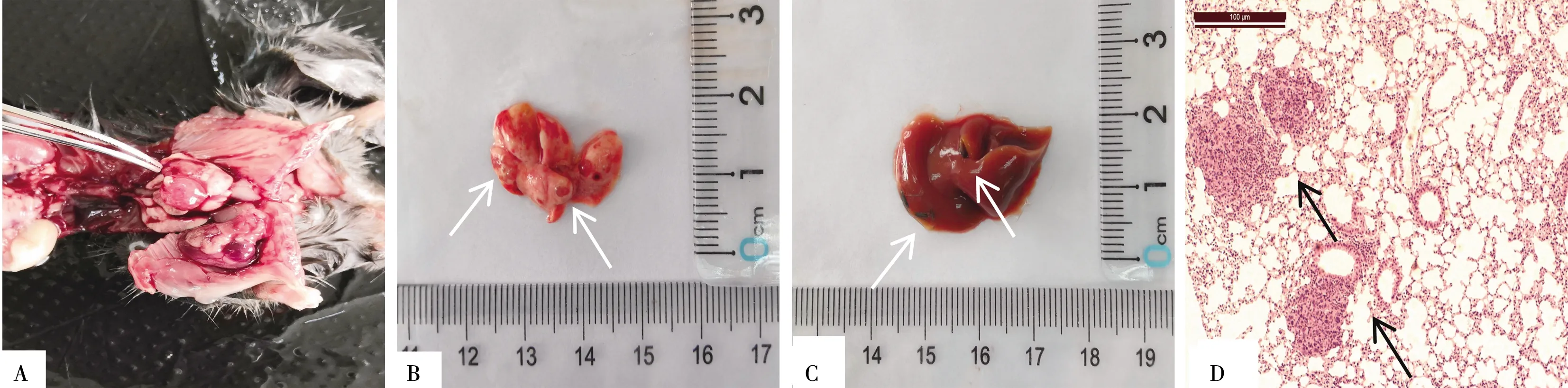
注:A.解剖可见小鼠肺部肉眼瘤结节形成;B.小鼠肺表面明显肉眼肿瘤结节形成,箭头所示为瘤结节;C.小鼠远道肝表面转移性肿瘤结节,箭头所示为脏脏表面瘤结节;D.肺内肿瘤细胞形成大小不一、排列不规则的癌巢,箭头所示为肺组织内癌巢形成。图1 荷瘤小鼠大体及病理HE染色观察
3.2 各组小鼠肺组织中MDSCs、M1及M2型TAMs细胞百分比比较
与空白组相比,模型组小鼠肺组织中M1型TAMs细胞百分比显著降低(P<0.05),M2型TAMs、MDSCs百分比显著上升(P<0.05);与模型组相比,肺岩宁低、高剂量组小鼠肺组织中M1型TAMs细胞百分比显著上升(P<0.05),M2型TAMs、MDSCs百分比显著降低(P<0.05),见表1、图2。
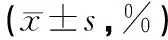
表1 各组小鼠肺组织TAMs、MDSCs淋巴细胞占比比较
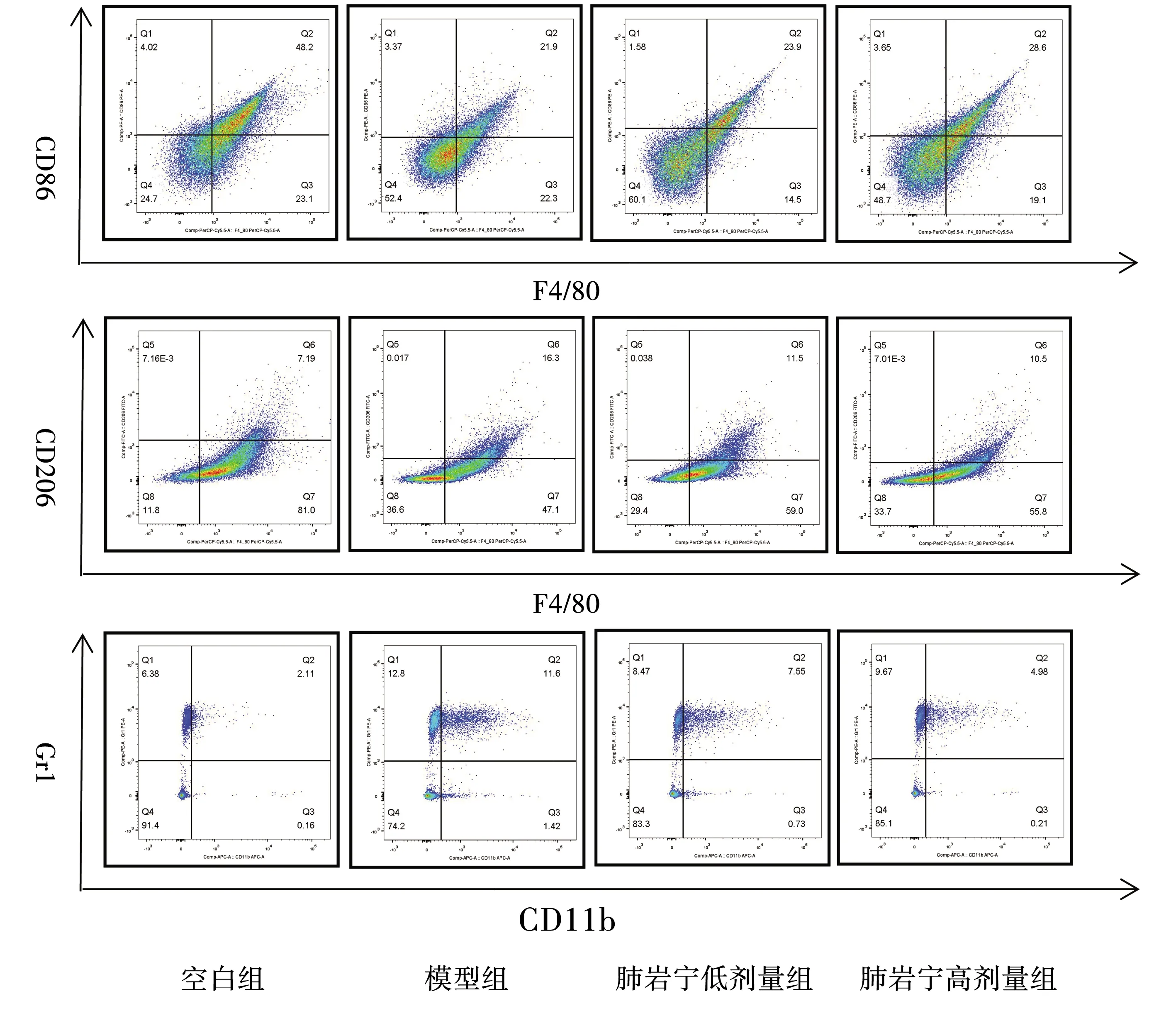
图2 各组小鼠肺组织中TAMs、MDSCs细胞流式图
3.3 各组小鼠血清中IL-4、IL-10水平
与空白组相比,模型组、肺岩宁低、高剂量组小鼠血清中IL-4、IL-10水平显著升高(P<0.05);与模型组相比,肺岩宁低、高剂量组小鼠血清中IL-4、IL-10水平显著降低(P<0.05);与肺岩宁低剂量组相比,高剂量组小鼠血清中IL-4、IL-10水平显著降低(P<0.05),见表2。
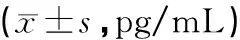
表2 各组小鼠血清中细胞因子水平
3.4 各组小鼠肺组织中iNOS、Arg mRNA表达水平
与空白组相比,模型组小鼠肺组织中 iNOS mRNA水平显著降低(P<0.05);与模型组相比,肺岩宁低、高剂量组小鼠肺组织中 iNOS mRNA水平显著升高(P<0.05)。与空白组相比,模型组小鼠肺组织中Arg-1 mRNA水平显著升高(P<0.05);与模型组相比,肺岩宁低、高剂量组小鼠肺组织中Arg-1 mRNA 水平显著降低(P<0.05),见表3。

表3 各组小鼠肺组织中iNOS、Arg-1 mRNA水平
3.5 各组小鼠肺组织中PD-1、PD-L1、PI3K、C/EBPβ表达水平
与空白组相比,模型组小鼠肺组织中PD-1、PD-L1、PI3K、C/EBPβ表达增加(P<0.05);肺岩宁低剂量组小鼠肺组织中PD-1、PD-L1、PI3K表达增加(P<0.05)。与模型组相比,肺岩宁高剂量组小鼠肺组织中PD-1、PD-L1、PI3K、C/EBPβ表达下调(P<0.05),肺岩宁低剂量组PD-L1表达下调(P<0.05);与肺岩宁低剂量组相比,肺岩宁高剂量组小鼠肺组织中PD-L1表达下调(P<0.05),见图3、表4。

图3 各组小鼠肺组织PD-1、PD-L1、PI3K、C/EBPβ表达比较

表4 各组小鼠肺组织PD-1、PD-L1、PI3K、C/EBPβ表达水平
4 讨论
肺癌属于中医学中“肺积”“痞癖”等范畴,徐振晔教授认为中医药抗肿瘤的优势不在于“彻底消灭”肿瘤,而在于“改造”肿瘤所处的内外环境,即重塑肿瘤微环境[8]。中医药整体调节、辨证施治的方式,将“扶正祛邪、调和阴阳”的总体辨治思路,从“病、症、证”的不同层面结合个体异质性施治,多靶点、多途径改善乏氧、酸中毒、慢性炎症及免疫抑制状态,恰恰解释了其通过对肿瘤微环境的调节达到抑制肿瘤抗转移的目的。肺岩宁方中生黄芪补气温阳、白术甘温健脾,两药相合,补肺脾肾之虚;黄精益精填髓、仙灵脾合山茱萸补肾温阳,三药相合,阴阳并补,阴中求阳,阳中求阴;石见穿、山慈菇、露蜂房、七叶一枝花、干蟾皮解毒散结,祛邪抗癌,诸药相合,攻补兼施、益气养精、解毒散结。全方着眼于“正气已虚”之本,兼顾“癌毒内结”之标,以益气养精之法固护机体整体正气,扶正培本,使抗邪之气源源不竭,“养正积自除”,注重脾肾先后天之本,增强机体抗病能力,并用解毒散结之品,重拳出击,务必使邪去正安,“疏其雍滞,令上下无碍,气血通调,则寒热自如,阴阳调达”(《素问·至真要大论》),攻补并蓄,总以调整整体气血阴阳、脏腑功能的平衡为主,以运动观念贯彻整个治疗过程中。本实验结果表明,肺岩宁方抑制MDSCs、M2 型TAMs等TIMs的增殖,促使TAMs表型向M1型转化,同时抑制MDSCs、TAMs精氨酸的合成及免疫抑制性细胞因子IL-4、IL-10的释放,从而达到重塑肿瘤微环境、改善肿瘤免疫抑制的目的。
免疫抑制性髓样细胞(Immunosuppressive myeloid cells)又被称为肿瘤浸润性髓样细胞(Tumor-infiltrating myeloid cells, TIMs),大量存在于实体瘤基质中,在受到肿瘤、炎症等刺激后被招募至肿瘤组织,分化成具有免疫抑制活性的一类髓样细胞。典型的TIMs有MDSCs及TAMs,MDSCs是一类未分化成熟并具有免疫抑制特性的髓源性细胞,其在肿瘤组织、淋巴结或血液循环中的聚集是肿瘤逃避免疫攻击的一个重要机制,为肿瘤的转移提供了有利条件[9],在NSCLC癌患者来源的异种移植瘤模型中,MDSCs浸润通过分泌趋化因子、诱导EMT促进肿瘤转移[10]。MDSCs利用CD45磷酸酶活性上调引起STAT3的抑制而分化为成熟的TAMs[11],两者均属于异质性程度较高的一类细胞群。TAM是肿瘤中浸润的主要炎症细胞,属于固有免疫系统细胞,具有杀伤肿瘤和促瘤生长的双重作用,根据其功能性可分为M1型(经典激活的M1型,Classically activated)及M2型(选择活化的M2型,Alternatively activated)两类,在肿瘤组织中,TAMs由抑瘤的M1型向M2型促瘤型分化,促进Th2淋巴细胞和Treg细胞分化和招募,促进肿瘤增殖、生长、转移、血管生成,降低机体主动免疫反应,为肿瘤的浸润、进展及转移提供了适宜的免疫环境[12]。
MDSCs及M2型TAMs的免疫抑制活性主要通过对T细胞耗竭或对其活性抑制发挥作用,与其消耗T细胞增殖所必须的代谢物、产生免疫抑制性细胞因子抑制T细胞功能、阻断T细胞检查点激活等机制相关。在动物模型和肿瘤患者组织中均发现MDSCs高表达Arg-1消耗细胞外L-精氨酸,抑制T细胞对精氨酸的利用,使T细胞上TCR缺乏CD3ζ链,抑制T细胞增殖及功能,通过对T细胞的耗竭发挥免疫抑制作用[13-14]。精氨酸酶和可诱导的iNOS存在互相竞争,在TAMs中,iNOS通过Th1型细胞因子来上调表达,而M2型TAMs通过Th2型细胞因子诱导释放高活性精氨酸酶,因此在实体瘤中招募到的M2型TAMs释放大量具有活性的精氨酸酶产生尿素和鸟氨酸,促进肿瘤细胞的增殖和血管生成[15]。本实验结果表明荷瘤状态下小鼠肺组织中MDSCs及M2型TAMs大量增殖,其Arg-1 mRNA表达增高,肺岩宁方可降低小鼠肺组织中MDSCs及M2型TAMs水平及Arg-1 mRNA表达水平;同时升高M1型TAMs水平及iNOS mRNA表达水平。
MDSCs及TAMs还可以通过产生免疫抑制性炎性细胞因子发挥免疫抑制活性,这些因子初始由肿瘤细胞分泌,支持肿瘤基质中MDSCs及M2细胞表型TAMs的募集和发育,继而形成恶性循环,维持免疫抑制环境,存在于肿瘤进展的全过程。IL-4、IL-10为Th2型细胞因子,通过激活STATs、PI3K信号通路诱导MDSCs生成及TAMs向M2型分化[16-17]。本实验结果表明肺岩宁方能下调荷瘤状态下小鼠外周血中IL-4、IL-10的表达,抑制MDSCs及M2型TAMs扩增,从功能层面重塑肿瘤免疫微环境。
在肿瘤中,PD-1/PD-L1信号通路异常激活,可抑制T细胞增殖及功能活化,诱导肿瘤免疫逃逸发生,肿瘤中浸润的髓样细胞MDSCs及TAMs的免疫抑制活性可直接介导免疫检查点阻断治疗耐药的发生,从而产生免疫抑制[18]。在小鼠模型中,选择性抑制巨噬细胞PI3Kγ/C/EBPβ活性,可恢复 CD8+T细胞活化和细胞毒性,增强免疫检查点抑制剂治疗作用,抑制肿瘤生长,延长瘤鼠生存[19],提示靶向 PI3K 通路的策略可能通过提高免疫疗法疗效治疗肿瘤的可行性。本实验结果表明肺岩宁方下调PD-1/PD-L1及 PI3K/C/EBPβ信号通路表达,同样具有抑制MDSCs及M2型TAMs扩增,诱导M2型TAMs向M1型转化的改善作用。
综上所述,肺岩宁方重塑肿瘤免疫微环境的作用体现在针对肿瘤形成过程中局部病灶寒热、虚实、气血、阴阳失调的基础,把握住致病因素与机体抗邪能力之间不平衡的关系,补其不足,损其有余,抑制肺癌局部免疫抑制性髓样细胞MDSCs及M2型TAMs增殖,调控M2 型TAMs重塑为具有抑瘤作用的M1型TAMs,调控其功能蛋白iNOS、Arg-1合成,下调IL-4、IL-10细胞因子水平,其内在作用机制可能与其抑制PD-1/PD-L1及PI3K/C/EBPβ信号通路相关。肺岩宁方调节肺癌肿瘤微环境的作用是其“益气养精,解毒散结”作用的一种外在具体体现,亟待进一步深入探讨其具体分子作用机制,为今后临床开发奠定一定的实验基础。

