维生素D与视神经脊髓炎谱系疾病
陈森林(综述),况时祥(审校)
(1.贵州中医药大学研究生院,贵州 贵阳 550002;2.贵州中医药大学第二附属医院神经内科,贵州 贵阳550003)
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是自身免疫介导的主要累及视神经和脊髓的中枢神经系统炎性脱髓鞘疾病,既往又称为视神经脊髓炎(neuromyelitis optica,NMO),具有反复复发的特点[1]。根据流行病学和基于人群的研究报告,NMOSD在欧洲和北美的患病率在<1/100 000~44/100 000之间[2],但亚洲国家NMOSD患病率要高于欧洲和北美。该病的发病机制及确切病因迄今未明,有研究表明,其发病主要与遗传、环境、免疫失衡等多重因素有关[3]。近年来,维生素D(vitamin D,VD)在生物医学研究的各个领域得到了越来越多的关注。研究发现,VD在人类中的主要作用是调节骨稳态和钙代谢,但它也是激活免疫防御系统和抑制免疫疾病病理的关键。现有流行病学证据表明,VD缺乏与NMOSD发病风险和病程有关[4]。约42% NMOSD患者存在VD不足(21~30 μg/L)[5]。本文将从VD的主要形式及代谢、VD在NMOSD中的作用、VD水平与NMOSD的愈后及VD治疗NMOSD的现状进行综述。
1 VD的主要形式及代谢
在VD庞大的家族系统中,VD3是VD的主要形式之一,VD3的结构及其编号系统[6]见图1。人体获得VD的途径主要有2种,一是从食物中获取少量的VD,二是大多数VD是在紫外线B(ultraviolet B,UVB)照射时产生的。紫外线作用于皮肤中的7-脱氢胆固醇而产生的激素原,在肝脏和肾脏中先后转化为25-羟基维D3[25(OH)D3]和1,25-二羟基维生素D3[1,25(OH)2D3][7]。具体表现为在肝细胞中,VD的25-羟基化至少可由四种酶完成,即所有微粒体细胞色素P450(CYP)亚型(CYP2DII、CYP2D25、CYP3A4和CYP2R1)[8]。在肾脏中,25(OH)D通过严格控制甲状旁腺激素和磷尿激素成纤维细胞生长因子23(FGF-23)的酶1-α羟化酶(CYP27B1)进一步转化为循环生物活性化合物钙3[9]。25-羟维生素D[25(OH)D]是VD的主要循环代谢产物,其代谢产物的运输是VD结合蛋白(vitamin D binding proteins,DBP)实现的,25(OH)D3浓度被认为是衡量VD状况的最佳指标[10],VD代谢途径见图2。

图1 VD3的结构及其编号系统
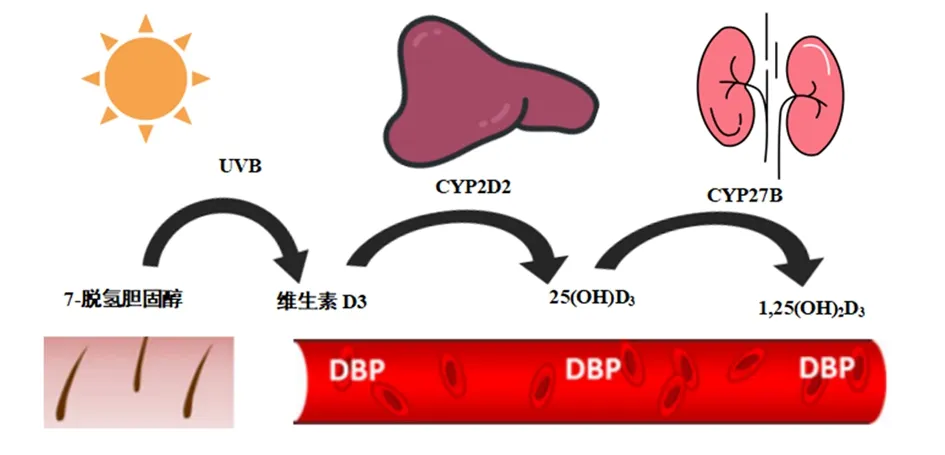
图2 VD代谢途径
2 VD在NMOSD中的作用
VD缺乏与自身免疫性疾病有关,而NMOSD是一种比较罕见的神经系统自身免疫性疾病。VD具有天然免疫系统和适应性免疫系统的调节功能,其缺乏对NMOSD的发病和病程进展起着重要作用。以往的研究表明VD对人类适应性免疫细胞具有一定的影响,并显示了VD激活酶和VD受体(vitamin D receptor,VDR)在T细胞、B细胞及免疫球蛋白(immunoglobulins,Ig)中的表达,结果显示,VD可抑制B细胞突然增殖和分化,从而减少Ig分泌[11-12],影响T细胞增殖和成熟,VD[1,25(OH)2D3]对免疫细胞的影响[13-14]见图3。
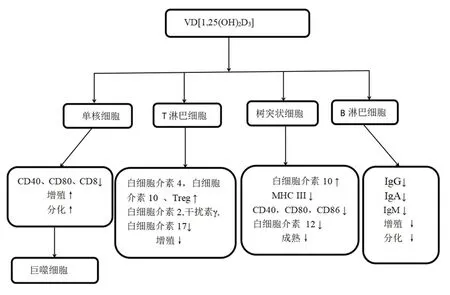
图3 VD[1,25(OH)2D3]对免疫细胞的影响
2.1VD调节T Cells的发育和分化 目前认为,VD缺乏会影响免疫系统,特别是T细胞介导的免疫,它能减少促炎细胞因子的产生、增强调节性T细胞的活性[15]。所有免疫系统细胞都表达VDR来传递VD信号。除了细胞因子环境外,VD是CD4+T细胞分化的重要因素[16]。体外研究表明,1,25(OH)2D3通过促进免疫调节性T辅助细胞2(Th2)和调节性T细胞(Treg)分化来调节CD4+T细胞的分化[17]。活化的T细胞表达CYP27B1,并有能力产生足够的1,25(OH)2D3,以此来影响VD反应基因。Palmer等[18]研究发现,1,25(OH)2D3影响Th17和Th9细胞的发育,包括白细胞介素22表达细胞,同时增加白细胞介素10活性细胞的频率。与Th17和Th9细胞相比,1,25(OH)2D3对Th1细胞的影响不大,反映出VDR水平显著降低。因此,白细胞介素10在Th9细胞培养中的诱导是1,25(OH)2D3影响Th9发育的一个重要机制,但不能解释对Th17细胞的抑制作用。这表明VD缺乏可能通过促进Th17和Th9细胞的正常生成而促进自身免疫,而牺牲调节性白细胞介素10生成的T细胞。有动物研究表明,VD通过调节Th17效应物反应而抑制自身免疫[19]。Fawaz等[20]研究发现,25(OH)D3和1,25(OH)2D3都降低了致病性Th17标记物的表达,降低其分泌炎性细胞因子(白细胞介素17A、干扰素γ)的能力。此外,在VD的影响下,活化的CD4+T细胞表现出更高频率的CD4+CD25hiCTLA-4+FOXP3+细胞,在体外对活化应答细胞进行检测时,显示出具有抑制作用。两种VD均能增加Th17极化CD4+T细胞VDRmRNA的表达,并均匀地转运到细胞核。此外,大量证据表明在VD的作用下,免疫系统可恢复到抗炎的最佳状态,同时保持足够的免疫反应性。Dankers等[21]研究发现,VD在增加Treg细胞的数量中起着重要作用,从而导致促炎性细胞因子的产生减少。Peelen等[22]研究发现,VD可以抑制树突状细胞(dendritic cell,DC)的完全成熟,使Th1/Th2平衡偏向Th2细胞,并增加Treg细胞的数量。这些所有的研究都有助于认识VD在T细胞的发育和分化中的重要作用。
2.2VD抑制B Cells增殖和分化 VD的有益作用与免疫系统的不同细胞有关,而B细胞在自身免疫性疾病的发病机制中起着重要作用。但目前更多的研究是针对T细胞,在一定程度上忽略了VD对B细胞的直接作用。免疫系统中激活的细胞表达于VDR,同T细胞一样,活跃的B细胞也表达VDR。虽然静息状态下的B细胞VDR mRNA水平较低,但仍可检测到[23],B细胞激活后上调VDR[24]。此外,由于细胞色素P450代谢酶CYP27B1和CYP24A1的调节表达,B细胞具有控制活性VD的潜力。因此,B细胞参与VD介导的免疫稳态,包括血浆细胞的生成。人类B细胞组成性地表达低水平VDR,而VDR在B细胞刺激时上调,因此,VDR在激活的B细胞中起着重要作用[25]。Marques等[26]发现,1,25(OH)2D3可调节免疫反应,VD可通过抑制B细胞分化来干扰浆细胞的抗体产生。Chen等[27]进一步证实1,25(OH)2D3可抑制激活的B细胞的持续增殖并诱导其凋亡,而初始细胞分裂却不受阻碍。1,25(OH)2D3可显著抑制血浆细胞和开关后记忆B细胞的生成,但与B细胞分化有关的遗传程序上调仅受到轻微影响。B细胞表达与VD活性有关的蛋白质的mRNAs,包括1α-羟化酶、24-羟化酶和VDR,它们都受1,25(OH)2D3活化的调控。1,25(OH)2D3上调p27的表达,但不上调p18和p21的表达,这可能在调节活化B细胞的增殖和随后的分化中起重要作用。
2.3VD降低免疫球蛋白(immunog lobulin,Ig)的数量 VD对Ig的影响主要是通过其影响B细胞的增殖和分化来实现的。研究表明,1,25(OH)2D3可调节B细胞的产生和Ig的分泌。Hartmann等[28]证实,通过添加1,25(OH)2D3,可以减少各种刺激物诱导的IgA、IgE、IgG和IgM的体外分泌。在VD存在下培养纯化B细胞的研究表明,血浆细胞的百分比和绝对数量以及IgA、IgG和IgM水平下降[29]。Schoindr等[30]研究发现,降钙素减少表达VDR的活化B细胞增殖,诱导其凋亡,抑制血浆细胞分化,从而抑制IgG和IgM的分泌,并抑制B存储器细胞的生成。Gupta等[31]在调查血清25(OH)D3与总IgE水平之间的关系时,发现儿童、青少年和成人血清25(OH)D3水平与总IgE水平呈负相关[32]。Chen等[27]研究发现,通过抗CD40/抗IgM/白细胞介素21的适应性途径诱导增殖活化的人B细胞,在1,25(OH)2D存在下培养数天后会发生凋亡。添加1,25(OH)2D不影响细胞的初始分裂,但由于诱导细胞凋亡,阻止了持续的增殖。此外,在存在1,25(OH)2D的情况下,观察到浆细胞(定义为CD19+/-CD38+CD27+淋巴细胞)的频率和数量减少。这涉及产生IgG和IgM的浆细胞,导致IgG和IgM的总量减少[27]。Shaygannejad等[33]评估了29例NMOSD患者的IgG-NMO水平,发现IgG-NMO阴性患者的日光暴露量表评分(P=0.01)和25(OH)D3(P=0.04)显著高于IgG-NMO阳性患者。所有受试者的日光暴露量表与血清25(OH)D3水平呈正相关(r=0.747,P<0.001)关系。因此,VD的生理变化可能对NMO患者的IgG-NMO合成产生显著影响。NMOSD是一种中枢神经系统炎症性疾病,IgG自身抗体可能对水通道蛋白4(aquaporin 4,AQP4)起致病作用。VD可调节B细胞功能,降低IgG合成,并在NMOSD和NMO的发病机制中起重要作用。
3 VD治疗NMOSD的现状
由于VD在维持机体的健康中起着的重要作用,以及作为一种重要的免疫调节剂而成为关注的焦点。VD和VD类似物在许多情况下都具有一定的治疗作用。
3.1VD治疗NMOSD的基础研究 VD具有髓鞘保护作用,而不依赖于T淋巴细胞的活化和浸润。饮食中VD的高含量与少突胶质细胞死亡和脱髓鞘过程中白质小胶质细胞活化/巨噬细胞浸润较弱有关。此外,通过研究还发现VD的代谢通过抑制DC的分化和对成熟刺激的脱敏作用而发挥免疫调节作用[33]。据报道,VD通过其免疫调节、抗炎和直接的神经保护活性,对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)疾病起积极作用。Jafarzadeh等[34]通过动物实验证实,磷酸盐缓冲盐水(phosphate buffered Saline,PBS)组EAE小鼠脊髓白细胞介素17、白细胞介素23p19、白细胞介素23p40、趋化因子20(chemokine ligand20,CCL20)、CCL22、趋化因子受体4(chemokine receptor4,CCR4)的表达及血清白细胞介素17、白细胞介素23水平均显著高于健康组。与PBS组EAE小鼠相比,VD治疗EAE小鼠中,上述细胞因子的表达显著降低。VD可下调EAE小鼠某些炎性细胞因子、趋化因子及趋化因子受体的表达。Xie等[35]通过1,25(OH)2D3诱导耐受性DC,并将耐受性DC转移到EAE小鼠中发现,耐受性DC抑制了Th1和Th17细胞向脊髓浸润,并提高了Treg(CD4+CD25+Foxp3+)、CD4+IL-10T细胞和Breg(CD19+CD5+CD1d+)的比例来改善EAE。尽管VD可诱导EAE小鼠脾脏、淋巴结和脊髓中Treg细胞的发育,但其对EAE的抑制作用是通过白细胞介素10介导途径实现的[36]。Mayne等[37]发现,在小鼠自身免疫模型中补充VD已被证明具有预防和治疗的益处。Joshi等[38]发现,VD的活性形式1,25(OH)2D3对人和小鼠T细胞中白细胞介素17A的表达有直接的抑制作用。用1,25(OH)2D3对EAE小鼠进行体内治疗可减少残疾和疾病进展,并减少外周和中枢神经系统分泌白细胞介素17A的CD4+T细胞。Urry等[39]研究发现,在人类疾病的动物模型中,注射1α-25VD3可成功治疗移植排斥反应和一系列自身免疫疾病,包括抗视网膜自身免疫[37]。
3.2VD治疗NMOSD的临床研究 VD在NMOSD的治疗中观察到了良好的疗效及安全性。Lucas等[40]通过招募中枢神经系统脱髓鞘患者进行研究,发现阳光照射不足和VD缺乏是中枢神经系统脱髓鞘性病变的独立危险因素,VD的水平与中枢神经系统脱髓鞘患者的残疾率之间呈负相关。Kusumadewi等[41]研究发现,阳光照射与VD水平呈正相关,紫外线辐射水平低是VD缺乏的主要原因。通过阳光照射增加NMOSD患者体内的VD含量,进而治疗NMOSD患者。另一项来自土耳其的研究[42]发现,与22例健康对照组相比,24例NMOSD患者和19例多发性硬化(multiple sclerosis,MS)患者的VD水平较低。AQP4抗体状态既不影响VD水平,也不与年龄、复发次数和Kurtzke扩展残疾状况评分量表(Expanded Disability Status Scale,EDSS)评分相关。与复发性疾病相比,单相脊髓炎症患者的VD水平显著降低,VD不足与复发风险增加等因素相关。目前还没有专门研究MOG抗体患者的VD水平的研究[43]。Palmer等[44]通过研究发现,使用缺乏白细胞介素10的细胞或阻断白细胞介素10信号的抗体可以消除1,25(OH)2D3对Th9细胞的抑制作用。人源化抗白细胞介素6受体单克隆抗体托珠单抗阻断白细胞介素6通路已被认为是治疗NMOSD的一种新方法[45],Luo等[46]研究发现,1,25(OH)2D3可以通过减少患者外周血单个核细胞中白细胞介素6的分泌从而达到阻断白细胞介素6通路,进而治疗NMOSD。因此,从VD治疗NMOSD的作用机制、基础研究及临床研究来看,VD是治疗NMOSD具有广泛前景的药物。
4 VD水平与NMOSD患者预后
基础、遗传及流行病学研究表明,VD在预防和治疗自身免疫性疾病方面具有潜在的作用。研究发现,检测25(OH)D可以更好地了解NMOSD患者的VD状况,因此它是识别VD缺乏症的标志。NMOSD患者VD水平更低,低水平25(OH)D/25(OH)D3可能是NMOSD患者疾病活动的危险因素[47],因此VD缺乏会导致患自身免疫性疾病的风险增加。Mora等[48]研究发现,VD水平与寿命存在相关关系,较高VD水平可阻碍机体免疫功能的衰老。还有学者[49]认为,自身免疫性疾病患者往往具有低水平的25(OH)D3,这种低水平的25(OH)D3与残疾或疾病活动有关。VD在NMOSD中发挥重要作用,是参与免疫途径的重要因素。Min等[49]通过临床研究发现,51例血清AQP4抗体阳性的NMOSD患者的VD水平明显低于204例健康对照组,且病程较长的NMOSD患者VD水平较高,并且发现VD水平越高,Kurtzke扩展残疾状态量表测量的神经功能残疾越少,说明血清VD水平反映了NMOSD患者的残疾状况,VD缺乏可能对NMOSD患者病程产生不利影响。因此,血清VD水平可反映NMOSD的进展状况,VD缺乏可能对NMOSD的发生发展产生不利影响[50]。Becklund等[51]研究显示,NMOSD患者的VD水平降低,在另一项研究[52]中发现VD水平与患者复发率、残疾进展和脑MRI新病变呈负相关。Shan等[53]通过研究证实,与116例健康对照组相比,58例NMOSD患者的VD水平更低,43例复发期间NMOSD患者的VD水平低于15例缓解期NMOSD患者。Simpson等[54]通过研究发现,VD水平与异基因干细胞移植后患者的预后相关,VD可能调节免疫反应,从而影响移植物抗宿主病的风险。此外,在移植环境中,VD对免疫系统的影响也可能影响患者的预后,在这方面,不同的研究评估了造血干细胞移植前VD水平与感染、移植物抗宿主病和移植后复发风险之间的关系[55]。因此,VD缺乏应该是NMOSD患者的高危致病因素,体内VD水平与NMOSD患者预后存在密切关系,对于VD水平较低的NMOSD患者,建议及时补充VD,可在一定程度上降低NMOSD的复发率和致残率。
5 总结与展望
综上所述,NMOSD是神经科的一种难治性疾病,VD通过参与T细胞的发育和分化、抑制B细胞增殖和分化以及降低Ig的数量等方面来影响NMOSD,在NMOSD发病机制中起着至关重要的作用。VD的水平及含量与NMOSD的进展及预后密切相关。基础研究及临床观察证实VD可通过多途径、多环节来调节免疫反应,对NMOSD患者具有一定的治疗作用。

