血浆生长分化因子-11 在慢性阻塞性肺疾病预后预测中的价值
李静杰,袁志,王群,陈淼,钟成,范伟杰,唐浩威,张国平,冯马龙
慢性阻塞性肺疾病(COPD)是一种常见、可预防和可治疗的慢性疾病,是致残和死亡的重要原因。近年来,COPD 发病率和死亡率呈上升趋势,目前证实包括遗传或环境因素在内的多种因素可能导致COPD 的发生,但吸烟仍然是COPD最危险的因素[1]。COPD 的主要病理生理表现为气道不可逆阻塞,肺功能进行性下降[2]。目前评估COPD 急性加重的发生频率、严重程度和持续时间尚无有效、标准化的监测工具,主要依据患者的主观症状和医生的判断,缺乏区分的客观指标。被视为“金标准”的一秒钟用力呼气量(FEV1)不能全面反映患者的临床状况[3]。有研究表明生长分化因子11(GDF-11)在COPD 患者肺成纤维细胞和气道上皮细胞中的含量明显降低,也可抑制香烟烟雾提取物(CSE)诱导的肺内细胞衰老和炎症反应,以及抑制弹性蛋白酶诱导的细胞衰老和肺泡间隙的扩大[4]。本研究旨在探究GDF-11 作为血浆生物标志物在COPD 预后预测中的价值,现报道如下。
1 资料与方法
1.1 一般资料 收集2019 年7 月至2020 年8 月宁波市奉化区人民医院呼吸内科住院的下呼吸道感染患者(观察组),对照组为健康体检者。观察组纳入标准:(1)符合全球COPD倡议文件诊断标准[5];(2)生命体征稳定;(3)最低心理状态检查评分≥27 分;(4)积极配合相关检查;(5)FEV1/用力肺活量(FVC)比值<0.7,FEV1 <80%;(6)患者及家属了解本研究并签署知情同意书。排除标准:(1)合并心脏病、肺、肾、肝疾病;(2)存在先天性疾病;(3)意识障碍、精神障碍、认知或理解能力异常;(4)长期卧床;(5)自身免疫性疾病。
1.2 方法 试剂及仪器:血气分析仪、肺活量测量仪、离心机、全自动酶标仪、移液器血清脑钠肽(BNP)ELISA 试剂盒、C 反应蛋白(CRP)ELISA 试剂盒、GDF-11、ELISA 试剂盒。治疗前后采集患者静脉血,-4 ℃保存备用。采用ELISA 检测血浆中GDF-11 和D-D,血清中CRP 和BNP 水平。实验开始前根据样品数确定检测所需板孔数,样品及标准品做3 个复孔。按照梯度将7 个浓度不同的标准品加入孔中,每孔0.1 ml,以样品稀释液作为零孔,其余每孔加入0.1 ml样品,37 ℃孵育90 min。去除液体,每孔加入0.1 ml生物素化抗体工作液,37℃孵育60 min。使用浓度为0.01 M PBS缓冲液清洗3 次。每孔加入0.1 ml ABC工作液,37 ℃孵育30 min。0.01 M PBS清洗5 次。加入TMB(90 l/孔)显色液,37℃避光孵育30 min。加入TMB(0.1 ml孔)终止液,测定OD 值。采用血气分析仪检查二氧化碳分压(PaCO2)和血氧分压(PaO2),采用肺活量测量仪检测肺功能。
1.3 随访 纳入本研究观察组的患者在出院后2 个月通过门诊复诊方式进行随访,调查不同严重程度患者的预后情况。
1.4 统计方法 采用SPSS 20.0 统计软件进行分析,计量资料以均数±标准差表示,采用t检验;多因素分析采用Logistic回归分析,绘制受试者工作特征曲线(ROC)曲线,计算曲线下面积(AUC);多组资料的趋势性采用Jonckheere-Terpstra检验。P <0.05 为差异有统计学意义。
2 结果
2.1 一般资料情况 最终共纳入80例,其中观察组40 例,男19 例,女21 例;年龄25~84 岁,平均(52.3±6.5)岁。对照组40 例,男20 例,女20 例;年龄26~85 岁,平均(49.7±7.5)岁。两组一般资料差异无统计学意义(P >0.05)。
2.2 两组临床指标比较 观察组CRP、BNP、D-D 及PaCO2均高于对照组(均05),而血浆GDF-11 水平低于对照组(P<0.05),两组PaO2差异无统计学意义(P >0.05)。见表1。

表1 两组临床指标比较
2.3 多因素 Logistic 回归分析GDF-11 为COPD 的保护因素,CRP、BNP、D-D 及PaCO2为COPD 的独立危险因素(均P <0.05),见表2。

表2 多因素Logistic 回归分析
2.4 ROC曲线分析 GDF-11联合CRP诊断COPD的AUC为0.84,95%CI为0.74~0.93;单纯采用GDF-11 诊断COPD 的最佳截断值为306.48 ng/ml,AUC 为0.71,95%CI为0.44~0.826。GDF-11 联合CRP 的AUC高于单纯采用GDF-11(P <0.05)。见图1。
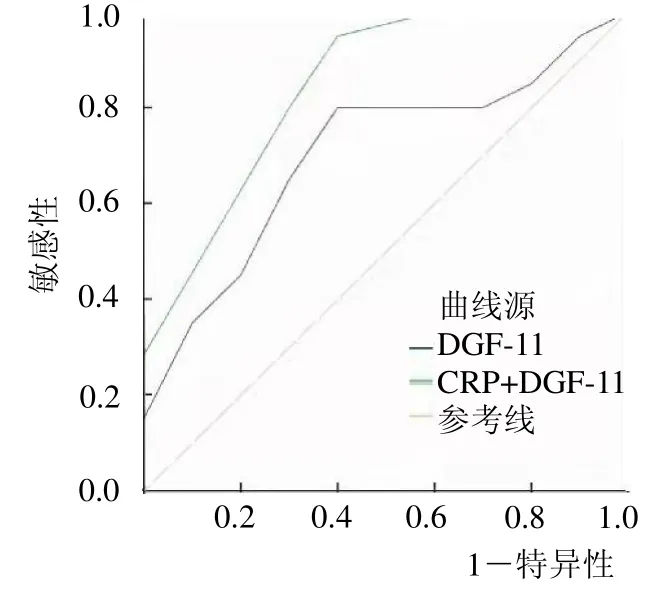
图1 ROC 曲线分析
2.5 GDF-11 和CRP对患者预后的价值在患者出院2 个月后通过门诊复诊方式对患者进行随访,检测患者血浆GDF-11水平及FEV1,本研究随访率为100%。根据血浆GDF-11 水平,利用四分位法将数据分成A 组(M0~M25)、B 组(M26~M74)及C 组(M75~M100)。以2 个月内再次因COPD住院和/或FEV1≤40%作为不良预后标准。3 组预后差异有统计学意义(t=6.48,P <0.05)。见表3。

表3 血浆GDF-11 水平对患者预后的评价
3 讨论
COPD 目前是全球第四大死亡原因,有研究证实肺细胞衰老可能与COPD 的发展和进展有关[6]。据统计,全世界有3.84亿人患有COPD,2017 年有320 万人死于COPD,到2040年,这一数字预计将达到每年440 万人[7]。2013 年我国COPD 死亡患者占据了全球总死亡人数的1/3,是严重危害人民身体健康的慢性呼吸系统疾病[8]。GDF-11在1997年首次被麦克弗伦等在实验中发现,经过研究证实GDF-11 在神经系统、肺、肾、脑、心脏和血液中均有表达,但在不同组织中的mRNA 和蛋白水平不同[9]。GDF-11 在哺乳动物的生长发育过程中发挥着多种作用。血浆中GDF-11表达水平随年龄增长而减少,GDF-11 抗衰老能力也随之减弱。Hikichi 等[10]的研究证实GDF-11 可作为分子标志物用于诊断和预测COPD 的发生和预后。
临床中FEV1 可以检测患者最大有氧能力,被视为诊断COPD的“金标准”,但疾病的发生发展受多种因素影响,而且需要考虑病情恶化的症状,以确定疾病的严重性和风险群体。目前尚无准确诊断COPD 有意义的或预测COPD 恶化的生化指标,COPD 严重程度分级依赖于临床FEV1 预计值和症状。有研究认为FEV1作为预测COPD预后情况的指标,其预测效果并不理想且存在较大的误差[11]。还有研究发现血浆GDF-11 水平高的COPD 患者恶化率及死亡率高,肺功能下降严重,尤其是FEV1 值[12]。因此,在COPD患者中寻找新型且有代表意义的血清标志物是非常重要的,对进一步预测患者疾病进展及预后有重要的参考价值。
本研究结果显示GDF-11 为COPD的保护因素,CRP、BNP、D-D 及PaCO2 为COPD 的独立危险因素。ROC 曲线分析结果发现GDF-11 联合CRP 诊断方案的AUC、灵敏度及特异度均高于单纯采用GDF-11 诊断。由此可见GDF-11 联合CRP诊断方案不仅可以提高COPD 的检出率,而且还可以提高检测的灵敏度和特异度。本研究在患者出院后2个月时进行随访,发现血浆GDF-11 水平可预测COPD预后,通过趋势性检测发现血浆GDF-11 水平越低COPD患者预后越差,不良预后的发生率越高,GDF-11 水平与不良预后的发生呈负相关。Tang 等[13]研究也证实,GDF-11 的表达下调时通过AKT信号通路调节导致COPD患者FEV 1 下降并预测COPD 的不良结局的发生情况,与本研究结果相似。
综上所诉,GDF-11 为COPD的保护因素,CRP、BNP、D-D 及PaCO2为COPD的独立危险因素。GDF-11 联合CRP 对COPD 的发展及预后有预测作用。

