干旱胁迫下黑果腺肋花楸的生长及生理响应
岑晓斐,贾国晶,曾继娟,朱 强,,靳 磊,惠学东,梁 斌
(1.宁夏大学,宁夏 银川 750021;2.宁夏国有林场和林木种苗工作总站,宁夏 银川 750001;3.种苗生物工程国家重点实验室,宁夏 银川 750001;4.宁夏泾源县林业草原发展中心,宁夏 泾源 756400)
黑果腺肋花楸Aronia melanocarpa,是蔷薇科涩石楠树属一种小浆果树种,又名黑果花楸、野樱莓、不老莓,其果实含有黄酮、多酚、花青素等多种对人体健康有益的成分,在欧美地区广泛应用于医药和功能食品工业,是集食用、药用、园林和生态等价值于一身的珍贵树种[1-3]。我国20世纪九十年代引入,目前已经被列为我国新兴十大小浆果之一[4]。其树形优雅美观,叶片春季绿色,秋季变为紫色、紫红色或深紫色,具有“秋天魔术师”的美誉;冬季果实不脱落,宿存于枝头和树梢,风景独特。在食用方面,果实可以制作成可口的食品;在医药保健方面,果实中含有丰富的微量元素和对人体有益的物质,在改善心脑血管循环、预防“三高”疾病、癌症等方面具有显著疗效[5-6];黑果腺肋花楸适应性强,无明显的病虫害,可以广泛种植于荒山、荒地等,在改造荒山、净化环境、防止水土流失方面具有重要的生态防护作用[7-8]。
干旱是全球农业面临最严重的问题之一[9]。近年来,随着全球气温的不断升高,干旱胁迫所带来的危害已位居所有逆境胁迫榜首[10]。据调查,干旱胁迫造成全球内的农业经济损失甚至远超过其它自然灾害所带来的经济损失之和,而我国又是一个旱灾发生频率较高且灾情严重的国家,干旱也成为植物生长过程中的主要制约因素之一,但是在一定的干旱胁迫范围内,植物可以经历一系列生理和形态结构的变化,从而表现出抗旱性的综合性状[11-12]。
研究表明,黑果腺肋花楸在山西、沈阳、黑龙江、吉林、泰州等地均能够自然越冬,生长良好,具有较高的观赏价值和经济、生态效益,适宜在引种地区推广种植。张雕等[13]发现胁迫程度越深对‘菊花桃’的生长影响越严重。马尾松幼苗可通过调整生长和生物量分配抵御干旱胁迫[14]。张高如等[15]研究发现在中度和重度胁迫后,各个生理指标均发生了显著性或极显著性的变化,说明在干旱胁迫下,植物通过调节生理指标来抵御干旱胁迫。陈昕等[16]采用盆栽控水法对石灰花楸的抗旱性进行研究,结果表明,干旱降低了幼苗生物量积累,随胁迫的加剧,幼苗变矮,地径变细,随着胁迫时间延长,石灰花楸幼苗的保护梅活性剂渗透调节物质的含量呈先上升后下降趋势,说明长时间的胁迫超出了其可调节的阈值,出现了下降趋势。陈菊艳等[17]研究发现华西花楸幼苗具有较强的适应能力,适合应用在不同的水分环境下。卞付萍、韩文忠、胡艳等[18-20]的研究结果表明黑果腺肋花楸具有较强的抗旱性及恢复能力,在灌溉或秸秆覆盖条件下,基本适宜在年降水量500~600 mm 的地区引种栽培,在年降水量达到600 mm 以上的地区引种栽培时,不需要进行灌溉。
目前,国内外学者关于黑果腺肋花楸的研究主要集中在繁育栽培、药食价值等方面,有关黑果腺肋花楸抗旱性的研究较少。因此,本试验以黑果腺肋花楸幼苗(‘黑宝石’和‘富康源Ⅰ号’)为研究材料,对其进行干旱胁迫处理,通过测定其形态和生理指标,探讨黑果腺肋花楸幼苗对干旱胁迫的响应,以期为黑果腺肋花楸在干旱、半干旱地区的应用、推广提供理论基础。
1 材料与方法
1.1 试验材料与设计
试验在宁夏银川市银川植物园大棚内进行。2020年4月13日将引种于辽宁的黑果腺肋花楸(‘黑宝石’和‘富康源Ⅰ号’)一年生幼苗开始定植移栽于塑料盆中(上口径28 cm,下口径28 cm,高35 cm),每盆栽培一株苗子,并装入沙土20 kg,盆土最大持水量为27.16%、pH 值8.48、全氮0.55 mg/kg、全磷为0.49 mg/kg、有机质为11.35 mg/kg、全钾为16.85 mg/kg,栽植好的苗木移入塑料大棚进行缓苗管理。在缓苗期间进行相同的水肥管理,依据“见干浇透”的原则对其进行浇水。于2020年7月22日,选取生长良好、长势相对一致的‘富康源Ⅰ号’和‘黑宝石’的盆栽苗进行干旱胁迫处理。采用盆栽控制试验法,以土壤相对含水量为田间持水量75%~80%为对照(CK),设置轻度干旱(T1)、中度干旱(T2)和重度干旱(T3)4 个处理,其依次为60%~65%、45%~50%、30%~35%。每个处理10 盆,3 次重复。试验期间,于每天15:00 采用称重法对试验对象进行称量并且补水至相应的土壤相对含水量。分别在干旱胁迫30 和60 d 随机选取3 株采集叶片,冲洗干净,用液氮冷冻,置于保鲜盒内,带回实验室,于-80℃低温冰箱保存用于测定相关生理指标。
1.2 项目测定与方法
1.2.1 生长指标的测定
采用钢卷尺和游标卡尺测定新梢长和新稍粗。最后,收获整株植株的地上和地下器官并放置于自封袋中,放入105℃烘箱下杀青10 min,再将温度调至80℃烘干至恒质量,测定地上和地下部分干物质量,计算根冠比。
1.2.2 生理生化指标的测定
分别采集每个处理的健康新鲜叶片,均匀混合剪碎后称取0.3 g,用于生理生化指标测定,重复3 次,取平均值。
土壤含水量的测定采用土壤烘干称重法[18];丙二醛含量采用硫代巴比妥酸法测定[18];可溶性蛋白含量采用G-250 考马斯亮蓝法测定[18];超氧化物歧化酶含量采用氮蓝四唑光化还原法测定[19];过氧化物酶含量采用愈创木酚法测定[19];过氧化氢酶含量采用紫外吸收法测定[19];游离脯氨酸采用酸性茚三酮法测定[18]。
1.3 数据处理
应用Excel 2010 软件对数据进行处理与绘图,利用SPSS 20.0 软件进行数据统计与分析。采用单因素方差分析和LSD 检验‘黑宝石’和‘富康源Ⅰ号’各处理间的差异显著性(P<0.05),采用独立样本T 检验分析相同处理‘黑宝石’和‘富康源Ⅰ号’种间的差异显著性(P<0.05)。
2 结果与分析
2.1 干旱胁迫对‘黑宝石’和‘富康源Ⅰ号’生长的影响
2.1.1 新梢长
随干旱时间的延长,‘黑宝石’和‘富康源Ⅰ号’的新梢长呈上升趋势;随干旱程度的加深,新梢长呈下降趋势(图1)。胁迫30 d,‘富康源Ⅰ号’的新梢长在T3 处理时较对照显著下降14.17%(P<0.05),‘黑宝石’的新梢长较对照下降不显著,‘富康源Ⅰ号’的变化幅度大于‘黑宝石’;胁迫60 d,‘富康源Ⅰ号’的新梢长较对照显著降低16.90%、21.83%、26.06%;‘黑宝石’较对照降低8.21%、13.43%和22.39%,‘富康源Ⅰ号’的变化幅度大于‘黑宝石’。‘黑宝石’各处理胁迫60 d 较30 d 增长0.7、0.4、0.2、0.07 cm;‘富康源Ⅰ号’胁迫60 d 较30 d 增长0.73、0.3、0.1和0.07 cm,2 种黑果腺肋花楸新梢长在胁迫周期内差异不显著。
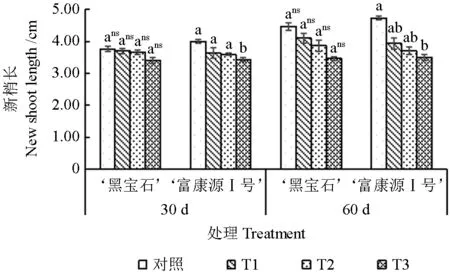
图1 黑果腺肋花楸不同时期新梢长的变化Fig.1 Variation of shoot length of aronia melanocarpa in different periods
2.1.2 新稍粗
随干旱时间的延长,‘黑宝石’和‘富康源Ⅰ号’的新梢粗呈逐渐上升趋势;随胁迫程度加深,两者新稍粗呈逐渐下降趋势(图2)。胁迫30 d 时,‘黑宝石’的新梢粗较对照下降不显著,‘富康源Ⅰ号’的新梢粗较对照下降明显,较对照下降5.40%、4.99%和6.75%,‘富康源Ⅰ号’的变化幅度大于‘黑宝石’;胁迫60 d 时,‘黑宝石’和‘富康源Ⅰ号’处理组的新梢粗均显著低于对照,其中‘黑宝石’各处理较对照降低3.87%、5.61%和6.68%;‘富康源Ⅰ号’较对照显著降低7.69%、8.97%和11.03%,‘富康源Ⅰ号’的变化幅度大于‘黑宝石’。‘黑宝石’各处理胁迫60 d较30 d增长0.060、0.043、0.037、0.013 mm;‘富康源Ⅰ号’胁迫60 d 较30 d 增长0.05、0.043、0.02 和0.01 mm,2 种黑果腺肋花楸新梢长在胁迫周期内差异不显著。
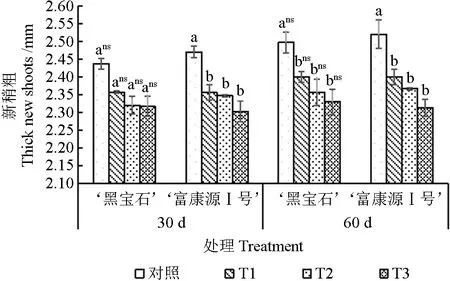
图2 黑果腺肋花楸不同时期新梢粗的变化Fig.2 Variation of new shoot diameter of Aronia melanocarpa in different periods
2.1.3 根冠比
随胁迫程度的加剧,‘富康源Ⅰ号’和‘黑宝石’的根冠比整体呈先上升后下降趋势(图3),但处理组均显著高于对照,在轻度干旱处理下均达到了最大值。其中‘黑宝石’较对照显著提高90.60%、48.58%和20.75%;‘富康源Ⅰ号’较对照显著增加83.87%、52.92%和32.32%。2 种黑果腺肋花楸在对照和轻度胁迫下差异不显著,在中度和重度胁迫下差异显著。
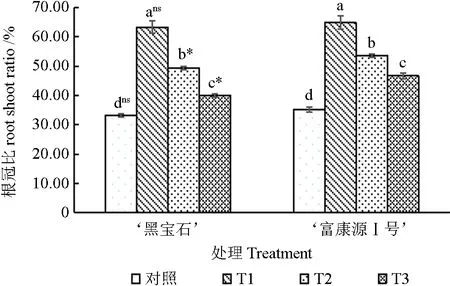
图3 黑果腺肋花楸根冠比的变化Fig.3 Change of root shoot ratio of Aronia melanocarpa
2.2 干旱胁迫对‘黑宝石’和‘富康源Ⅰ号’渗透调节物质的影响
2.2.1 可溶性蛋白含量的测定
随干旱程度的加剧,‘黑宝石’可溶性蛋白含量整体呈先上升后下降趋势,‘富康源Ⅰ号’在胁迫30 d 时呈逐渐上升趋势,胁迫60 d 时呈先上升后下降趋势(图4)。其中,胁迫30 d 时,‘黑宝石’可溶性蛋白含量在T1 处理下较对照显著增加24.50%,在T2 和T3 处理下较对照降低23.12%和37.75%,‘富康源Ⅰ号’可溶性蛋白含量均高于对照,较对照提高77.25%、141.57%和308.63%;胁迫60 d 时,‘黑宝石’可溶性蛋白含量在T1 处理下较对照显著增加41.58%,T2 和T3处理下,较对照显著降低48.71%、73.66%;‘富康源Ⅰ号’可溶性蛋白含量显著高于对照,较对照增加96.58%、126.16%、74.75%。2 种黑果腺肋花楸可溶性蛋白含量在30 d 时T1 和T3 处理下存在极显著差异,在T2 处理下,差异不显著;胁迫60 d 时,在T1 处理下差异不显著,在T2 和T3 处理下存在极显著差异。
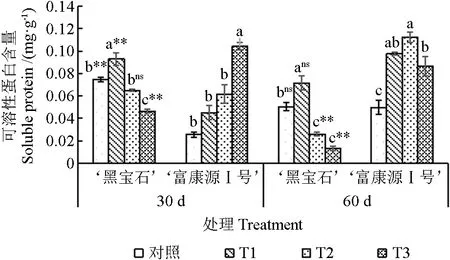
图4 黑果腺肋花楸不同时期可溶性蛋白含量的变化Fig.4 Changes of soluble protein content of Aronia melanocarpa at different stages
2.2.2 脯氨酸(Pro)含量的测定
随胁迫程度加剧,‘黑宝石’Pro 含量整体呈上升趋势,‘富康源Ⅰ号’呈先上升后下降趋势(图5)。胁迫30 d 时,‘黑宝石’处理Pro 含量显著高于对照,较对照提高33.52%、43.25%和83.64%;‘富康源Ⅰ号’Pro 含量虽呈先上升后下降趋势,但均高于对照,较对照增加20.57%、74.34%和49.56%,胁迫60 d 时,‘黑宝石’Pro含量较30 d 时变化幅度不大,各处理较对照显著增加91.39%、155.05%和199.37%;‘富康源Ⅰ号’Pro 含量则低于胁迫30 d 时的含量,但均高于对照,较对照提高121.50%、51.65%和1.20%。2 种黑果腺肋花楸胁迫30 d 在T1 和T2 处理下存在极显著差异,在T3 处理下无显著差异。干旱胁迫达到60 d 时,在T3 处理下存在极显著差异,在T1 处理下存在显著差异,在T2 处理下差异不显著。
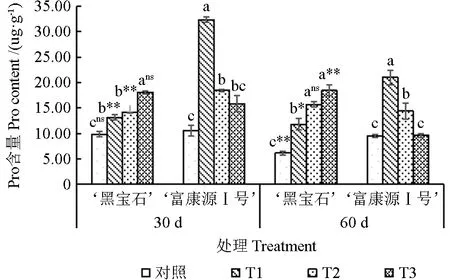
图5 黑果腺肋花楸不同时期脯氨酸含量的变化Fig.5 Changes of proline content in Aronia melanocarpa at different stages
2.3 干旱胁迫对‘黑宝石’和‘富康源Ⅰ号’丙二醛(MDA)的影响
随干旱时间的延长,MDA 含量出现下降趋势,胁迫30 d时达到最大值(图6);随胁迫程度的加深,‘黑宝石’MDA 含量胁迫30 d 呈先下降后上升趋势,‘富康源Ⅰ号’胁迫30 d 时各处理呈上升趋势。其中,胁迫30 d 时,‘黑宝石’和‘富康源Ⅰ号’的MDA 含量均在T3 处理时达到了最大值,‘黑宝石’在T3 处理下比对照显著增加72.66%,‘富康源Ⅰ号’较对照显著增加127.04%;胁迫60 d 时,‘黑宝石’各处理的MDA 含量显著低于对照,较对照下降91.08%、83.77%和71.78%,‘富康源Ⅰ号’较对照显著降低81.21%、76.08%和70.58%。2 种黑果腺肋花楸MDA 含量在胁迫30 d 时T3 处理下存在极显著差异,T1 和T2 处理下差异不显著;干旱胁迫到达60 d 时,2 种黑果腺肋花楸在对照和T3 处理时存在极显著差异,T2 处理下存在显著差异,T1 处理下无显著差异。
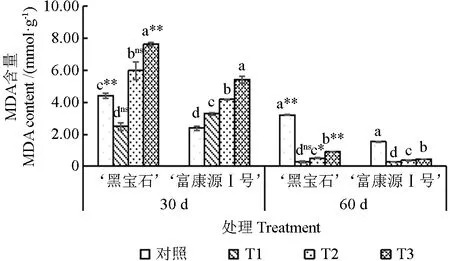
图6 黑果腺肋花楸不同时期丙二醛含量的变化Fig.6 Changes of malondialdehyde content in Sorbus mandshurica at different stages
2.4 干旱胁迫对‘黑宝石’和‘富康源Ⅰ号’保护酶的影响
2.4.1 超氧化物歧化酶(SOD)含量的测定
随干旱时间的延长,‘黑宝石’SOD 含量呈下降趋势,在T2 处理30 d 时达到最大值,‘富康源Ⅰ号’在T1 处理60 d 时达到最大值;随程度的加深,‘黑宝石’和‘富康源Ⅰ号’SOD 含量整体呈先上升后下降趋势(图7)。胁迫30 d 时,‘黑宝石’各处理的SOD 含量较对照显著增加30.39%、33.43%和24.59%,‘富康源Ⅰ号’较对照显著提高63.97%、101.10%和30.51%;胁迫60 d 时,‘黑宝石’SOD 含量在T1 和T2 处理下虽高于对照,但增长幅度不大,在T3 处理时较对照降低了29.84%,‘富康源Ⅰ号’SOD 含量虽在T3 时出现下降趋势,但高于对照,且较对照显著增加67.72%、38.88%和14.71%。2 种黑果腺肋花楸SOD 含量胁迫30 d 各处理差异不显著;干旱胁迫到达60 d时,在T1和T3处理下存在极显著差异,T2 处理下存在显著差异。
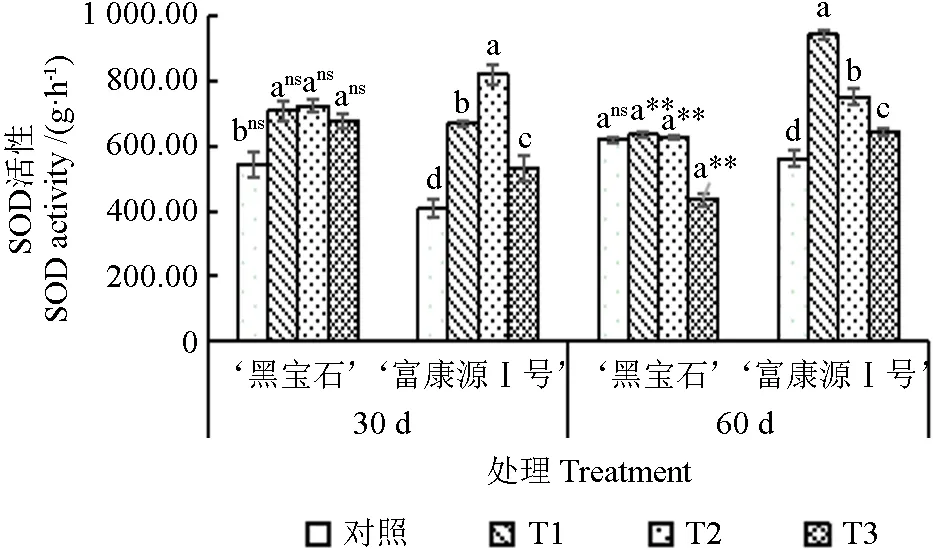
图7 黑果腺肋花楸不同时期超氧化物歧化酶活性的变化Fig.7 Changes of superoxide dismutase content in Aronia melanocarpa at different stages
2.4.2 过氧化物酶(POD)含量的测定
随胁迫时间的延长,‘黑宝石’POD 含量呈下降趋势,在T2 处理30 d 时达到最大值;‘富康源Ⅰ号’在T1 处理60 d 时达到最大值;随胁迫程度的加深,2 种黑果腺肋花楸的POD 含量呈先上升后下降趋势(图8)。胁迫30 d 时,‘黑宝石’各处理的POD 含量显著高于对照,较对照增加149.77%、177.45%和132.53%,‘富康源Ⅰ号’各处理较对照显著增加69.95%、99.37%和56.56%;胁迫60 d 时,‘黑宝石’POD 含量在T1和T2 处理下较对照显著提高85.38%、149.60%,在T3 处理下较对照降低58.16%,‘富康源Ⅰ号’在T1 处理下较对照显著提高116.03%,在T2 和T3 处理下较对照下降38.45%、56.56%。由图8还可以看出,胁迫30 d 时,各处理下2 种黑果腺肋花楸存在极显著差异;胁迫60 d 时,在T2 处理下存在极显著差异,其他处理差异不显著。
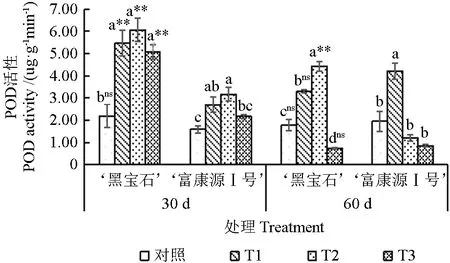
图8 黑果腺肋花楸不同时期过氧化物酶活性的变化Fig.8 Changes of peroxidase content in Aronia melanocarpa at different stages
2.4.3 过氧化氢酶(CAT)含量的测定
随胁迫时间的延长,‘黑宝石’CAT 含量在T2 处理60 d 时达到最大值,‘富康源Ⅰ号’在T1 胁迫30 d 时达到最大值;随程度的加深,2 种黑果腺肋花楸的CAT 含量呈先上升后下降趋势(图9)。胁迫30 d 时,‘黑宝石’各处理的CAT 含量显著高于对照,较对照增加22.80%、77.07%和25.68%,‘富康源Ⅰ号’较对照显著提高41.75%、38.56%和31.67%;胁迫60 d 时,‘黑宝石’CAT 含量在T1 和T2 处理下较对照显著增加89.56%、123.90%,在T3 处理下较对照显著降低34.34%,‘富康源Ⅰ号’在T1 处理下较对照显著提高21.45%,在T2 和T3 处理下较对照显著降低53.35%、87.80%。在研究周期内,‘富康源Ⅰ号’各处理CAT 含量高于‘黑宝石’,且存在极显著差异。
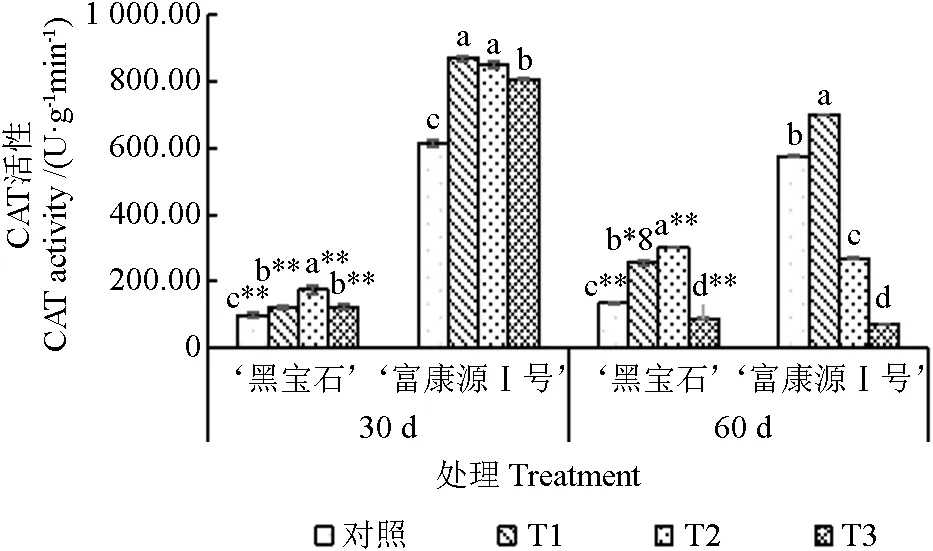
图9 黑果腺肋花楸不同时期过氧化氢酶含量的变化Fig.9 Changes of catalase content in Aronia melanocarpa at different stages
3 讨论与结论
3.1 讨 论
干旱是限制植物生长发育的重要逆境因素之一,生长和各器官之间生物量配比的变化是植物应对逆境胁迫的基本响应机制之一[21]。本研究中根冠比在轻度干旱时达到最大,中度和重度干旱时出现下降趋势,说明‘黑宝石’与‘富康源Ⅰ号’在一定程度上能通过增加根冠比调节地上和地下器官的生物量分配,以适应干旱环境。这与赵英等[21]的研究结果相似。新梢生长量可反映植物的抗逆性,新梢生长量越大则抗逆境能力越强。本研究发现,干旱胁迫抑制‘黑宝石’与‘富康源Ⅰ号’的生长,新梢长和新稍粗虽在生长,但生长较缓慢。随时间的延长,在轻度干旱时新梢生长量持续增长,中度与重度干旱生长较缓慢,甚至不生长。渗透调节是植物适应缺水条件的一个显著响应,其作用是主动积累溶质,维持膨压,进行渗透调节,防止水分散失。同时保持膜结构的完整性,使植物体的代谢过程正常进行[22]。本研究表明‘黑宝石’可溶性蛋白含量在轻度干旱时较对照显著增加,‘富康源Ⅰ号’处理组含量高于对照组,说明2 种黑果腺肋花楸在遭遇干旱胁迫时可通过积累蛋白质,增大膨压吸收水分。干旱胁迫下‘黑宝石’脯氨酸含量不断地积累,‘富康源Ⅰ号’脯氨酸含量在轻度干旱时增长较快,中度、重度干旱处理下出现了下降趋势,但均高于对照。这与闽楠幼苗、地果幼苗的变化趋势相似[23-24]。说明2 种黑果腺肋花楸幼苗可以通过脯氨酸的积累来抵御干旱造成的伤害。生物膜是植物体的重要屏障,也是细胞内与外界环境信息交流、物质交换的主要通道,对于植物体具有重大意义。植物在干旱条件下,体细胞的活性氧自由基就会大量积累,破坏体内细胞膜结构的完整性,从而加深细胞膜脂过氧化程度,进而导致MDA 的积累,而细胞膜系统稳定性与植物抗旱性密切相关[25-26]。本研究发现随干旱胁迫程度的加深,‘富康源Ⅰ号’和‘黑宝石’MDA 含量逐渐上升,说明胁迫导致2 种黑果腺肋花楸幼苗叶片中活性氧大量积累,膜脂过氧化作用增强,MDA 含量增加。这与权伍荣等[27]研究结果相似。虽然‘黑宝石’MDA 含量在T1 处理30 d 时出现了下降,可能是由于植株在受到外界环境的伤害时为防止自身水分散失而进行自我保护的一个措施。而随着干旱时间的延长,‘黑宝石’与‘富康源Ⅰ号’处理组的MDA 含量均低于对照,说明随时间的延长,‘富康源Ⅰ号’和‘黑宝石’幼苗的抗旱性变得越来越弱,胞膜透性也达到了最大。为避免干旱胁迫下植物体内产生过多活性氧自由基带来的细胞损伤,植物会启动酶类抗氧化系统来清除过量的自由基,减少其对细胞膜的伤害[28],在清除自由基的过程主要以SOD、POD、CAT 为主。本研究发现,干旱胁迫下保护酶SOD、POD、CAT 的活性整体呈先上升后下降趋势,这与张雕等[29]、王纪辉等[30]的研究变化趋势一致。说明2种黑果腺肋花楸清除自由基的能力是有限的,在处理初期,为清除干旱胁迫产生的大量活性氧自由基,保护酶活性增加,从而降低膜脂过氧化作用对植物造成的伤害;处理后期保护酶活性下降,是因为严重缺水导致植株幼苗细胞代谢失调,产生大量的自由基,膜脂过氧化作用增强,保护酶活性下降,说明在轻度干旱胁迫下黑果腺肋花楸幼苗可以通过保护酶系统来维持幼苗的正常代谢,但在中度和重度干旱胁迫下会影响幼苗正常生长。
对于干旱胁迫研究,主要表现为胁迫下生理变化趋势,对其生长及生理变化影响的研究较少。本研究中,随胁迫时间的延长,2 种黑果腺肋花楸的新梢生长量表现出前期生长较快后期缓慢甚至不生长,是由于前期,植物体内的MDA、可溶性蛋白、脯氨酸含量及保护酶活性增加,来抵御干旱对植物产生的影响;随时间增加,长时间的缺水导致细胞内自由基产生与清除的动态平衡被打破,细胞膜透性达到最大,MDA 含量下降,抑制渗透调节物质及保护酶合成,超过了自身可调节的范围,故导致黑果腺肋花楸幼苗新梢生长量因缺水而导致生长缓慢;随胁迫程度加深,2 个品种的新梢生长量在轻度胁迫下生长迅速,在中度与重度胁迫下生长较慢,究其原因为轻度干旱时,植物体内的各项指标呈上升趋势,可维持细胞的正常生理代谢,从而抵挡干旱对植物所造成的伤害;中度、重度胁迫下,可溶性蛋白与脯氨酸含量下降说明植株保水能力降低,保护酶活性出现下降趋势,表明自由基的大量积累已超出其可以调节的阈值。对比‘黑宝石’和‘富康源Ⅰ号’生长差异发现,尽管干旱处理下‘黑宝石’的新梢长和新稍粗较‘富康源Ⅰ号’增长较快,但二者间并无明显差异,说明在干旱胁迫处理对二者的生长均造成了一定的抑制作用,但‘黑宝石’较‘富康源Ⅰ号’抑制作用小。
3.2 结 论
干旱胁迫对黑果腺肋花楸幼苗的生长具有抑制作用,但其可通过积累渗透调节物质和抗氧化保护酶的调节作用,进而抵抗干旱逆境,保障植株正常生长。‘富康源Ⅰ号’的耐旱性强于‘黑宝石’,‘黑宝石’可耐中度干旱(45%~50%Φf),‘富康源Ⅰ号’可耐轻度干旱(60%~65%Φf)。‘黑宝石’可在年均降水量为340 mm的地区生长,‘富康源Ⅰ号’可在年均降水量为358 mm 地区生长,即2 种黑果腺肋花楸可在年均降水在358 mm左右的干旱地区生长。但本试验只针对干旱胁迫对黑果腺肋花楸幼苗的生长和生理特性进行了研究,对其光合作用、根系等方面未进行研究,还不够全面,为了更加深入全面地了解干旱胁迫对黑果腺肋花楸的影响,需进一步对光合等一系列的指标进行研究,为建立黑果腺肋花楸树种的抗旱体系、筛选优树提供理论依据和参考。

