CYP2D6*10基因多态性对利培酮治疗的精神分裂症患者药物浓度的影响
陆晋军,刘文清,吴仁容,陆健,严叶良,徐云庆
精神分裂症病因可能与生长环境、遗传等因素有关[1];第二代抗精神病药利培酮已广泛用于精神分裂症治疗[2]。
有研究[3]表明,利培酮及代谢物9-羟利培酮(9-OH利培酮)在健康志愿者中的药代动力学存在较大个体差异,临床上相同治疗剂量下部分精神分裂症患者易出现不同的不良反应(如催乳素升高、体质量增加等),可能与利培酮及9-OH利培酮血药浓度有关。细胞色素P450家族中的 2D6(CYP2D6)属细胞色素类药物代谢酶之一,是利培酮的主要代谢酶[4-5]。利培酮于体内经CYP2D6分解为活性代谢产物9-OH利培酮,二者虽均具药物活性,但前者在体内诱发的药物不良反应较为明显。临床研究[6]证实,维持剂量的利培酮治疗2周后,血药浓度处于稳态,此时9-OH利培酮/利培酮比值呈相对恒定状态,可较好反映体内利培酮代谢速率。为此,经本院医学伦理委员会(批号:2018-7号)批准,本研究探讨CYP2D6*10基因多态性对利培酮治疗血药浓度的影响。
1 对象和方法
1.1 对象 为2018年5月至2019年5月我院收治的精神分裂症患者。入组标准:①符合《中国精神障碍分类与诊断标准》第3版[7]精神分裂症诊断标准;②入组前4 周内未接受系统抗精神病药治疗;③接受利培酮单药治疗,无药物过敏史;④小学以上文化程度;⑤对本研究知情且签署同意书。排除标准:①严重心、肝、肾及内分泌等重要脏器系统疾病;②恶性肿瘤;③酒精或精神活性物质成瘾、滥用者;④患其他类型精神疾病;⑤孕妇及哺乳期妇女。共入组77例,男38例,女39例;年龄18~60岁,平均(40.9±9.7)岁;病程4~10年,平均(7.54±2.65)年;高血压12例,糖尿病4例,既往有吸烟史2例,既往有饮酒史2例。
1.2 方法
1.2.1 治疗方法 所有患者均接受利培酮单药治疗,起始剂量1 mg/d,根据病情逐渐增加剂量,2 周内剂量增至2~6 mg/d,分别于早上8∶00和晚上20∶00时服药;直至剂量3 mg/d后维持,8周为一疗程。
1.2.2 血药浓度检测方法 患者服用维持剂量的利培酮(3 mg/d)2周后,于晨服药前抽取外周静脉血5 ml于乙二胺四乙酸二钾(EDTA-2K)抗凝管中,室温静置12 min后以3 000 r/min离心5 min,分离血浆并于-20℃冰箱中保存;采用高效液相色谱串联质谱分析法,将血清100 μl、乙腈0.5 ml、内标溶液20 μl置入离心管内,经涡旋震荡15 s后以14 650 r/min的速度离心5 min。吸取上清液置于进样瓶内,采用血药浓度数据软件行进样分析,线性范围1~120 ng/ml;按照患者血药浓度的9-OH利培酮/利培酮比值进行分组,>10归为A组,5~10归为B组,<5归为C组。
1.2.3 CYP2D6*10基因多态性检测方法 同时留取的EDTA-2K抗凝血,48 h内按照血液基因组DNA提取试剂盒说明书进行白细胞DNA提取,后行PCR扩增体系及循环体系设计。PCR反应条件:50 ℃预变性10 min,继以95 ℃变性1 min,95 ℃退火15 s,65 ℃延伸1 min,持续循环40个,每个循环结束时进行荧光信号采集。FAM检测通道选择CYP2D6*10 C,标为红色,VIC检测通道选择CYP2D6*10 T,标为黑色。从3组中各抽取4例进行CYP2D6*10等位基因测序,基因多态性类型包括野生型(C/C)、杂合突变型(C/T)、纯合突变型(T/T)。
1.2.4 疗效及不良反应症状评估 分别于3组患者治疗前、治疗8周以简明精神病量表(BPRS)[8]及治疗中出现的症状量表(TESS)[9]评估。其中治愈:BPRS较治疗前减分≥80%,显效:BPRS较治疗前减分60%~79%,有效:BPRS较治疗前减分30%~60%,无效:BPRS较治疗前减分<30%,总有效=(治愈+显效+有效)/总例数×100%;TESS评分总分0~100分,得分越高不良反应越严重。

2 结果
2.1 各组一般资料比较 根据血药浓度9-OH利培酮/利培酮比值,A组、B组及C组分别有30例、20例及27例;各组年龄、性别、吸烟史、饮酒史、高血压病史、糖尿病史比较差异无统计学意义(P>0.05)。见表1。

表1 各组一般资料比较
2.2 各组CYP2D6*10基因多态性分布比较 各组CYP2D6*10基因型、等位基因频率均符合Hard-Weinberg平衡定律,样本具有群体代表性。A组C/C、C/T基因型及C等位基因频率显著高于C组(P均<0.05),T/T基因型频率显著低于B、C组(P均<0.05);B组C/T基因型及C等位基因频率显著高于C组(P均<0.05),T/T基因型频率显著低于C组(P<0.05)。见表2。

表2 各组CYP2D6*10基因多态性分布比较(例数,%)
2.3 CYP2D6*10基因多态性与利培酮血药浓度的关系 T/T基因型患者血利培酮浓度显著高于C/T、C/C基因型患者,而血9-OH利培酮浓度、9-OH利培酮/利培酮比值显著低于C/T、C/C基因型患者(P均<0.05);C/T及C/C基因型患者血利培酮浓度、9-OH利培酮浓度及9-OH利培酮/利培酮比值比较差异无统计学意义(P>0.05)。见表3。
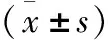
表3 CYP2D6*10基因多态性与利培酮血药浓度的关系
2.4 各组治疗后临床疗效及TESS评分对比 C组总有效率显著低于A、B组,而TESS评分显著高于A、B组(P均<0.05);A、B组总有效率及TESS评分对比差异无统计学意义(P>0.05)。见表4。

表4 各组治疗后临床疗效及TESS评分对比较
3 讨论
利培酮为第二代抗精神病药,已被证实可通过结合并抑制高亲密性5-羟色胺及多巴胺受体发挥药理效应,在精神分裂症的治疗中发挥着重要作用[10]。研究[11]认为,约85%的利培酮在体内代谢为9-OH利培酮,9-OH利培酮的药理作用与利培酮相似。故利培酮及9-OH利培酮血药浓度总和即为对利培酮的治疗反应。细胞色素P450家族中关键成员CYP2D6是利培酮代谢反应中最为主要的限速酶,可划分为弱代谢、中度代谢、强代谢、超强代谢4种表型,影响个体利培酮转化为9-OH利培酮的速率,体现为个体利培酮及9-OH利培酮药动学参数差异[12];由于单纯利培酮及9-OH利培酮血药浓度均伴不同程度的波动,故利培酮、9-OH利培酮单一或联合的血药浓度均不适合作为判断利培酮代谢的指标[13]。当服用利培酮达稳态后个体9-OH利培酮/利培酮比值呈相对恒定状态,以此比值作为判断利培酮体内代谢速率的有效指标;通常9-OH利培酮/利培酮比值越大,利培酮的代谢速率越快[14-15]。
本研究患者连续服用利培酮达稳态后以高效液相色谱串联质谱分析法行利培酮及9-OH利培酮血药浓度检测,按照9-OH利培酮/利培酮比值将患者分组;采用实时荧光PCR技术检测入组者CYP2D6*10基因多态性;结果显示,各组患者的年龄、性别、吸烟史、饮酒史、高血压病史、糖尿病史比较差异无统计学意义,可排除上述因素对药物代谢可能造成的影响。各组CYP2D6*10基因多态性分布显示,A组C/C、C/T基因型及C等位基因频率显著高于C组(P均<0.05),T/T基因型频率显著低于B、C组(P均<0.05);B组C/T基因型及C等位基因频率显著高于C组(P均<0.05),T/T基因型频率显著低于C组(P<0.05);表明CYP2D6*10基因多态性影响9-OH利培酮/利培酮比值。与Molden等[16]及杨燕等[17]对亚洲精神分裂症患者的研究结果一致。
本研究中,CYP2D6*10 T/T基因型患者利培酮血药浓度明显高于C/T、C/C基因型患者,9-OH利培酮血药浓度及9-OH利培酮/利培酮比值显著低于C/T、C/C基因型患者,表明CYP2D6*10 T/T基因型对利培酮代谢存在明显影响;而CYP2D6*10 C/T及C/C基因型患者的利培酮、9-OH利培酮血药浓度及9-OH利培酮/利培酮比值比较差异无统计学意义,提示CYP2D6*10括野生型、杂合突变型个体对利培酮代谢的影响相对较小;张婷等[18]研究证实CYP2D6*10 T/T基因型个体显著影响利培酮的代谢;提示CYP2D6*10 T/T基因型个体CYP2D6酶活较低,而CYP2D6*10 C/T及C/C基因型个体CYP2D6酶活更高。
最后在各组治疗8周后的疗效及不良反应症状观察中,C组总有效率显著低于A、B组,而TESS评分显著高于A、B组(P均<0.05),但A、B组总有效率及TESS评分对比差异无统计学意义,表明CYP2D6*10 T/T基因型与利培酮治疗精神分裂症的临床疗效、不良反应相关。分析原因可能是CYP2D6*10 T/T基因型为利培酮代谢产生影响,导致药物代谢丧失、性质改变或药物代谢率下降,从而影响疗效及不良反应症状。既往研究中王皓等[19]指出CYP2D6基因多态性可为利培酮治疗精神分裂症的临床疗效产生影响,与本次研究结果存在一定相似之处。
综上,CYP2D6*10基因多态性与利培酮代谢、临床疗效、不良反应密切相关;T/T基因型个体CYP2D6酶活较低,影响利培酮代谢及血药浓度;临床利培酮的治疗中,对出现的治疗反应的不同应考虑到个体利培酮代谢的差异。本研究样本量偏少,且未探讨9-OH利培酮/利培酮比值对CYP2D6代谢类型的预测效能,故今后有待深入探讨。

