鸭疫里默氏杆菌弱毒株的发酵培养
李林林,孙敏华,董嘉文,吴彩艳,廖申权,孙铭飞,吕敏娜,邝瑞欢,张建峰,徐志宏
(1.广东省农业科学院动物卫生研究所 广东省畜禽疫病防治研究重点实验室 农业农村部兽药与诊断学科群广东科学观测实验站,广州 510640; 2. 岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000)
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌(Riemerella anatipestifer,RA)引起的一种高致病性、接触性传染病,又称鸭传染性浆膜炎(infectious serocitis,IS)。鸭疫里默氏杆菌可感染鸭、鹅、火鸡等多种禽类,主要感染1~8周龄,尤其是2~3周龄的雏鸭,引起多发性、渗出性炎症和全身性败血症[1]。临床上主要表现为眼和鼻分泌物增多、喘气、咳嗽、下痢、共济失调和头颈震颤,慢性经过的病鸭主要表现为脑膜炎症状、颈斜、生长缓慢或成僵鸭。病变以纤维素性心包炎、肝周炎和气囊炎为特征[2]。鸭疫里默氏杆菌病发病率可达90%以上,死亡率高达75%。该病在世界范围内广泛流行,是目前危害养鸭业最为严重的细菌性传染病之一,给养鸭业造成巨大经济损失[3]。
鸭疫里默氏杆菌菌体细胞壁表面的多糖抗原呈多样性的特征使得鸭疫里默氏杆菌的血清型呈多态化[4],目前国际上已确定的鸭疫里默氏杆菌血清型至少有21个(1-21型),国内相继报道了18个血清型。当前我国流行的鸭疫里默氏杆菌以血清1型[5]和血清2型[6]为主,这两种血清型菌株在全国范围内广泛分布,同时多血清型流行已成为基本态势[7]。目前,华南地区流行的菌株主要为血清1型[8]。鸭疫里默氏杆菌病的防控方法主要为疫苗接种和药物防治[9],广泛应用疫苗是预防该病的有效措施。国内已有多家灭活疫苗应用于养殖生产,但未见关于鸭传染性浆膜炎弱毒活疫苗研究的报道,也未见该类疫苗产品问世。因此,研制一种安全有效的预防鸭疫里默氏杆菌病的弱毒疫苗对我国养鸭业的发展具有重要意义。1型鸭疫里默氏杆菌天然弱毒株SG株(GenBank登录号:NZ_KB206047)由本单位分离鉴定并进行弱毒疫苗研制。在疫苗制备中,抗原浓度是影响疫苗质量和免疫保护效果的关键因素,因此,优化鸭疫里默氏杆菌的培养条件提高有效抗原产量对制备疫苗非常必要。高密度发酵培养可有效提高抗原产量和培养基的利用率,缩短生产周期,减少生产成本,进行低成本的规模化生产[10]。本研究将通过优化鸭疫里默杆菌弱毒株发酵培养条件,提高抗原产量,为鸭疫里默杆菌弱毒疫苗生产提供了一种有效可行的抗原制备工艺。
1 材料与方法
1.1 菌株与试剂1型鸭疫里默氏杆菌天然弱毒株SG株,由广东省农业科学院动物卫生研究所分离、鉴定并保存。胰蛋白胨和酵母提取物购自OXOID公司;大豆蛋白胨、琼脂粉购自广东环凯微生物科技有限公司;葡萄糖、氯化钠和磷酸氢二钾购自生工生物工程(上海)股份有限公司;新生牛血清购自广州蕊特生物科技有限公司。
1.2 培养基的配制TSB培养基:胰蛋白胨17.0 g、大豆蛋白胨10.0 g、酵母提取物5.0 g、葡萄糖2.5 g、磷酸氢二钾2.5 g、氯化钠5.0 g,将上述物质溶于ddH2O中定容至1 L,调整pH值至7.5,混匀后分装,121℃高压灭菌30 min。
TSA培养基:在TSB培养基基础上添加琼脂粉20.0 g,将上述物质溶于ddH2O中定容至1 L,调整pH值至7.5,混匀后分装,121℃高压灭菌30 min,待其自然冷却至40℃~50℃,加入5%新生牛血清,混匀后制成平板。
1.3 菌种的复苏取冻干保存的1型鸭疫里默氏杆菌SG株F6代菌种,用含5%新生牛血清的TSB培养基溶解后,划线接种于TSA培养基,置37℃培养36~48 h,观察菌落形态,挑选符合标准的典型菌落。
1.4 种子液的制备挑选1型鸭疫里默氏杆菌SG株F6代典型单菌落接种于5%新生牛血清的TSB培养基中,置37℃振荡培养16~20 h。取样,按体积比1%接种于5%新生牛血清的TSB培养基中,调整转速为160 rpm,置37℃振荡培养12~14 h作为种子液。
1.6 培养基优化正交试验运用正交试验设计[6],选取TSB培养基中主要营养成分胰蛋白胨添加量、大豆蛋白胨添加量、酵母提取物添加量、葡萄糖添加量4因素,每个因素3个水平制定正交试验,见表1。
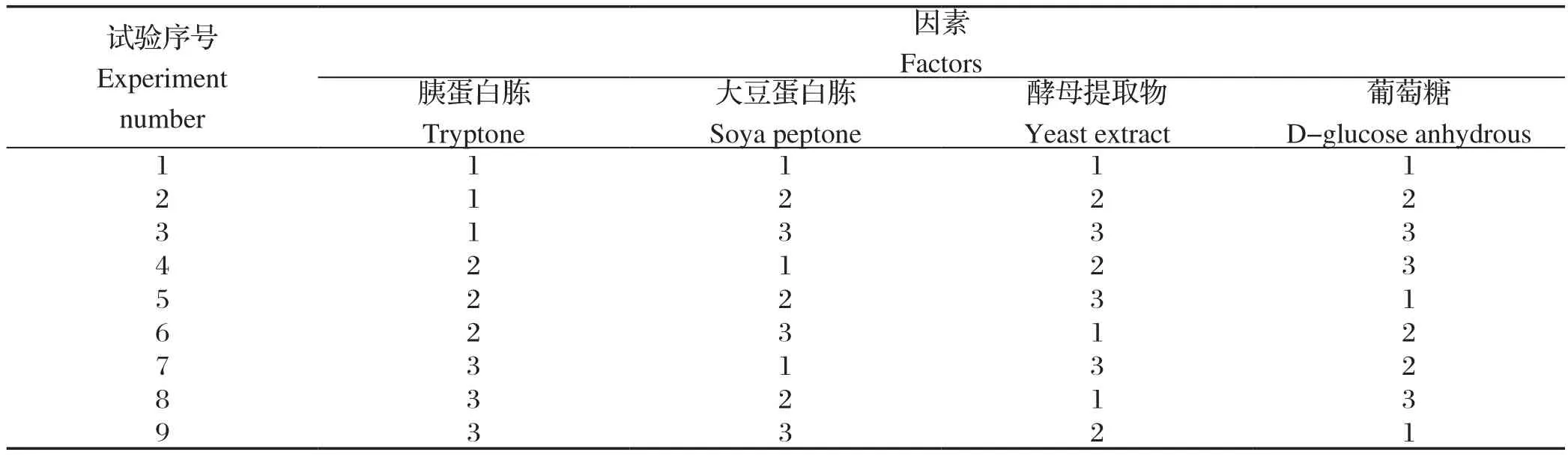
表1 四因素三水平正交试验表Table 1 Table of four factors and three levels orthogonal test
采用具有在线控制pH和溶解氧(DO)的5 L发酵罐进行发酵培养。每次试验加入培养基(pH7.4~7.6)及消泡剂,121℃灭菌30 min,自然降温。使用前预热到37℃,加入5%新生牛血清、1%种子液。培养温度为37℃,初始通气量为3 L/min,转速为150 rpm,在发酵过程中通过调节通气量使溶氧维持在20%。培养10 h,自4 h开始每隔1 h取样,参考《中华人民共和国兽药典》方法用TSA培养基进行活菌计数。
1.6 发酵培养条件的单因素优化试验
1.6.1 发酵培养DO(溶解氧)值的优化 按5 L发酵罐加入适量TSB培养基(pH7.4~7.6)及消泡剂,121℃灭菌30 min,自然降温。使用前预热到37℃,加入5%新生牛血清、1%种子液。培养温度为37℃,初始通气量为3 L/min,转速为150 rpm,在发酵过程中通过调节通气量使溶氧分别维持在10%、20%、40%。培养10 h,自4 h开始每隔1 h取样进行活菌计数。
1.6.2 发酵培养转速的优化 发酵前准备同1.6.1。在发酵过程中通过调节通气量使DO值维持在最佳值,分别以转速100、150、200 rpm进行发酵培养。培养10 h,自4 h开始每隔1 h取样进行活菌计数。
1.7 发酵液的活菌计数将收获的菌液参考《中华人民共和国兽药典》方法用TSA培养基进行活菌计数。
1.8 优化配方和优化工艺在 GMP 生产车间的发酵生产根据培养基配方优化和发酵工艺优化结果,在GMP 生产车间规模化发酵生产3 批鸭疫里默杆菌弱毒抗原,采用 50 L 发酵罐,发酵液体积为 10 L。分别采集发酵后4 h开始每隔1 h取样,进行活菌计数。
2 结果与讨论
2.1 鸭疫里默杆菌弱毒株在发酵不同时间各组活菌数的测定发酵不同时间各组活菌数测定结果见表2,正交实验组别序号5的培养基发酵培养的菌液活菌数最高,发酵8 h可达1.22×1010CFU/mL。此组培养基配方是:每升培养基含胰蛋白胨17.5 g、大豆蛋白胨7.5 g、酵母提取物7.5 g、葡萄糖2.5 g、磷酸氢二钾2.5 g、氯化钠5.0 g。本实验室分离到RA天然弱毒SG株,在培养过程中发现其生长较强毒株缓慢,通过以上培养基优化,利用优化后的培养基发酵培养可获得较好的生长速率。
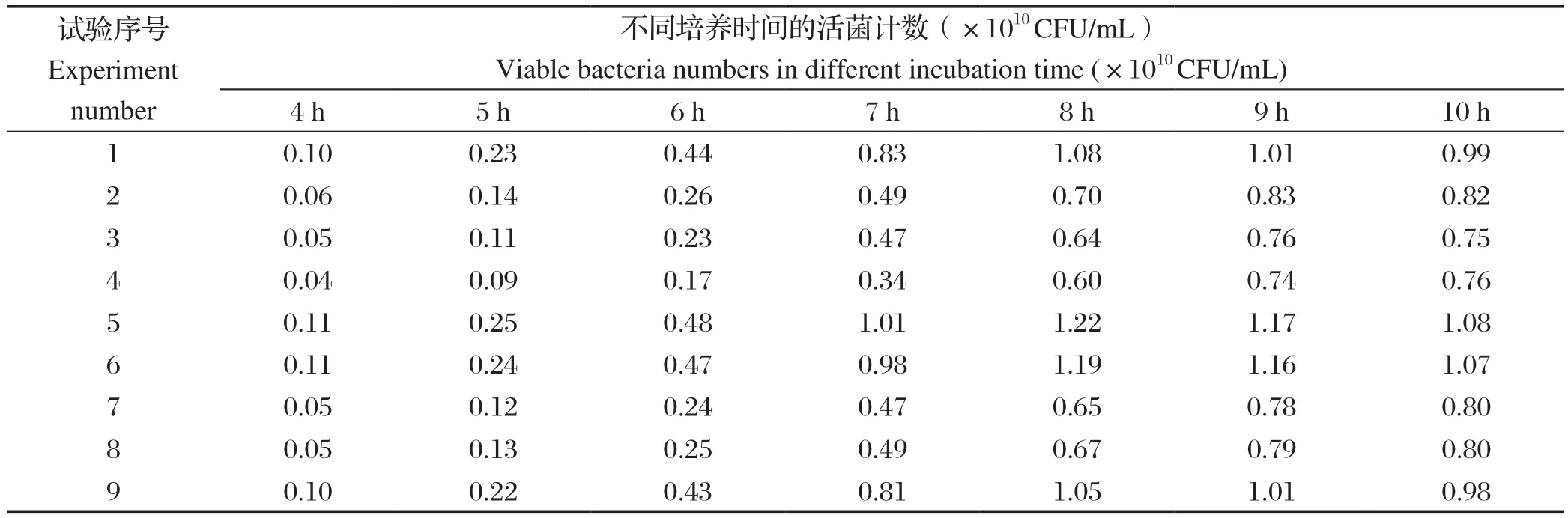
表2 发酵不同时间各组活菌数的测定结果Table 2 Results of viable bacteria in different groups at different fermentation time
2.2 发酵培养DO值的优化结果当DO值分别维持在10%、20%、40%时,SG株发酵8 h活菌数分别为1.08×1010CFU/mL、1.29×1010CFU/mL、0.97×1010CFU/mL(表3)。因此,1型鸭疫里默氏杆菌SG株发酵的最适DO值为20%。
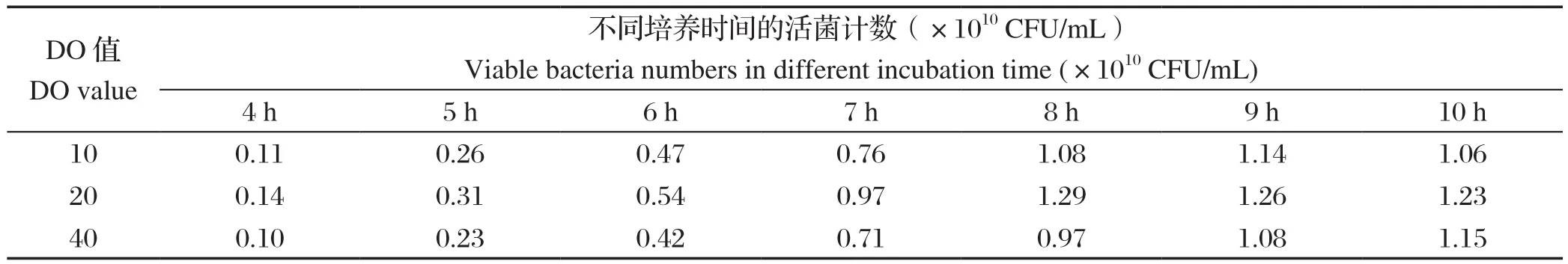
表3 1型鸭疫里默氏杆菌SG株在不同DO值发酵培养的活菌计数结果Table 3 Results of viable bacteria of Riemerella anatipestis SG strain fermented at different DO values
2.3 发酵培养转速优化结果当转速分别为100、150、200 rpm时,SG株发酵8 h活菌数分别为9.8×109CFU/mL、1.19×1010CFU/mL、1.01×1010CFU/mL(表4);因此,选择150 rpm为1型鸭疫里默氏杆菌SG株最适发酵培养转速。
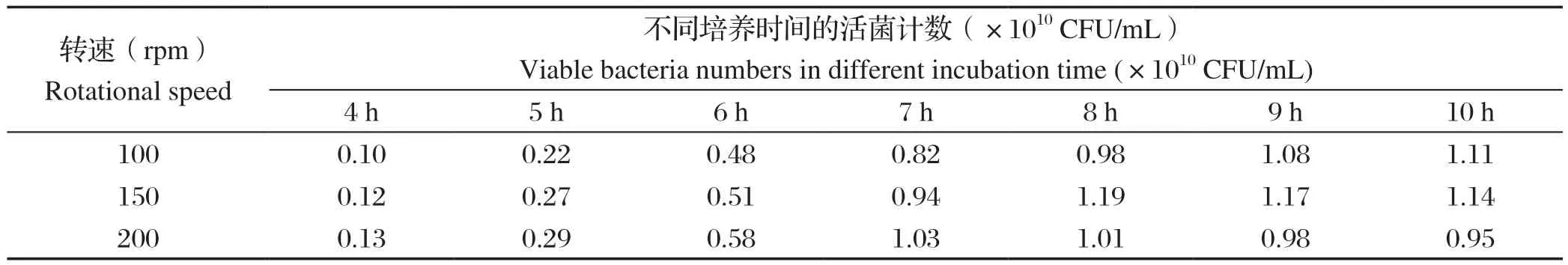
表4 1型鸭疫里默氏杆菌SG株不同转速发酵培养的活菌计数结果Table 4 Results of viable bacteria of Riemerella anatipestis SG strain fermented at different rotational speeds
2.4 GMP生产车间的发酵生产结果根据培养基配方优化和发酵工艺优化结果,在GMP生产车间规模化发酵生产3批鸭疫里默杆菌抗原,采用50 L发酵罐,发酵液体积为10 L。结果显示,3批1型鸭疫里默氏杆菌SG株培养物均在发酵8 h活菌数达到高峰,活菌数分别为1.26×1010CFU/mL、1.18×1010CFU/mL、1.21×1010CFU/mL(表5)。该方法较SG株摇床培养到达菌数高峰时间(16 h)要提前8 h左右,且活菌数高。王艳等[12]对鸭疫里默氏杆菌JX-2株进行发酵培养较摇床培养,提前6 h左右达到菌数高峰,杨灵芝等[13]利用液体发酵装置对鸭疫里氏杆菌GN52株进行培养,较实验室培养提前4 h左右达菌数高峰,且含菌量提高。因此,本研究获得的鸭疫里默氏杆菌发酵培养条件具有较好的优越性,可大规模推广应用。
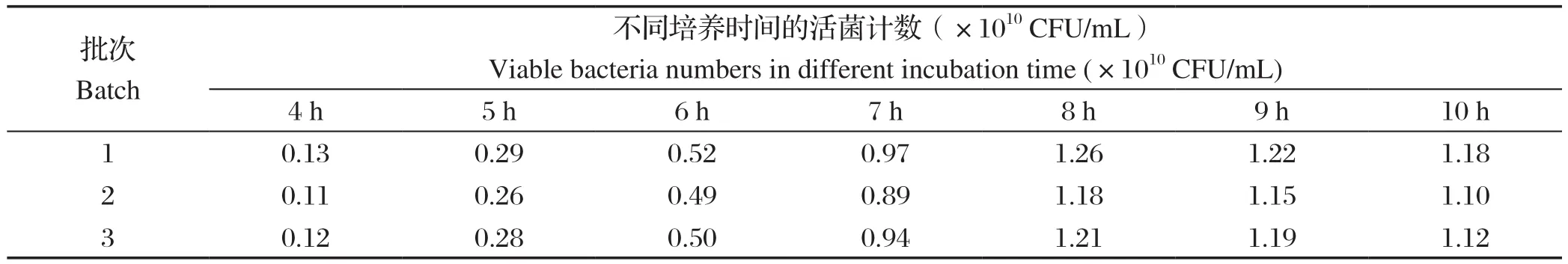
表5 1型鸭疫里默氏杆菌SG株不同时间发酵培养的活菌计数结果Table 5 Results of viable bacteria of Riemerella anatipestis SG strain fermented at different time
鸭疫里默氏杆菌病在世界范围内广泛流行,是对养鸭业危害最严重的细菌性疾病之一。当前,鸭疫里默氏杆菌的耐药性严重,流行的血清型也不断变化,而已有的灭活疫苗在生产工艺和免疫预防效果方面均存在较大提升空间,而弱毒疫苗的研发还未见报道。本研究在华南地区田间分离得到的1型鸭疫里默氏杆菌自然弱毒株SG株基础上,通过高密度发酵技术优化发酵培养基,优化发酵培养工艺参数,缩短了鸭疫里默氏杆菌弱毒株的生产周期,提高了生产效率,为鸭疫里默氏杆菌弱毒疫苗的研制提供了高效的抗原制备工艺。

