副猪嗜血杆菌在感染猪体内的分布及其在血液、鼻拭子中载量的变化
庞琳琳 ,赵秋华 ,王 欣 ,张俊杰 ,郭 爽 ,李蓓蓓 ,刘 珂 ,邵东华 ,邱亚峰 ,马志永 ,袁万哲,魏建超
(1.河北农业大学动物医学院,保定 071001;2.中国农业科学院上海兽医研究所,上海 200241;3.上海市闵行区动物疫病预防控制中心,上海 201109)
德国科学家Glaserser发现一种与纤维素关节炎和浆膜炎相关的革兰氏阴性菌,1922年由Schermer和Ehrlich首次分离得到,1943年Hjärre和Wramby将此种微生物命名为副猪嗜血杆菌[1-2]。副猪嗜血杆菌(Haemophilus parasuis,HPS)是一种无鞭毛缺乏运动性,可形成荚膜和菌毛样结构,非溶血性,且生长十分娇嫩依赖生长因子烟酰胺腺嘌呤二核苷酸(NAD)的革兰氏阴性菌[1-2];从猪体内分离的HPS通常是带荚膜的,体外培养几代后荚膜消失,在TSA上培养形成白色半透明的圆形菌落,与金黄色葡萄球菌一起培养产生“卫星”现象[3-4]。作为一种存在于猪上呼吸道的条件性致病菌,可引起严重的全身性疾病,即以纤维性多浆膜炎,关节炎和脑膜炎或急性肺炎和急性败血症为特征的Glsser病[4-6]。根据Kielstein and Rapp-Gabrielson(KRG)试验,把已分离出来的HPS进行血清型分型,共分为15种血清型,且发现其毒力明显不同[7],其中血清型1、5、10、12、13、14和15型毒力较强[8],有时死亡率高达50%;而我国主要的流行株为4型和5型,其次为12型和13型[9-10]。
HPS是猪呼吸道疾病的常见病原体之一,常与其他病原体如猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猴免疫缺陷病毒(Simian immunodeficiency,SIV)、多杀巴斯德菌(Pasteurella multocida)、胸膜肺炎放线杆菌(Antinobacillus pleuropneumoniae)和猪肺炎支原体(Mycoplasma hyop neumoniae)等混合感染引发更为严重的全身性炎症[11-14],给养猪业带来巨大的经济损失。与上述病原体发生共感染时,可以从患有肺炎猪的肺组织中分离到HPS[15]。目前该病菌在体内各组织中的分布规律及在血液和不同组织中的载量的变化尚未见报道。鉴于该菌株的日益流行,使得对该病菌在体内各组织中的感染状况及其排毒规律等研究成为一种必要。本研究观测了HPS感染仔猪临床症状(体温、体重、精神、食欲等),应用SYBR Green Ⅱ荧光定量PCR的方法检测了菌体在鼻黏膜和血液中动态变化过程,分析了HPS在仔猪各组织中的分布情况,为该病的发病机理及临床诊断提供理论依据,更为今后该病的防控奠定基础。
1 材料与方法
1.1 试验动物与菌株20头28日龄健康断奶仔猪购自上海市崇明县某猪场。购进前采集40头仔猪血液和鼻拭子,对猪瘟病毒(Classical swine feler virus,CFSV)、伪狂犬病病毒(Pseudorabies vivus,PRV)、猪圆环病毒(Porcine circovirus,PCV2)、PRRSV和HPS进行了PCR检测和ELISA检测,选择CFSV、PRV、PCV2、PRRSV抗原阴性、HPS抗原和抗体均为阴性的猪为实验对照。血清13型HPS(W2)由中国农业科学院上海兽医研究所猪呼吸道传染病研究团队分离、鉴定并保存。攻毒菌株的复壮:将血清13型HPS W2株接种到TSB(5%新生牛血清,10 ng/mL NAD)液体培养接种;37℃、220 rpm摇床培养;OD值达到0.4~0.6时,2794×g离心5 min收获菌体沉淀;加入适量的PBS重悬菌株,2794×g离心5 min,洗涤3次后,加入一定量的PBS,使菌液浓度约为1×106CFU/mL。
1.2 主要试剂胰胨大豆琼脂培养基(TSA培养基)和胰胨大豆肉汤培养基(TSB培养基)均购自英国的OXOID公司;新生牛血清购自浙江天杭生物科技股份有限公司;烟酰胺腺嘌呤二核苷酸(NAD)、2×TaqPCR Master Mix购自天根生化科技(上海)有限公司;SYBR Green ExTaqⅡ及DNA胶回收试剂盒均购自宝生物(大连)有限公司;细菌基因组提取试剂盒、DL2000 DAN marker及质粒抽提试剂盒均购自天根生化科技(上海)有限公司。
1.3 引物的设计参照GenBank中HPS全基因组中特异性保守序列设计1对引物,扩增片段的长度为275 bp。HPS-qF:5'-ACAACCTGCAAGTACTTA TCGGGAT-3',HPS-qR:5'-TAGCCTCCTGTCTG ATATTCCCACG-3', 引物由生工生物(上海)股份有限公司合成。
1.4 动物分组与处理仔猪被随机分成高剂量组、中剂量组、低剂量组和对照组,每组5头,各组均用滴鼻方式感染;分圈严格隔离饲养,均提供全价优质饲料饲喂,1周后开始试验。HPS滴鼻高剂量感染组鼻腔接种2 mL/头的HPS W2株(2×106CFU/mL),HPS滴鼻中剂量感染组鼻腔接2mL/头的HPS W2株(2×105CFU/mL),HPS滴鼻低剂量感染组鼻腔接种2mL/头的HPS W2株(2×104CFU/mL),对照组每头仔猪腹腔注射和鼻腔接种等量生理盐水。此后每日观察试验组的运动、呼吸、采食和饮水,连续观察20 d。在感染后的第4、8、12、16、20 d测量直肠体温并采集各组猪鼻拭子及血液,在攻毒后第12、20 d分别采用安乐死方式处死全部试验猪,剖检,观察各脏器的病理变化,收集扁桃体、心脏、肝脏、脾脏、肺脏、肾脏、腹部淋巴结、气管以及脑等组织。
1.5 样品中HPS的分离鉴定取上述样品的一部分进行HPS的病原分离,对分离到的疑似HPS按照文献进行PCR检测,同时对部分阳性核酸样品进行测序分析。
1.6 样品处理与荧光定量PCR检测每个鼻拭子样品中加入500 μL无菌PBS涡旋均匀;实质性器官按照质量与体积比为1∶1的比例加入无菌PBS并对各组织进行研磨。取200 μL血液或前述组织上清液,按照细菌基因组提取试剂盒说明书提取基因组DNA,按照本实验 室已建立的HPS荧光定量PCR检测方法,各样品中HPS载量与分布进行检测,每个样品进行3个平行试验,同时设置标准曲线,换算出各组织中HPS的拷贝数。
1.7 数据统计应用IBM SPSS Statistics 20软件和Excel对数据进行统计与分析。
2 结果
2.1 HPS感染猪的临床症状及剖检变化在试验期间对照组的猪只未发现临床症状。3个试验组的猪在感染HPS后均未出现死亡,但感染HPS的高、中剂量组的猪相对于对照组生长速度明显减缓,被毛粗乱。攻毒后第4 d,高剂量HPS感染组个别猪只出现精神沉郁;攻毒后第8 d,高、中剂量HPS感染组部分猪表现出食欲不振、呼吸困难;攻毒 后第12 d,高剂量HPS感染组个别猪只厌食、流涕、咳嗽以及大声喘气等明显症状;攻毒后第16 d,咳嗽和喘气症状逐渐好转;20 d后症状消除,采食、饮水和排泄均正常。
攻毒后12 d和20 d,对出现明显HPS临床症状的部分猪进行剖解,发现高剂量HPS感染组部分猪全身淋巴结肿大,特别是颌下淋巴结肿大明显,部分肺脏呈现淤血,气管内有脓性分泌物,其他脏器均未见明显肉眼病变;而对照组正常。
2.2 HPS感染猪体温变化由图1可知,对照组体温无明显变化。从第4 d开始,攻毒组部分猪只在攻毒后体温变化明显,大部分猪只均出现发热症状,体温高于对照组,并随时间延长持续升高,特别是高剂量感染组猪平均体温较其他组略升高1~2℃,第12 d时达到最高值,为40.9℃,显著高于对照组;第16 d各攻毒组体温逐渐下降;此后趋于正常。
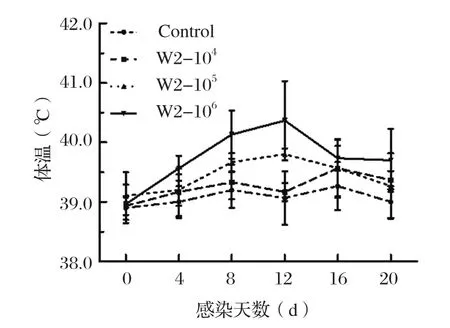
图1 各组平均体温的变化Fig.1 Mean rectal temperature of pigs in each group
2.3 HPS经鼻腔感染后在猪各组织中分布采用HPS荧光定量PCR方法检测HPS感染猪后各组织中HPS的分布由结果可知,HPS在气管、扁桃体、颌下淋巴结的检出率为100%,其次是肺脏、腹骨淋巴结,在心脏、肝脏、脾脏仅有高剂量感染组个别猪只检出,而在肾脏和脑组织中未检出。对照猪只各器官均未检测到HPS(表1)。
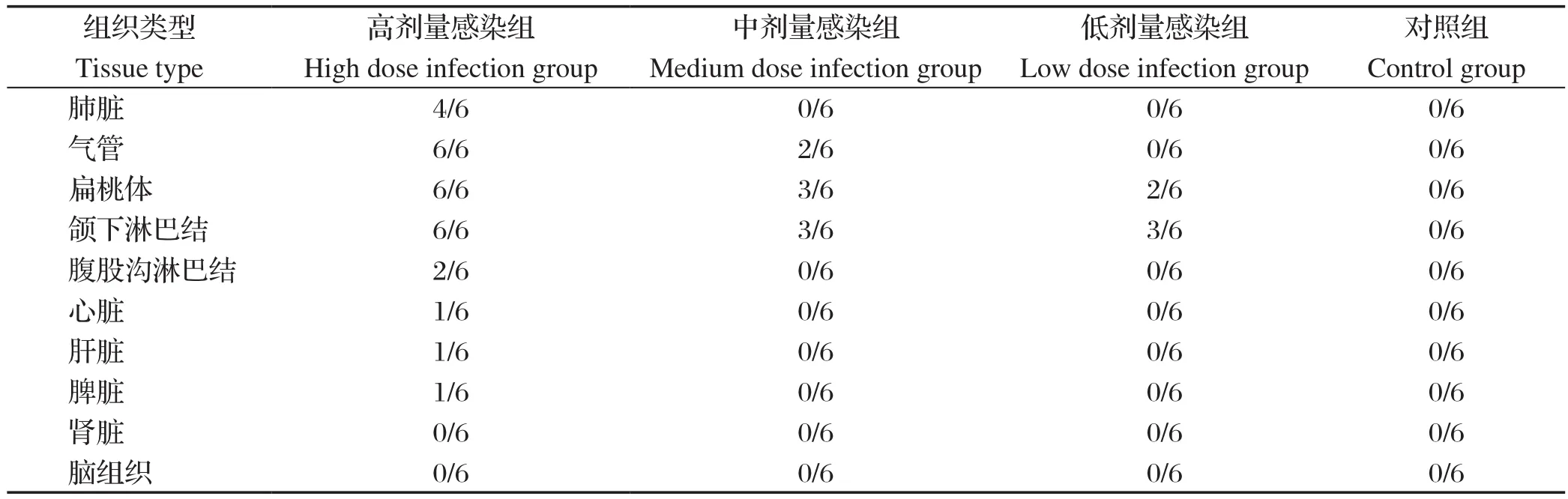
表1 HPS感染后在猪各组织中的分布Table 1 Distribution of HPS in pig tissues after infection
进一步对高剂量感染组猪各组织中HPS载量进行分析,发现在攻毒后12 d发病猪肺脏HPS载量最高,肺组织中载量较高,其次为气管、扁桃体、颌下淋巴结、腹股沟淋巴结、心脏、肝脏、脾脏(图2)。
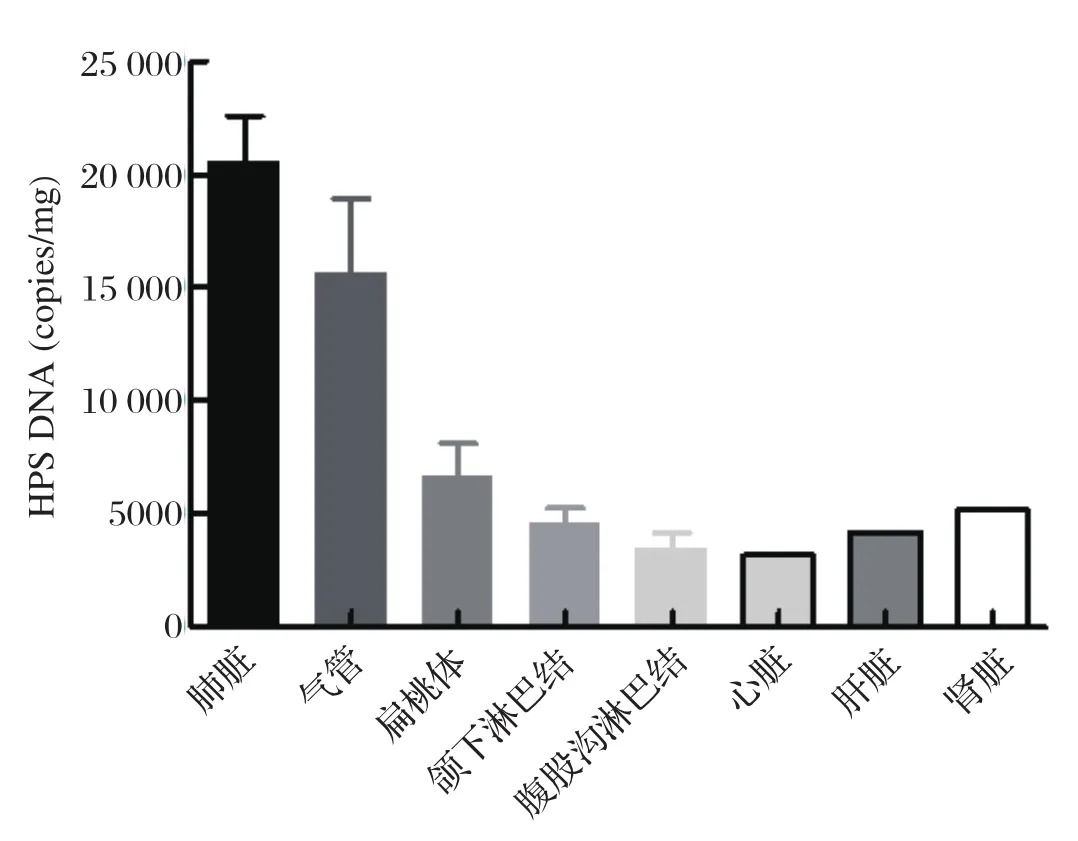
图2 HPS感染后在猪各组织中的载量分析Fig.2 HPS load in pig tissues after infection
2.4 HPS感染后猪血液和鼻拭子中HPS载量的动态变化在HPS感染后第4、8、12、16、20 d采各组猪鼻拭子和血液,采用HPS荧光定量PCR方法检测HPS感染后猪 血液和鼻拭子中HPS载量。各组猪只血液中均未检测到HPS。然而,猪只感染HPS后第8-20 d在鼻拭子中可检测到HPS,且 高剂量感染组猪HPS载量显著高于其他组(P<0.05)(图3),其中感染后12 d HPS载量达到最高值,表明HPS可以定殖在呼吸道,而且持续存在排毒,并表现为无规律排毒。
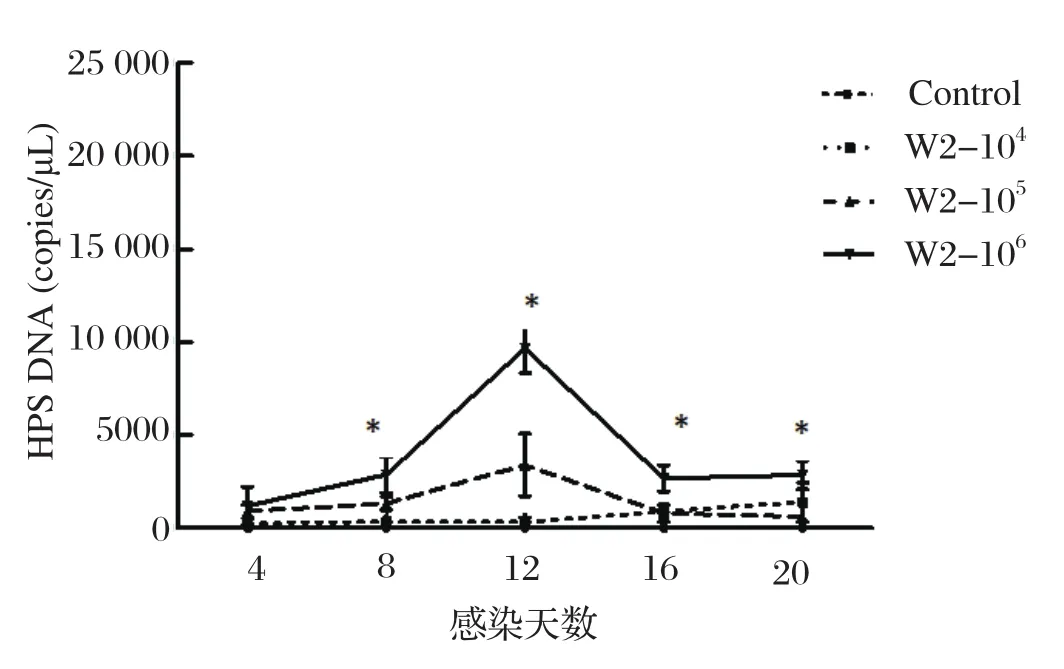
图3 HPS感染后猪鼻拭子中HPS载量的动态变化Fig.3 Dynamic changes of HPS load in nasal swabs of pigs after HPS infection
2.5 样品中HPS的分离鉴定对上述部分HPS阳性样品接种到TSA培养基上进行HPS的 病原分离,从鼻拭子、气管分泌物、肺脏、淋巴结等组织中分离到9株疑似HPS菌株,采用PCR方法对其进行进一步鉴定,在1%琼脂糖凝胶中电泳中,可见一条275 bp的目的条带(图4),大小与预期结果相符,选择一部分进行测序,经序列比对发现,均与GenBank数据库中HPS参考毒株一致,证明从发病猪分离的病原体为HPS。
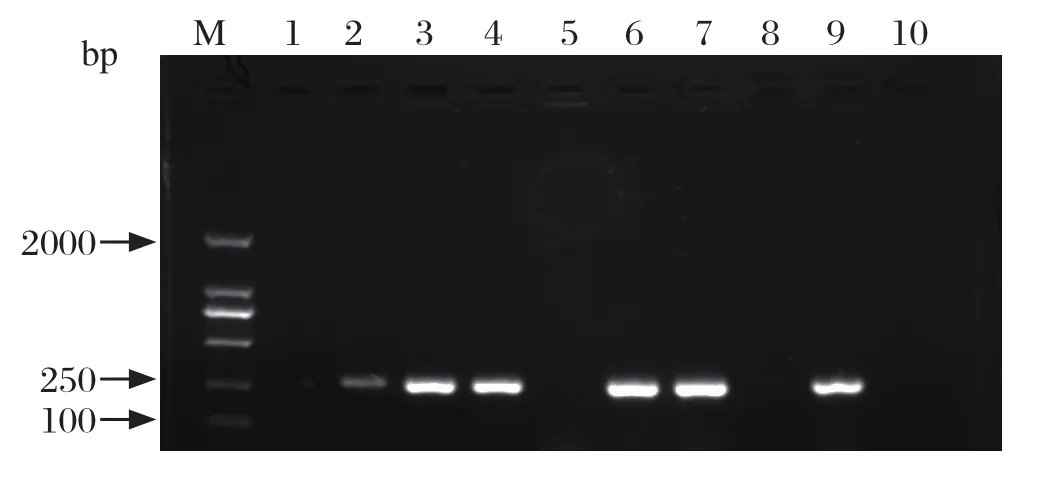
图4 疑似HPS菌株的PCR鉴定Fig.4 Identification of suspected HPS isolates by PCR
3 讨论
HPS是一种存在于上呼吸道的条件致病菌,可通过呼吸系统传播,常常作为一种继发性细菌和多种病原体混合感染,引发更为严重的全身性疾病,使猪群死亡率增加,给养猪业带来巨大的经济损失[19]。一般应用药物和疫苗两种方法对HPS引起的疾病进行防控,但HPS的血清型众多,各血清型之间交叉免疫保护现象较弱,临床中还有大量的HPS并未得到分离[16];且随着抗生素在猪产业的广泛应用,发现猪体对一些抗生素的耐药性逐渐增加;以上原因为临床上对HPS的防控带来了具体的挑战[17]。因此,了解HPS在仔猪机体内的动态变化过程、排毒、各组织中的分布等情况,可以为HPS致病机理及防控的研究奠定了一定的理论基础。
本研究观测了HPS感染仔猪临床症状(体温、体重、精神、食欲等),应用SYBR Green Ⅱ荧光定量PCR的方法检测了菌体在鼻黏膜和血液中动态变化过程,分析HPS在仔猪各组织中分布情况。研究发现,高剂量组临床症状相较于其他组更为明显;由图1可见,高剂量组的平均体温明显高于其他各组,且在感染后的第12 d时最高,然后缓慢下降。在感染的第8~20 d时高剂量组鼻拭子中HPS的载量显著的高于各组(P<0.05),在感染后的第12 d时排毒量达到最高(图3);从低、中剂量组鼻黏膜内的排毒情况来看,HPS可以定殖在呼吸道中且出现了持续性排毒的情况,但并不存在一定的排毒规律性,这一结果符合Pomorska-Mól等[18]研究的HPS和SIV混合感染时HPS增殖过程。通过检测HPS在各组织中分布发现,HPS主要定殖在气管、扁导体、淋巴结、肺组织中,此结论为HPS新型菌株的分离提供了思路。

