CA199、IL-10、CHI3L1联合检测在胰腺癌诊断中的价值*
贺龙梅,马燕粉,王晓倩,蔡晓辉,刘静文,马运峰,王晓琴△
1.西安交通大学第一附属医院检验科,陕西西安 710061;2.陕西省中医医院检验科,陕西西安 710082;3.中国人民解放军空军第九八六医院儿科,陕西西安 710054;4.西安交通大学基础医学院病原生物学与免疫学系,陕西西安 710082
胰腺癌是一种高度恶性且进展迅速的消化系统肿瘤,其5年生存率仅为5%。2020年美国癌症协会发布的数据显示,美国胰腺癌新发病例数位居男性恶性肿瘤的第10位,女性恶性肿瘤的第9位,病死率居恶性肿瘤的第3位[1]。中国国家癌症中心最新统计数据也显示,胰腺癌发病率位居中国城市男性恶性肿瘤的第8位,胰腺癌死亡率居北京市和上海市人群恶性肿瘤死亡率的第6位[2]。虽然现有的影像学方法极大地提高了胰腺癌诊断的特异度和灵敏度,但是受胰腺解剖学和胰腺癌生物学特征的影响,胰腺癌患者早期临床表现不典型,易侵犯周围组织器官以及发生远处转移,多数患者确诊时已属晚期,仅有约20%的患者在确诊时有接受根治性手术的机会[3-5]。血清肿瘤标志物检测简单、快捷,已成为胰腺癌筛查的首选方法。目前胰腺癌相关肿瘤标志物有多种,但单一指标检测均具有一定的局限性。本研究旨在探讨血清糖类抗原(CA)199、白细胞介素(IL)-10及壳多糖酶3样蛋白1(CHI3L1)联合检测在胰腺癌临床诊断中的价值。
1 资料与方法
1.1一般资料 选取2018年9月至2019年2月西安交通大学第一附属医院收治的胰腺癌患者40例,将其作为胰腺癌组;另外,选取肺癌患者40例(肺癌组)作为其他肿瘤对照,胰腺炎患者40例(胰腺炎组)作为炎症对照,西安交通大学第一附属医院同期体检健康者40例作为健康对照组。所有纳入研究的患者均经病理、实验室检查或影像学检查(超声、CT和磁共振等)等手段确诊。健康对照组人群经体检检查(包括常规生化检查、超声检查、心电图、胸部X线片等),排除有心脏、肝脏及肾脏等重要器官疾病者。各组间性别、年龄比较差异无统计学意义(P>0.05),具有可比性,见表1。
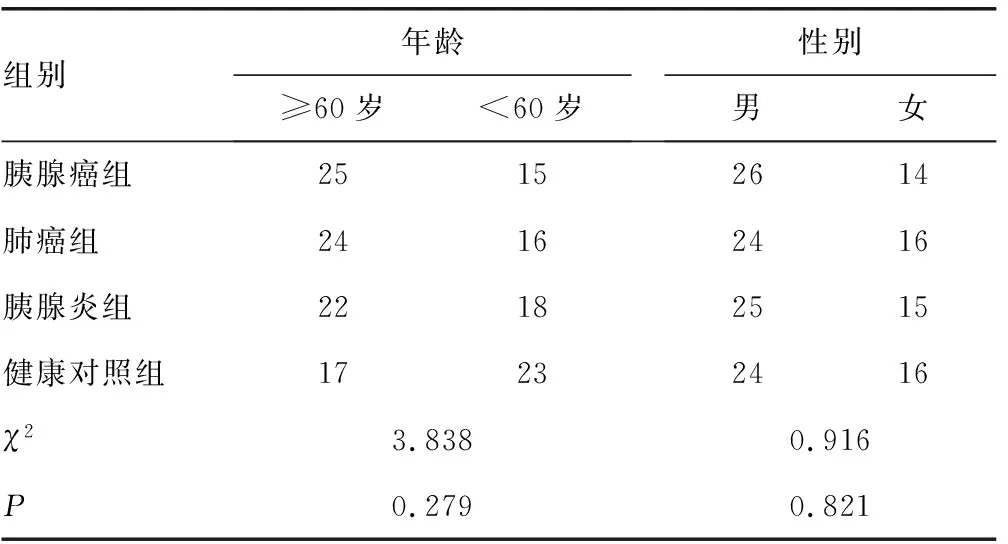
表1 胰腺癌组和各对照组一般资料比较(n=40,n)
1.2仪器与试剂 CA199的检测采用罗氏E170电化学发光分析仪及其配套试剂;IL-10的检测采用达优生物技术有限公司IL-10检测试剂盒;CHI3L1检测采用杭州普望生物技术有限公司试剂盒;采用美国Thermo公司的超微量分光光度计检测吸光度(A)。
1.3方法 采集清晨空腹静脉血5 mL于促凝管中,3 000 r/min离心10 min后分离血清,将血清分装为3管,其中1管用于CA199的检测,将另2管血清冻存于-80 ℃,直至所有标本收集完毕。标本收集完毕后于检测当日将冻存的血清取出置于室温复融,充分混匀后严格按照试剂盒说明书采用酶联免疫吸附试验(ELISA)分别检测IL-10和CHI3L1。用超微量分光光度计在450 nm处读取A值。应用软件拟合最优标准曲线,再输入样本A值计算相应检测指标水平。
1.4统计学处理 采用SPSS22.0软件进行数据分析,计量资料以M(P25~P75)表示,组间比较采用Kruskai-Wallis秩和检验;采用Logistic回归分析CA199、IL-10、CHI3L1水平对胰腺癌发生的影响;用Medcalc19.8软件绘制各检测指标的受试者工作特征(ROC)曲线;利用多元Logistic回归模型,由各指标的线性组合计算预测概率P,然后用预测概率P计算联合检测的曲线下面积(AUC)[6];分析AUC、灵敏度与特异度;P<0.05为差异有统计学意义。
2 结 果
2.1各组间血清CA199、IL-10、CHI3L1水平的比较 胰腺癌组血清CA199水平高于其他各组(P<0.05);胰腺癌组IL-10水平高于胰腺炎组和健康对照组(P<0.05);胰腺癌组CHI3L1水平高于肺癌组和健康对照组(P<0.05)。见表2。
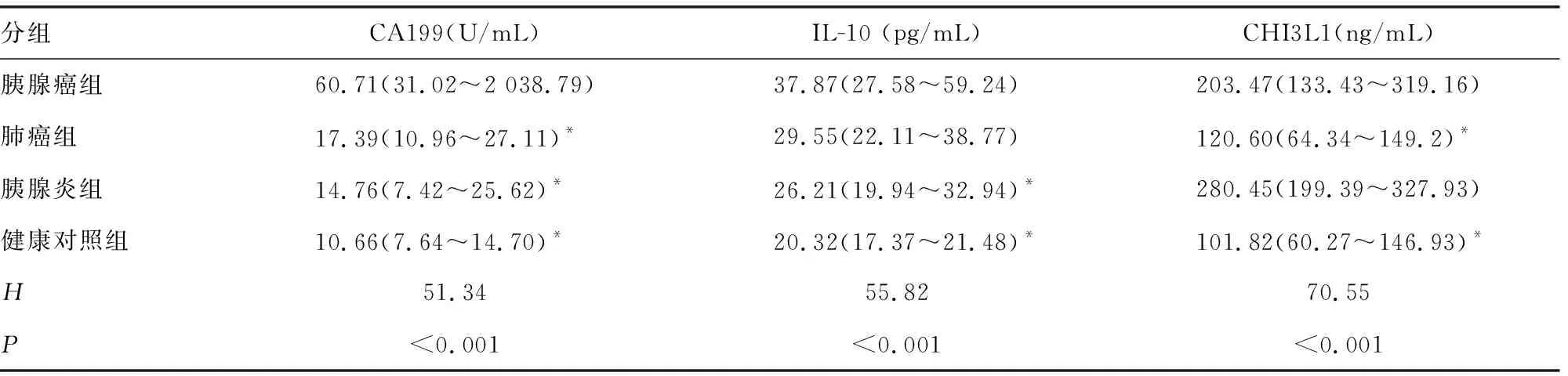
表2 各组血清CA199、IL-10、CHI3L1水平比较[n=40,M(P25~P75)]
2.2各指标水平对胰腺癌发生的影响 CA199、IL-10、CHI3L1是胰腺癌发生的危险因素(P<0.05),见表3。
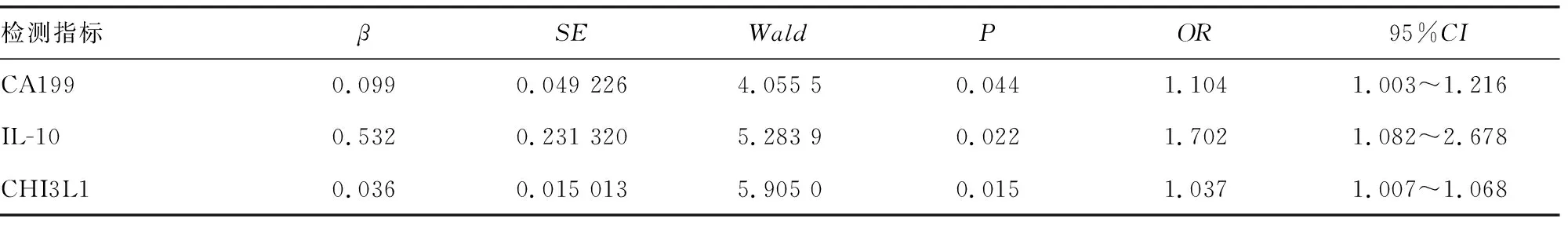
表3 Logistic回归分析各指标对胰腺癌发生的影响
2.3各项指标检测用于胰腺癌诊断的效能 单项指标检测中,CA199对胰腺癌的诊断特异度最高,为95.0%, AUC为0.908;IL-10对胰腺癌的诊断灵敏度最高,为87.5%,AUC为0.936;CHI3L1诊断胰腺癌的AUC为0.820。3项指标联合检测的特异度、灵敏度分别为97.5%、97.5%,AUC为0.996。CA199、IL-10、CHI3L1联合检测时,AUC优于CA199、IL-10、CHI3L1单独检测,见表4、图1。
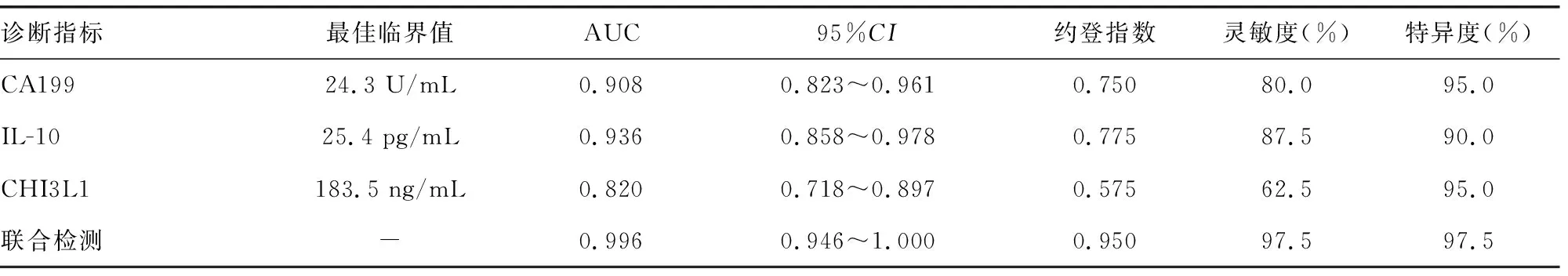
表4 单独及联合检测CA199、IL-10、CHI3L1对胰腺癌的诊断效能分析

图1 CA199、IL-10、CHI3L1单独及联合检测用于胰腺癌诊断的ROC曲线
3 讨 论
胰腺癌是一种恶性程度很高,诊疗较为困难的消化道恶性肿瘤,是预后最差的恶性肿瘤之一,而其发病率和死亡率近年来明显上升。胰腺癌的发生机制尚不十分清楚,但家族史、肥胖、吸烟、慢性胰腺炎及糖尿病史等都被认为是胰腺癌的危险因素。受胰腺解剖学和胰腺癌生物学特征的影响,胰腺癌患者早期无明显临床症状或症状较轻,当有典型临床表现时,疾病往往已进展至中后期,80%的患者确诊时已因肿瘤转移或侵袭到胰外器官而无法行根治性切除术,75%的胰腺癌患者在确诊后1年内死亡,中位生存时间为4~6个月。早期诊断、早期治疗能提高胰腺癌患者的5年生存率,延长患者生存时间[7-8]。如何提高胰腺癌早期检出率是当前众多临床学者研究的重点。近年来,由于血清肿瘤标志物检测具有准确、快速、微量,患者痛苦小,接受度高等优点,其作为新的诊断技术在胰腺癌的早期发现以及肿瘤的诊断、鉴别诊断与分期等方面的应用有了进一步的进展。
CA199是一种存在于细胞膜上的糖蛋白,表达于健康人的正常胰腺导管上皮细胞,通常以唾液黏蛋白存在于血清中,健康人血清中的水平相对较低[9],是胰腺癌中最有效的生物标志物和异常糖基化的指标。CA199在胰腺癌中起着生物标志物、预测因子和启动子的作用。作为一种生物标志物,其面临的主要挑战在于炎症和非胰腺癌所造成的假阳性和Lewis阴性个体造成的假阴性。当使用CA199作为生物标志物时,应确定Lewis抗原状态[10-11]。本研究显示,胰腺癌患者血清CA199水平显著高于健康对照组和胰腺炎组,特异度为95.0%,灵敏度为80.0%,AUC为0.908。这与秦牛等[11]的研究报道一致。
IL-10是肿瘤细胞的生长因子,可以维持肿瘤细胞生长和增殖,IL-10水平升高与某些癌症有关,例如卵巢癌、黑色素瘤、淋巴瘤、骨髓瘤。值得注意的是,IL-10表达升高可能是由于多种原因引起的,其意义截然不同:IL-10可由肿瘤细胞自身表达,也可由参与宿主抗肿瘤反应的活化细胞产生,它可能是一种有效的炎性反应而不是免疫抑制指标。在霍奇金淋巴瘤和非霍奇金淋巴瘤中,IL-10血清水平升高被认为是生存或治疗反应的影响因素;血清中可检测到的IL-10也被认为是肝细胞癌、肺癌、肾癌、胃癌或结直肠癌以及其他实体瘤临床转归的阴性指标;相反,在一项弥漫性大细胞淋巴瘤的研究中,血清IL-10水平与预后无关[12]。综上所述,IL-10在肿瘤及其预后中的作用尚不明确。迄今为止,国内外关于IL-10在胰腺癌患者血清中的变化研究较少。本研究发现,胰腺癌组患者血清IL-10水平显著高于健康对照组和胰腺炎组,特异度为90.0%,灵敏度为87.5%,AUC为0.936,对胰腺癌具有较高的诊断价值。
CHI3L1是哺乳动物壳多糖酶家族的成员,又称为YKL-40。其在肿瘤中的生物学机制和生理功能尚未完全阐明,CHI3L1通过促炎、促肿瘤和促血管生成因子的生成而在癌症中发挥作用,了解CHI3L1的生物学和生理学功能对于治疗炎症性疾病以及诊断与治疗肿瘤至关重要[13]。随着研究的不断深入,有学者发现血浆CHI3L1水平的增加与酒精性肝炎、胰腺损伤等疾病有关[14]。本课题组成员前期研究发现,CHI3L1与胰腺癌具有相关性,在胰腺癌中呈高表达,且与胰腺癌TNM分期显著相关[15]。一直以来,胰腺癌发病的众所周知的高危因素是胰腺炎,并且在遗传性胰腺炎综合征患者中,这种癌症的终生风险可达到40%,与SPINK1和PRSS1的突变有关。这与本研究中CHI3L1血清水平在胰腺炎与胰腺癌患者中均高于健康体检者的结果相一致。
本研究在前期研究的基础上,初步探讨了CA199、IL-10、CHI3L1 3项指标单独检测与联合检测的诊断效能。通过ROC曲线分析发现,CA199、IL-10、CHI3L1对胰腺癌患者均有一定的诊断价值,其中IL-10的诊断价值最大(AUC=0.936)。CA199、IL-10和CHI3L1在胰腺癌患者血清中呈高表达,IL-10和CHI3L1有望成为胰腺癌新的临床诊断指标。在胰腺癌患者中联合检测血清CA199、IL-10及CHI3L1水平具有较高的临床诊断价值。下一步本课题组将扩大样本量,对IL-10和CHI3L1在胰腺癌中的作用机制进行研究,以期进一步地明确胰腺癌发生、发展的机制。

