肠减压后腹腔镜辅助右半结肠切除术在右半结肠癌伴肠梗阻中的应用
巫 诚,俞金龙,邹兆伟
(南方医科大学珠江医院普通外科,广州 510280)
肠癌是常见恶性肿瘤,发病率在所有肿瘤中高居第3位[1]。在原发性肠癌患者中,约20%的患者并发肠梗阻,其中1/3的梗阻位于右半结肠[2-4]。对于治疗右半结肠癌并发梗阻患者来说,手术切除肿瘤解除肠梗阻是最主要的治疗手段[5]。目前,主要有两种手术方式可供选择:传统开腹手术和腹腔镜下微创手术。传统开腹手术需要较大手术切口来充分显露术野以进行手术操作,因此术后易出现较多手术并发症,对患者快速恢复产生不利影响[6]。腹腔镜手术因其创口小、术中出血量少、术后并发症少及术后恢复快等优势,被广泛应用于结直肠癌患者的手术治疗中[7]。然而,右半结肠癌患者合并梗阻时肿瘤大多为局部晚期,梗阻段肠管严重扩张,操作空间严格受限,给腹腔镜手术带来巨大困难,术中易损伤扩张肠管及其他重要血管而危及患者生命。因此,在一段时间内,右半结肠癌伴完全性肠梗阻一度被认为不适合采用腔镜手术[8]。为解决这一难题,本研究采用了肠减压后联合入路翻页式腹腔镜辅助右半结肠癌根治术。本研究旨在进一步研究术中肠减压后联合入路翻页式腹腔镜辅助右半结肠癌根治术治疗右半结肠癌合并肠梗阻患者的可行性及疗效,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2019年1月至2020年6月在本院普通外科就诊的急性右侧梗阻性结肠癌患者的病历资料。所有患者术前腹部立位平片均提示严重肠梗阻且明确诊断为右半结肠从盲肠至近端横结肠的占位性及阻塞性病变。共53例纳入本研究,所有病例均经术后病理证实为结肠癌。其中男37例,女16例;按病理分期Ⅱ期20例,Ⅲ期33例。根据其手术方式分为肠减压后联合入路翻页式腹腔镜辅助右半结肠癌根治术组(腹腔镜组,n=22)和传统开腹手术组(传统开腹组,n=31)。两组患者年龄、性别及体重指数(BMI)等资料比较,差异均无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1腹腔镜组手术方法
患者术前均有典型肠梗阻症状,腹部膨隆,全腹叩诊鼓音,腹部立位平片(图1A)及腹部CT提示为右半结肠癌伴肠梗阻,不减压均无法建立腹腔镜操作空间。完善术前准备后,患者在气管插管全身麻醉下,取上腹正中切口(长5~7 cm),进入腹腔后,切口处置入腹部切口扩张器,通过扩张器口将小肠移出腹腔,在距回盲部约10 cm的回肠处以小圆针一号线行荷包缝合,横行切开回肠壁1 cm,置入负压吸引管后收紧荷包,随后进行肠管减压,减压完毕后浆肌层间断加固缝合数针封闭回肠切口,将小肠回纳腹腔。重新建立气腹后行联合入路翻页式腹腔镜辅助右半结肠癌根治术[9],详细手术过程见图1B~F。
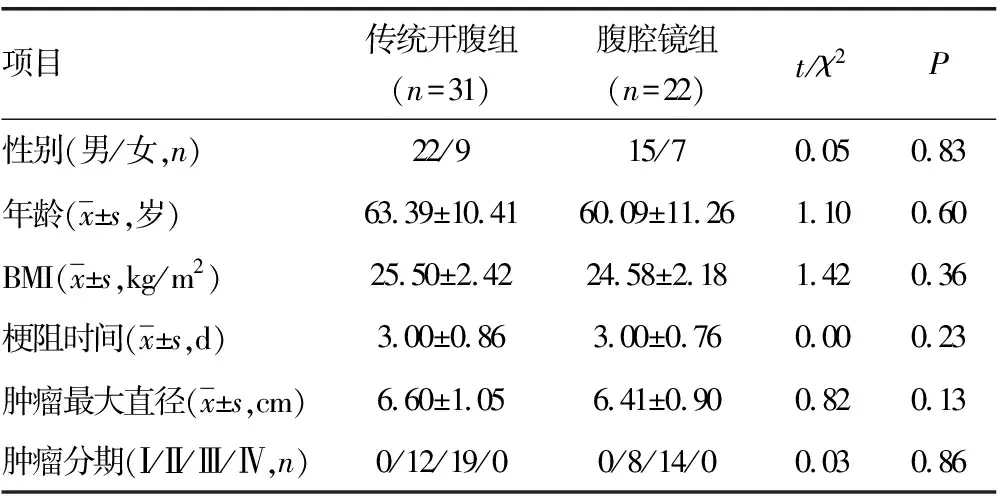
表1 两组患者一般资料比较
1.2.2传统开腹组手术方法
患者术前腹部立位平片及腹部CT均明确提示为右半结肠癌伴肠梗阻,腹腔肠管扩张严重,无法建立腹腔镜操作空间进行微创治疗。术前准备及麻醉同腹腔镜组,取右侧腹直肌切口,若肠梗阻较严重则先行小肠的术中减压,根据肿瘤的根治原则先从系膜根部阻断血管根部后再从外周入路进行右半结肠的游离、切除,同样行回肠、横结肠端侧吻合。
1.2.3观察指标
比较两组患者的手术时间、术中出血量、切口长度、切口感染发生率、术后肛门排气时间、术后住院时间、术后腹腔近期并发症发生率(吻合口瘘、吻合口出血、腹腔感染)。
1.3 统计学处理
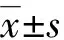

A:术前腹部立位平片;B:肠减压前腹腔内空间;C:移出腹腔的扩张小肠;D:术中小肠减压;E:肠减压后腹腔内空间;F:手术后术野巡查。
2 结 果
2.1 两组患者手术相关情况比较
两组患者手术时间比较差异无统计学意义(P>0.05)。但腹腔镜组患者的手术切口长度短于传统开腹组,术中出血量少于传统开腹组,术后恢复排气时间短于传统开腹手术组,平均住院时间也明显少于传统开腹组,两组患者上述指标比较差异均有统计学意义(P<0.05),见表2。

表2 两组患者术中及术后情况比较
2.2 两组患者术后并发症比较
腹腔镜组患者术后未出现吻合口瘘及腹腔内出血情况,只有1例患者发生手术切口感染。传统开腹组有6例患者发生了手术切口感染,其中还有1例患者出现吻合口瘘,但两组患者总并发症比较,差异无统计学意义(P>0.05),见表3。

表3 两组患者术后并发症比较[n(%)]
3 讨 论
肠梗阻是结肠癌患者临床较为常见的并发症之一,其临床症状常表现为腹部胀痛、便秘及呕吐等,对患者的生存、生活质量及术后恢复产生极大不利影响[10-11]。临床上对于结肠癌合并肠梗阻患者一般首要选择是传统开腹手术,这种术式可以有效切除肿瘤,解除患者肠梗阻,挽救患者生命。但是,这种术式在术中需要有较大手术切口来进行手术操作,手术过程中出血量较多,术后出现各种并发症的概率也明显增加,这些对患者术后康复都将带来不利影响[12-13]。随着手术技术的发展,自1991年首次报道腹腔镜结肠切除术治疗结肠癌以来[14],腹腔镜手术在结肠直肠肿瘤中的应用已在世界范围内得到广泛应用。腹腔镜手术具有创伤小、手术时间短、术中出血量少和术后并发症少的优势,从而可加快患者的术后恢复速度[15]。
但是,对于完全梗阻性结直肠癌患者来说,腹腔内肠管严重扩张水肿,常规气腹下,无法充分暴露术野。若行腹腔镜手术,损伤肠管及重要血管风险极大,对患者生命造成巨大威胁。因此,在一段时间内,结肠癌伴完全性肠梗阻患者被认为不适宜接受腹腔镜手术治疗[8]。近年来,许多学者对梗阻性结肠癌的腹腔镜治疗进行了一些探索。结直肠支架已被成功地用于阻塞的左侧结直肠癌治疗[16]。STIPA等[17]首次对31例阻塞性结直肠癌患者行内镜下自体扩张金属支架减压术;肠梗阻消失约1周后,行腹腔镜微创手术,取得满意效果。但是支架的最佳位置是在直肠和乙状结肠,这样只能治疗部分左侧梗阻性结肠肿瘤。对梗阻性右半结肠癌患者使用结直肠支架治疗鲜有报道。到目前为止,如何使用腹腔镜微创治疗右侧梗阻性结肠癌仍未在临床很好地应用。为阻塞性结直肠癌患者提供足够的腹腔镜手术空间是成功实施腹腔镜微创治疗的关键。
为了解决这一难题,在临床实践中,本课题组在治疗急性梗阻性右半结肠癌患者时,选择上腹正中切口对扩张肠袢进行减压,此切口也可用于后续标本取出。与常规腹腔镜微创手术相比,并不会额外增加患者创口,符合微创要求。在将肠管移出腹腔后,本研究选择在距回盲部约10 cm处的回肠用小圆针1号线进行荷包缝合,在置入负压吸引管后,可收紧荷包避免减压过程中粪水溢出造成腹腔污染。在这个位置置入负压吸引器,可获得最为满意减压效果,因为吸引器既可以向近端对小肠行肠管减压,也可以对远端结肠进行减压。同时,这个切口将随后续标本一起移除,并不额外造成创伤及增加手术操作。减压完毕还纳肠管后,腹部切口扩张器可予7.5号手套封闭。在常规气腹压力下建立气腹,腹腔内空间大为改善,术野显露良好,明显提高了手术的安全性,为后续腹腔镜下行肿瘤根治术提供了条件。本研究中,患者均达到了腹腔镜下完整结肠系膜切除、中央血管结扎及D3 淋巴结清扫的要求(如图1F)。本研究通过此种术式成功为腹腔镜组22例梗阻性右半结肠癌患者切除肿瘤并且Ⅰ期吻合肠管,无一例中转开腹。
本研究结果显示,肠减压后联合入路翻页式腹腔镜辅助右半结肠癌根治术比传统开腹手术在缩短手术切口长度、减少术中出血、加快术后肠道功能恢复等方面具有明显优势,这些都明显加快了患者术后康复,明显缩短了患者住院时间,减轻了患者痛苦及经济负担。本研究中传统开腹组术后6例(19.35%)手术切口感染,腹腔镜组只有1例(4.54%)患者出现了手术切口感染,但两组患者切口感染率比较差异无统计学意义(P>0.05)。可见,进行肠道内减压为腹腔镜微创手术创造空间的同时并不会额外增加术后手术切口感染风险。
本研究也存在一些不足之处:(1)所有患者均来自单中心,对手术方式的开展及评估存在一定局限性。(2)研究时间较短,纳入患者数量较少,导致对两组患者术中、术后情况及并发症发生率评估造成一定误差。(3)由于聚焦于两种术式在梗阻性右半结肠癌患者治疗中的可行性及疗效分析,本研究未收集患者术后治疗及远期生存率数据进行分析。因此,后续需要大样本量、多中心行进一步研究。
综上所述,本研究认为通过术中进行肠减压可以改善腹腔空间,进而可为梗阻性右半结肠癌的腹腔镜下手术治疗创造机会。相对于难以进行腹腔镜微创治疗而选择传统开腹手术,此术式具有手术切口小、术中出血少、住院时间短的优势,可加快患者术后康复,减轻患者痛苦及经济负担。

