季节性冻融对宁武公海湖细菌群落多样性的影响
柴宝峰,李晓琪,刘晋仙
(山西大学 黄土高原研究所,黄土高原生态恢复山西省重点实验室,山西 太原 030006)
0 引言
季节性冻融是温带大陆气候和温带季风气候区重要的气候特征。世界上大约有一半的湖泊,尤其是在中高纬度地区的湖泊都存在季节性冻融现象[1]。湖冰物候受区域以及全球气候变化影响,而高海拔的山地是气候变化的敏感区[2]。近年来,由于全球气温升高,湖泊覆冰时间减少,导致湖泊的季节性动态发生变化[1],进而改变湖泊的生态功能[3]。湖冰在蓄积热量、控制湖泊水体温度、维持湖泊生物多样性等方面发挥着重要作用。冰层对湖泊的影响包括降低水温、降低光合有效辐射、改变湖泊水体混合状态、减少水体和大气交换、减少陆源径流输入等,并且可以通过改变这些能量和物质输入的时间和空间特征影响湖泊生态系统。温度变化直接影响冻融过程的发生,并使湖泊水动力发生变化[4],从而对微生物的分布和多样性造成影响,进而影响到更高的营养级,最终对整个湖泊生态系统产生影响[5]。营养物质通常是山地湖泊中影响微生物生长的限制因素,在冰雪覆盖期间发生的营养状况的改变可能会筛选出寡营养型微生物类群;光有效辐射的降低会影响光合自养微生物的丰度和活性,从而改变冰期的初级生产力。尽管湖冰物候的改变会导致湖泊生态系统发生一系列变化,但季节性冻融如何影响山地湖泊生态系统中细菌群落的多样性目前尚不清楚。已有的研究也仅通过对比湖冰产生前后的湖泊条件来间接推断微生物群落的变化[6],有研究表明湖泊中的微生物在不同季节间的变化存在级联效应,如冬季湖泊中藻类的组成和多样性直接决定春季是否会出现水华[7],因此进一步深入了解冬季湖泊状况,对湖泊生态系统的整体认识具有重要意义。
细菌是湖泊生态系统中的重要成员,不仅是多种元素循环的驱动者,也是水生食物网的主要组分。细菌群落数量庞大,种类繁多,在微食物网中占据重要地位。已有研究表明,湖泊深度[8]、营养盐浓度[9]、降水量[10]、水体温度[11]等都会影响细菌群落的多样性及其空间分布。冻融过程对细菌群落影响的研究多集中在土壤[12]、海洋和极地[13],这些研究结果表明冻融显著改变了细菌群落的组成和结构[14]。在许多淡水和沿海系统中,微生物群落的季节差异与有机物和养分输入的差异有关,而在内陆淡水山地湖泊中细菌群落在冻融过程中是否和其他生境中的变化具有一致性,目前还未有报道。因此对冻融过程中细菌群落在湖泊生态系统中适应性的全面了解,对于未来更好地管理和维护湖泊生态系统功能具有深远的意义。本研究通过分析冰封期和消融期山西宁武公海湖中的细菌群落,旨在探讨以下问题:(1)季节性冻融如何影响细菌群落的组成和多样性?(2)季节性冻融如何影响细菌群落中不同物种间的互作关系?
1 材料与方法
1.1 研究区概况
公海湖(38°91′N,112°23′E),位于山西省宁武县西南的管涔山,海拔1 854 m,面积0.36 km2,最大水深约8 m,湖床平坦,为降水补给的小型封闭淡水湖[15]。该区域属温带季风气候,冬季寒冷漫长多风雪,夏季凉爽,降水充沛,年平均气温6.2℃,年均降水量470 mm~770 mm。公海湖于每年11月初开始结冰进入冰封期,一直持续到翌年3月底,在这段时间内湖面被冰层完全覆盖,湖水波动较小,处于较稳定的状态,随着天气转暖,冰层逐渐消融,直至4月底完全融化(图1)。在冰封期,湖水和外界无直接接触,处于隔绝状态,水体在冰盖下和大气之间的物质能量交换被阻隔。

图1 山西省宁武县公海湖全景图(A)2019年4月消融期;(B)2018年12月冰封期Fig.1 Gonghai Lake located in Ningwu,Shanxi.(A)Ice free in April 2019;(B)Ice covered in December 2018
1.2 研究方法
1.2.1 样品采集、理化性质测定
实验所用样品分别采集于2018年12月和2019年4月。在公海湖中央从表面到湖底每隔2 m设立一个采样点,共5个采样点(分别是0 m、2 m、4 m、6 m、8 m),每个采样点取3个重复,每个重复间隔1 m左右。在每个采样点利用采水器收集水样3 L装于无菌塑料桶中运回实验室,后用0.2 μm聚碳酸酯滤膜过滤2.5 L,然后把滤膜放置到无菌离心管中,于-20℃保存用于后续微生物基因组的提取,剩余的0.5 L用于理化性质分析。
水体温度(T)、pH、电导率(EC)、溶解氧(DO)、盐度(SAL)、氨态氮()和硝态氮()含量用便携式水质监测仪(Aquread AP-2000,UK)原位测定;总碳(TC)、总有机碳(TOC)和无机碳(IC)含量用TOC分析仪(Shimadzu,TOC-VCPH,Japan)测定;亚硝态氮()、硫酸盐()和磷酸盐()含量用全自动间断化学分析仪(Cleverchem Anna,DeChem-Tech,Germany)测定。
1.2.2 样品DNA提取及高通量测序
用快速提取试剂盒(MP Biomedicals,Solon,OH,USA)提取水体样本基因组,测定浓度和纯度后于-20℃保存。细菌PCR扩增使用引物338F(ACTCCTACGGGAGGCAGCAG) 和 806R(GGACTACHVGGGTWTCTAAT)扩增 V3-V4高变区,扩增体系及条件参照Liu等人的方法[16]进行。通过Illumina Miseq高通量测序平台(上海美吉生物医药科技有限公司)对扩增产物进行测序。获得序列后,将原始序列在FLASH中进行合并,并使用QIIME去除嵌合体,按照97%的相似性进行操作分类单元(operational taxonomic units,OTU)聚类,细菌序列使用SILVA库进行比对,置信阈值为70%。最后对所得OTU按最小样本序列数抽平后进行后续分析。
1.3 数据分析
对所有数据进行正态分布检验,符合正态分布检验的数据使用配对样本t检验,不符合的使用wilcoxon秩和检验。水体理化参数的季节间差异使用配对样本t检验进行分析,细菌群落α多样性指数的季节间差异和细菌优势类群的组间差异用wilcoxon秩和检验分析;利用Spearman相关性分析不同季节优势类群和环境因子的相关性(SPSS 20.0);基于Bray-Curtis距离的PCoA用于分析细菌群落的空间分布格局(R软件Ape程序包),用ANOSIM分析检验群落结构的差异性(R软件Vegan程序包),在Canoco 5软件中通过前选择筛选出对群落结构有显著影响的环境因子,然后通过冗余分析(RDA)分析细菌群落和水体理化参数的关系。为了揭示细菌群落间的相互作用,在属水平采用随机矩阵原理(random matrix theory,RMT)构建不同时期微生物共现网络[17]。网络性质参数及相关过程均在Molecular Ecological Network Analyses Pipeline(MENA)(http://ieg4.rccc.ou.edu/mena)网站上完成[18]。为确保在同等条件下进行网络分析,采用0.83的阈值来构建冰封和消融期的两个网络,最后利用Cytoscape 3.6.1软件将结果可视化。所有统计分析的显著性水平均为95%(P<0.05)。
2 结果
2.1 水体理化因子
水体理化参数在季节性冻融过程中发生了显著改变。湖面覆冰消融后的4月水体T、DO、、、TC、TOC和IC浓度显著增高(P< 0.05);而EC和浓度则在12月的冰封期较高(P<0.05);浓度在2个时期间没有显著的变化(表1)。
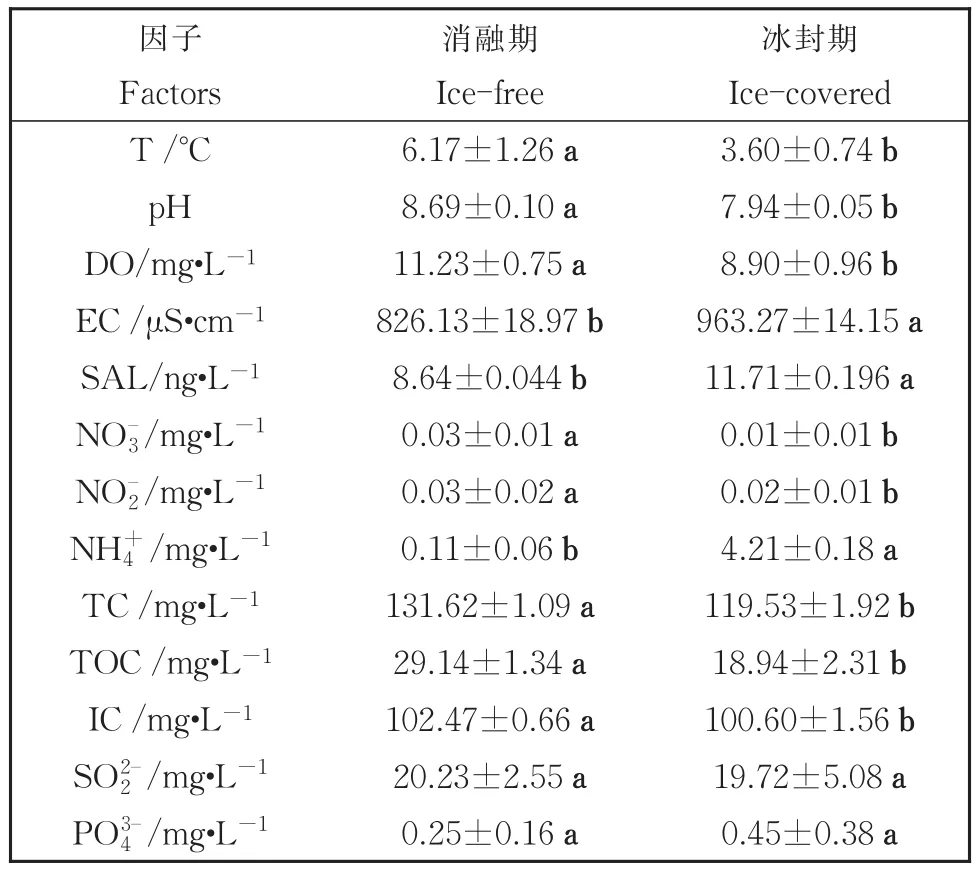
表1 公海湖在消融期和冰封期的水体理化参数Table 1 Physicochemical parameters in ice-free and ice-cov‐ered periods of Gonghai Lake
2.2 细菌群落组成
在冰封期和消融期的细菌群落隶属于53个门,126个纲,338个目,575个科,1 039个属,2 066个种,5 090个OTU。相对丰度>1%的分类群定义为优势类群,相对丰度<1%的合并为其他(others)。其中6个门为优势门,包括放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)和Patescibacteria(图2A)。共有27个优势属,其中HgcI_clade是丰度最高的属,其相对丰度在冰封期和消融期分别占12.15%和16.82%(图2B)。
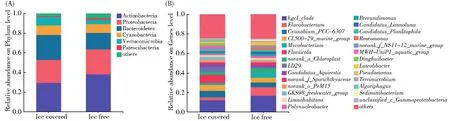
图2 消融期和冰封期优势细菌组成。(A)优势细菌门;(B)优势细菌属Fig.2 Composition of dominant bacterial taxas during ice free and ice covered periods.(A)Phylum level;(B)Genus level.
对优势类群相对丰度的组间差异性分析的结果显示,放线菌门的相对丰度在消融期显著高于冰封期,而拟杆菌门和疣微菌门的相对丰度在冰封期较高,其余3个优势门的相对丰度在季节性消融过程中均没有发生显著变化(图3A)。在属水平上,27个优势属中有23个优势属的相对丰度在湖面覆冰消融过程中发生了显著变化。Fluviicola、LD29、Candidatus_Aquirestis、norank_o__PeM15、GKS98_freshwater_group、norank_f__NS11-12_marine_group、MWH-UniP1_aquatic_group、定慧杆菌(Dinghuibacter)、Terrimicrobium和噬冷菌属(Algoriphagus)这10个属的相对丰度在冰封期显著高于消融期;其余13个属的相对丰度则在消融期显著高于冰封期(图3B)。优势类群相对丰度在湖冰冻融过程中的变化与水体理化参数有显著的相关性,不论是在门水平还是属水平不同类群相对丰度的变化主要受T、pH、DO、EC、氮和碳(TC、TOC)等理化因子变化的影响(图4)。
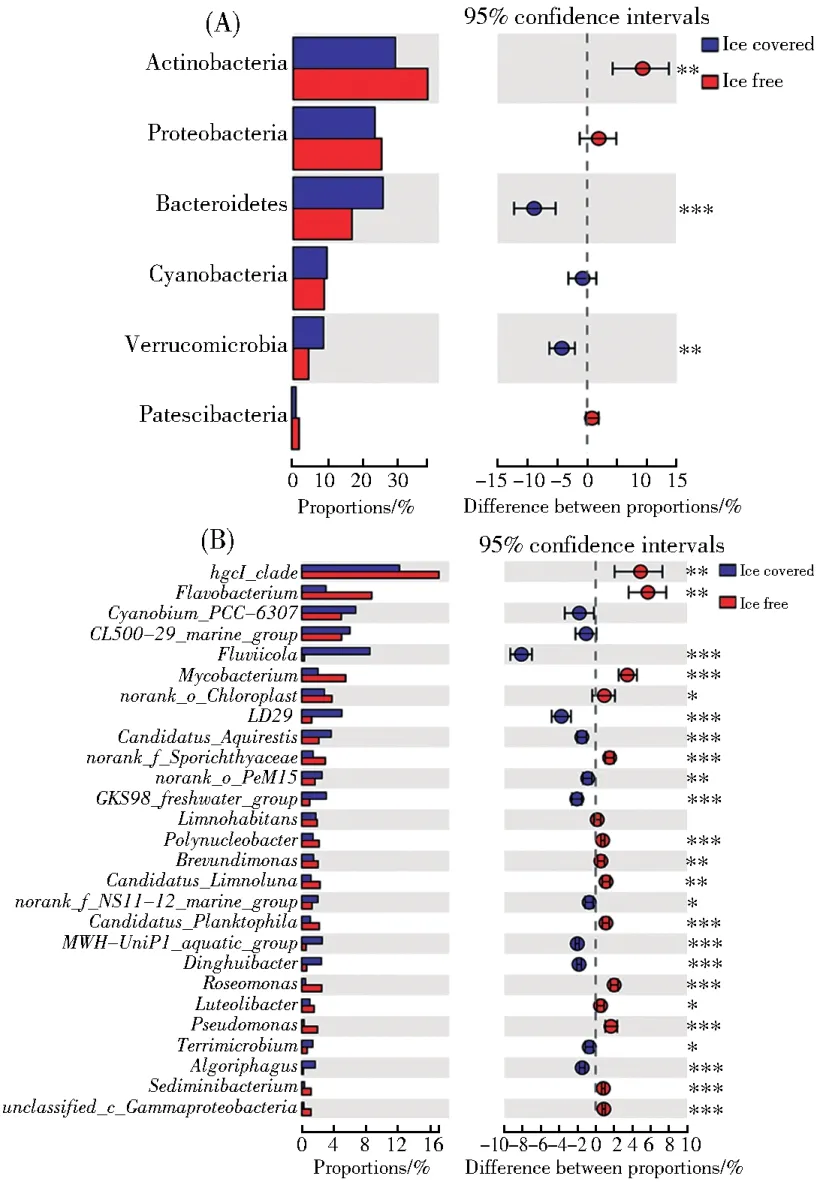
图3 消融期和冰封期细菌优势类群相对丰度的变化趋势(A)门水平;(B)属水平Fig.3 Changes in relative abundance of dominant bacterial taxas during the ice free and ice covered period(A)Phylum level;(B)Genus level
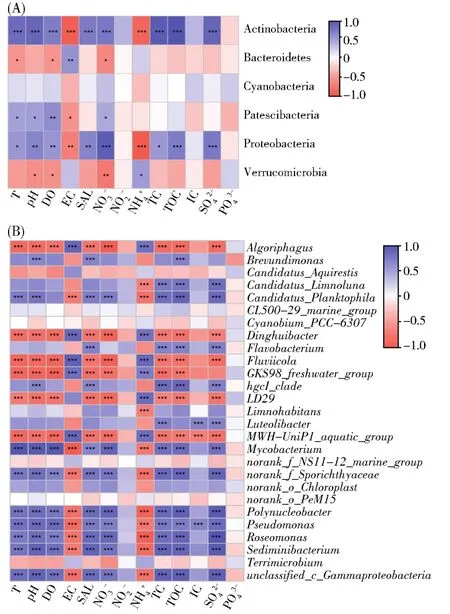
图4 水体理化参数和细菌优势类群相对丰度的相关性热图(A)门水平(B)属水平Fig.4 Heat map of the correlation between the physical and chemical parameters of the water and the relative abundance of dominant bacterial taxas(A)Phylum level(B)Genus level
2.3 细菌群落的多样性
细菌群落的α多样性在季节性冻融过程中发生了一定的变化。在消融期细菌群落的OTUs和Simpson指数显著高于冰封期(P<0.05),而Shannon指数在两个时期间没有显著差异(图5)。OTU数目与多种理化因子(除了和)存在显著的相关性,Simpson指数主要与TC和TOC显著相关(表2)。

图5 消融期和冰封期细菌群落的α多样性Fig.5 Alpha-diversity of bacterial communities during the ice-free and ice-covered periods
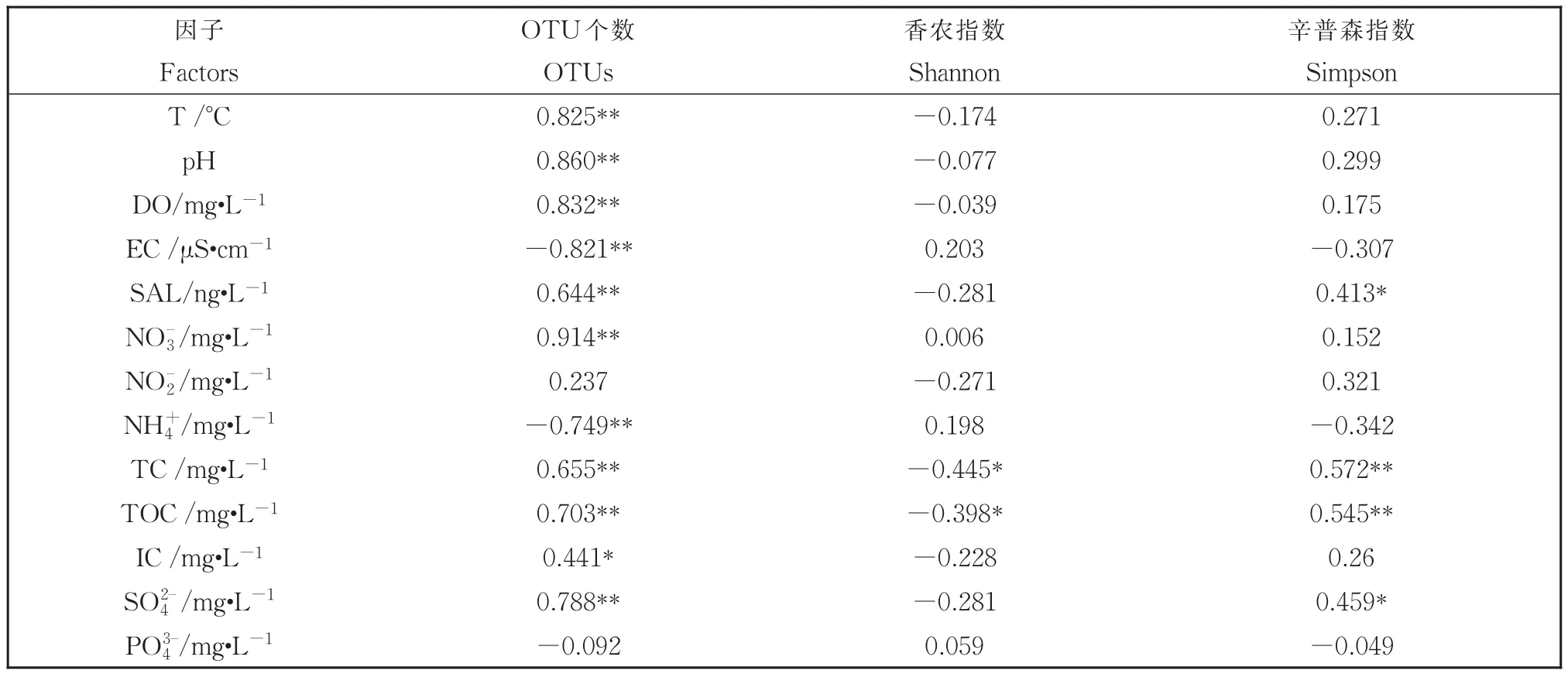
表2 细菌群落α多样性与水体理化参数的Spearman相关性分析Table 2 Spearman Correlation analysis of α-diversity of bacterial community and physicochemical parameters in Gonghai Lake
细菌群落β多样性在冰封期和消融期间变化显著。基于Bray-Curtis距离的PCoA分析结果显示,两个时期细菌群落明显分离(ANOSIM,R=0.986,P< 0.01),在冰封期不同采样点的群落更聚集(图6A)。RDA结果显示,细菌群落β多样性在2个时期的差异主要受水体T、DO、和TOC的显著影响(F=12.5,P< 0.01,图6B)。

图6 消融期和冰封期(A)在OTU水平基于Bray-Curtis距离的细菌群落PCoA排序图;(B)细菌群落与水体理化参数的RDA分析Fig.6 (A)PCoA ordination of bacterial community distribution pattern based on Bray-Curtis distance at OTU level;(B)RDA analysis of bacterial community and physical and chemical parameters of water in ice-free and ice-covered periods
2.4 不同时期细菌群落共现网络
细菌群落的共现网络图(图7)在冰封期共有93个节点,155条边,平均度为3.333,平均聚集系数为0.298,平均路径距离为3.671;在消融期节点数、边数和模块数均高于冰封期,共有188个节点和677条边,平均度为7.202,平均聚集系数为0.277,平均路径距离为4.049。冰封期正相关边数占82.581%,负相关边数占17.419%;消融期正相关边数占66.027%,负相关边数3占3.973%(表3)。两个时期不同属间主要为正相关关系,但由冰封期过渡到消融期正相关边数占比有所降低,负相关边数占比提升了将近16%。在冰封期多数节点隶属于变形菌门(37个),其次是拟杆菌门(16个)和放线菌门(14个);消融期多数节点隶属于变形菌门(77个),其次是拟杆菌门(28个)和放线菌门(23个)(图7)。

表3 消融期和冰封期细菌群落网络图属性Table 3 Network properties of bacterial community in ice-free and ice-covered periods
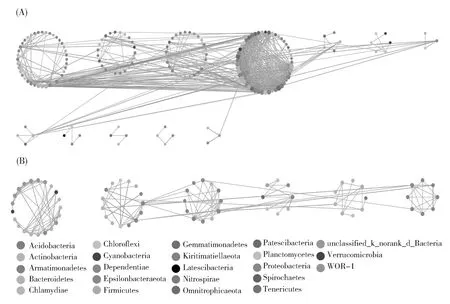
图7 (A)消融期和(B)冰封期细菌群落共现性网络Fig.7 Co-occurrence network of bacterial community in(A)ice-free period and(B)ice-covered periods
从冰封期到消融期,细菌群落的共现网络中出现了关键节点。在消融期共有3个关键节点分别是norank_f_Rhodocyclaceae、Sphingorhabdus和 氢 噬胞菌属(Hydrogenophaga),这三个细菌属均隶属于变形菌门,其中Sphingorhabdus和氢噬胞菌属为模块中心点,norank_f_Rhodocyclaceae为连接节点(图8)。
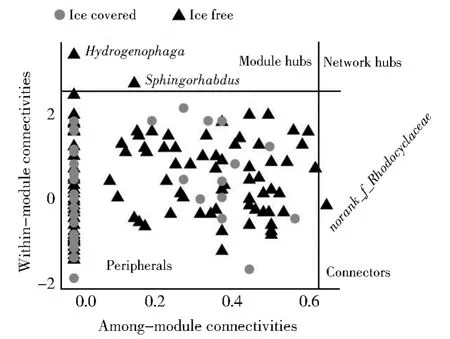
图8 消融期和冰封期细菌类群拓扑作用Fig.8 Topological roles of bacterial taxas in ice-free and ice-covered periods
3 讨论
3.1 季节性冻融对细菌群落的影响
微生物丰度和组成的变化往往是对气候变化和养分有效性的响应[19]。本研究表明,多数细菌的相对丰度在湖冰冻融过程中发生了显著变化,而这与水体的理化参数变化显著相关。季节性冻融主要由于温度变化所致。温度可以改变微生物的丰度和代谢活性,对细菌群落有选择作用,同时对微生物的季节动态演替也有很好的预测作用[20]。与多数研究结果一致,本研究中放线菌门、变形菌门、拟杆菌门为主要优势细菌门,在淡水中广泛分布。放线菌门的相对丰度在消融期显著高于冰封期,而拟杆菌门和疣微菌门的变化趋势则相反,在冰封期它们的相对丰度明显升高(图3)。放线菌多数是好氧菌,多分布在有机物丰富的地区,属于放线菌门的hgcI_clade属的丰度在消融期显著高于冰封期,其丰度变化和TOC浓度显著正相关。有研究发现hgcI_clade对含碳化合物的利用能力较强[21],因此有机物丰富且DO充足的消融期更适合放线菌的生长。拟杆菌自身对低温严寒有很好的适应性[22],所以能够在冰封期更好的生存,这与在土壤中观察到的现象一致[23]。疣微菌门广泛分布在各个生境中,在前期的研究中被证明更偏爱生活在寡营养环境中[24],它们和呈负相关关系(图4A),在冰封期的相对丰度显著高于消融期,归属于疣微菌门的属LD29被发现在冰封期的相对丰度显著高于消融期(图3B),冰封期冰盖减少了外部对水体的物质输送,湖泊中营养物质较消融期匮乏(表1),这一时期可能更适合寡营养生活史的疣微菌门。
消融期细菌群落的OTUs和Simpson指数显著高于冰封期,Shannon指数也高于冰封期,但未达显著水平(图5)。和已有的研究结果一致,冰封期细菌生物量通常较低[25],这可能是由于低温、营养物质再矿化减少和陆地有机物输入受限等因素所致[26-28]。季节性冻融导致的细菌群落结构发生变化主要受T、DO、和TOC的影响(图6)。许多研究已经证实了水温是影响水体中细菌群落结构的主要因素[29],而冰封期和消融期的温度差异显著(表1)。水温对细菌活性有直接影响,也可通过调节水体中各种生化反应、水体中的动植物等间接影响其结构和组成。冰封期由于冰层阻隔,冰下水体和外界发生物质交换减少,与消融期相比水体中DO、和TOC含量明显较少。溶解氧是冬季冰下微生物群落多样性的限制因子[3],在消融期水体中的溶解氧浓度升高,直接导致需氧细菌类群大量增殖。水体中的和TOC可以通过上行效应对细菌群落结构产生直接影响[30],同时也可以通过影响原生动物等对细菌有捕食作用的生物而对其造成间接影响[31]。
3.2 季节性冻融对细菌类群相互作用的影响
为了进一步研究冻融作用对山地湖泊细菌间相互作用的影响,构建了细菌群落共现网络图。整体拓扑特征表明,网络连通性曲线能较好地拟合幂率模型,R2分别为0.773和0.756,表明网络中只有少数节点有大量连接。消融期节点数和边数显著高于冰封期,说明消融期细菌类群间的相互作用更复杂(表3、图7)。微生物能对外界环境变化作出迅速反应,网络的平均路径长度越短,外界干扰越容易在更短的时间内波及整个网络[32-33]。在冰封期共现网络的平均路径短于消融期(3),说明在冰封期细菌群落受外部干扰的敏感性增加,而在消融期随着湖冰的融化,湖泊环境条件的改善(与外界物质交换不受限,溶解氧含量增加等),细菌群落对外部干扰的抵抗能力会增强。已有的研究表明,越复杂的生物网络往往对外界干扰的抵抗力更强,对信息和资源的传递也更加高效[34]。
共现网络可以代表生态系统中各种生物间的相互作用,如捕食、竞争和互惠共生,各种群通过相互作用连接在一起,任意两个节点之间的连线代表着微生物间的相互作用或者生态位共享。正相关关系被认为是不同物种间的合作和生态位重叠,而负相关关系是生态位分离、竞争等的结果[35]。虽然两个时期都是以正相关边数居多,但由冰封期过渡到消融期,正相关边数占比有所降低,负相关边数占比提升了将近16%(表3)。这表明虽然各个类群在冰封期和消融期都是以协同合作为主,但随着湖面冰层消失,细菌间竞争作用逐渐增强,这可能是由于养分的增多导致了细菌生物量的增加,从而加剧了彼此间的竞争作用[18]。也有研究指出,微生物间往往会形成共同协作的模式来共同抵御环境胁迫[36],这也为上述现象提供了合理的解释。微生物群落组成的变化往往可以通过微生物网络的模块变化来体现[37],消融期更多的模块数代表了更高的功能多样性(图7,表3)。冰封期节点最多的细菌属于变形菌门、拟杆菌门和放线菌门,消融期节点最多的细菌门和冰封期一致,而这些细菌类群在两个时期均为优势门,这表明在群落中相对丰度较高的物种具有较高的交互潜力。不同的节点可能在网络图中扮演不同的角色,根据Z-P图可以识别微生物网络中的关键物种。从冰封期到消融期,网络中关键节点增多。消融期共有3个关键节点(图8),由此可知,冰封作用导致了微生物网络中的关键物种的减少,使得细菌类群之间的相互作用发生了改变。
4 结论
本研究旨在探究细菌群落的组成和结构在冰封期和无冰期如何变化。冻融期间细菌优势类群的相对丰度受到冻融作用的影响发生了明显的改变,冰盖的形成抑制了一些细菌类群的生长,同时也促进了一些类群的生长,各细菌类群的相对丰度变化趋势不一。消融期细菌群落的α多样性显著高于冰封期,且两个时期的细菌群落结构也具有显著差异。季节性冻融显著改变了细菌各类群之间的相互作用,冰消融后细菌网络的复杂性增加,物种之间的竞争潜力提高,整个群落的抗干扰力增强。

