低氧胁迫对青海湖裸鲤肌肉线粒体呼吸链复合体酶及抗氧化酶活性的影响
陈付菊,付生云,令小东,常 兰,李雪源
低氧胁迫对青海湖裸鲤肌肉线粒体呼吸链复合体酶及抗氧化酶活性的影响
陈付菊1,付生云2,令小东1,常 兰1,李雪源1
(1. 青海大学农牧学院,青海 西宁 810016;2. 青海省裸鲤救助中心,青海 西宁 810003)
【】研究青海湖裸鲤在低氧胁迫下肌肉组织线粒体呼吸链复合体酶活性及抗氧化酶活性的变化规律,探讨其对低氧的应答机制。取体质量为(97.68 ± 0.12)g的青海湖裸鲤,分别于中、重度低氧[溶解氧分别为(3.0 ± 0.1)、(0.7 ± 0.1) mg/L] 条件下胁迫8、24 h,观察肌肉组织线粒体形态结构,检测线粒体呼吸链复合体Ⅰ-Ⅳ酶活性及抗氧化酶活性。1)重度低氧胁迫使肌肉组织线粒体长径较常氧对照组大(< 0.05),短径在胁迫8 h时显著增大(< 0.05),胁迫24 h与对照组无显著差异(> 0.05);部分线粒体嵴溶解,线粒体出现空泡化。中度低氧胁迫组长径和短径与常氧组无显著差异(> 0.05),未见空泡形成。2)线粒体呼吸链复合体Ⅰ和Ⅲ活性在重度低氧胁迫8 h时显著增加(< 0.05),24 h时降至常氧水平,二者在中度低氧胁迫24 h时显著增加(< 0.05);复合体Ⅱ在各组之间均无显著变化(> 0.05);复合体Ⅳ在重度低氧胁迫后与常氧组之间无显著差异,而在中度低氧胁迫24 h时显著增加(< 0.05)。3)过氧化氢(H2O2)含量在重度低氧胁迫8 h时显著增加(< 0.05),24 h时降至常氧水平,中度低氧胁迫24 h时与常氧组之间无显著差异(> 0.05);丙二醛(MDA)含量在重度和中度低氧胁迫后显著增加(< 0.05);超氧化物歧化酶(SOD)活性在重度低氧胁迫后与常氧组之间无显著差异,而在中度低氧胁迫24 h时显著增加(< 0.05);总抗氧化能力(T-AOC)和谷胱甘肽过氧化物酶(GPX)活性在重度和中度低氧胁迫后显著增加(< 0.05)。青海湖裸鲤肌肉组织对溶氧骤变产生应答反应,通过调整线粒体体积、形状结构、呼吸链复合体酶活性及相关抗氧化酶活性提高其低氧适应能力。
青海湖裸鲤;低氧胁迫;肌肉组织;线粒体呼吸链复合体活性;抗氧化酶活性
溶解氧(Dissolved oxygen, DO)是影响水生生物生理功能[1-3]的重要环境因素之一。溶解氧降低会使鱼类的抗氧化能力降低,防御功能失衡,导致鱼体氧化应激损伤[4]。大部分鱼类对水体溶解氧波动有一定适应能力,但如水体溶解氧水平长期处于较低水平,则造成鱼类生理功能紊乱及组织结构损伤,这与其体内活性氧自由基(Reactive oxygen species, ROS)过量产生相关[5]。
线粒体是ROS的重要来源[6],内有超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)等抗氧化酶类,这些酶在清除过量ROS的过程中发挥重要作用[7]。当线粒体受损伤时,线粒体呼吸链电子传递功能异常,使线粒体产生过量ROS[8],从而影响抗氧化系统与生物膜脂质过氧化,进而诱导机体组织结构氧化应激损伤[9-10]。
青海湖裸鲤()属鲤形目鲤科裸鲤鱼亚科裸鲤属,在海拔3 200 m环境中经历长期自然演化,有耐盐碱、耐寒等特点,对水体环境溶解氧适应范围为3.0 ~ 8.5 mg/L,对低氧适应性极强[11]。目前,已有青海湖裸鲤低氧适应特性[12-13]研究,但其耐低氧机制尚不清楚。青海湖裸鲤骨骼肌含有大量线粒体,在不同低氧环境下,其肌肉组织线粒体呼吸功能和抗氧化酶活性的变化尚不清楚。笔者研究青海湖裸鲤在低氧胁迫下肌肉组织线粒体呼吸链复合体及相关抗氧化酶活性的变化规律,探讨青海湖裸鲤对低氧的应答机制,为青海湖裸鲤种质资源保护提供参考。
1 材料与方法
1.1 材料
1.1.1 实验用鱼 青海湖裸鲤体质量(97.68±0.12)g,体长(24.11±0.12)cm,取自青海湖黑马河。将实验鱼暂养于3个500 L的塑料桶中,每日投喂人工配合饵料(青海湖裸鲤救助中心提供)1次,每日9:00、17:00分别用曝气自来水 [DO(8.4 ± 0.1)mg/L] 换水1/4。暂养期间,用空气泵连续增氧,将水体溶解氧维持在(8.4 ± 0.1)mg/L(自然水体中的溶解氧值,即常氧组),水温为(14.5 ± 0.7)℃,正式实验前1 d停饲。
1.1.2 主要试剂 H2O2测定试剂盒(A064-1)、丙二醛(MDA)测定试剂盒(A003-1)、SOD测定试剂盒(A001-3)、总抗氧化能力(T-AOC)测定试剂盒(A015-1-2)、GPX测定试剂盒(A005-1)和总蛋白测定试剂盒(A045-2)均购自南京建成生物工程研究所;组织线粒体分离试剂盒(C3606),线粒体呼吸链复合体Ⅰ(BC0510)、Ⅱ(BC3230)、Ⅲ(BC3240)、Ⅳ (BC0940),Bradford蛋白浓度测定试剂盒(P0006C)均购自北京索莱宝科技有限公司。
1.2 低氧胁迫处理
实验在9个顶部覆盖塑料膜的自制水族箱 (120 L)中进行。参考陈付菊等[13]方法,设置1个重度低氧胁迫组、1个中度低氧胁迫组和1个常氧组,每组3个平行组。每个低氧胁迫组随机放入暂养鱼15尾,每常氧组10尾。低氧胁迫开始前,用AZ8402溶解氧测定仪测定水体溶解氧为(8.4 ± 0.1)mg/L。实验时,通过往水族箱中注入氮气,通过调节氮气、空气的注入流量控制水体溶解氧水平,用AZ8402溶解氧测定仪定期监控水体中溶解氧变化。实验过程中,待重度、中度低氧胁迫组水体溶解氧1 h内分别降至(0.7 ± 0.1)、(3.0 ± 0.1)mg/L[13],维持24 h。常氧组溶解氧维持在(8.4 ± 0.1)mg/L。低氧胁迫期间水温为(14.5 ± 0.7)℃。
在重度低氧胁迫后的8 h和24 h及中度低氧胁迫后的24 h时将实验鱼用适量MS-222溶液麻醉,迅速剖取脊柱两侧的肌肉组织,提取线粒体用于测定线粒体呼吸链复合体活性(8尾/组);取脊柱左侧的肌肉组织并用体积分数2.5%戊二醛固定,用于肌肉组织线粒体超微结构的观察(4尾/组);取脊柱右侧的肌肉组织经液氮处理后置于-80℃下保存,用于测定肌肉组织中SOD、GPX、T-AOC活性和H2O2、MDA含量(8尾/组)。根据预实验结果,中度低氧胁迫8 h时复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ及各酶活性与中度低氧24 h时无显著差异,故在正式实验时未检测中度低氧胁迫8 h时的各项指标。
1.3 线粒体超微结构观察及线粒体直径测量
参考陈付菊等[13]方法,肌肉组织用体积分数2.5%戊二醛固定24 h,用0.1 mol/L磷酸盐缓冲液(pH 7.4)漂洗3次,每次5 min。用0.01 g/mL四氧化锇于4℃下固定1 h,用双蒸水漂洗3次,分别用体积分数为50%、70%、90%、100%的乙醇脱水两次,每次10 min。经环氧丙烷过渡、树脂梯度渗透后包埋,60 ℃下聚合,包埋块用Leica UC7型超薄切片机进行半薄定位及超薄切片,经醋酸双氧铀和柠檬酸铅双染色,切片,用透射电镜观察组织超微结构,拍照。
所得照片中线粒体长径和短径用软件Imager proplus 6.0测量,随机取6组测量数据,取平均值。
1.4 组织匀浆液制备及酶活性测定
称取适量-80℃下保存的肌肉组织在冰上解冻,按照质量 (g)、体积(mL)比1∶9向样品中加入预冷的生理盐水,在冰上匀浆。将匀浆液在4℃、2 500 r/min条件下离心10 min,取上清液,检测样品总蛋白浓度,-80℃下保存备用。
样品总蛋白浓度、SOD、T-AOC、GPX活性及MDA、H2O2含量的测定均按试剂盒说明书进行。
1.5 线粒体提取及呼吸链复合体酶活性的测定
参考陈付菊等[13]方法,取新鲜肌肉组织约90 mg,于预冷离心管中剪碎,加入900 μL预冷的分离液A,用预冷的玻璃匀浆器手动上下匀浆10次,在4 ℃、600 r/min条件下离心5 min,取上清液,在4 ℃、11 000 r/min条件下离心10 min,小心弃去上清液,加入预冷的线粒体储存液,混匀,用詹纳斯绿B检测线粒体活性,并测定蛋白浓度。
线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性的测定按试剂盒说明书进行。复合体Ⅰ活性以每毫克组织蛋白每分钟消耗烟酰胺腺嘌呤二核苷酸 (NADH)的量 (μmol) 表示,复合体Ⅱ活性以每毫克组织蛋白每分钟消耗2,6-二氯吲哚酚的量 (μmol) 表示,复合体Ⅲ活性以每毫克组织蛋白每分钟消耗还原型泛醌的量 (μmol) 表示,复合体Ⅳ活性以每毫克组织蛋白每分钟消耗还原型细胞色素C的量(μmol)表示。
1.6 统计分析
数据用平均值±标准误表示,用SPSS 17.0对数据进行单因素方差分析(one-way ANOVA),不同处理组数据进行Duncan多重比较,=0.05。
2 结果
2.1 青海湖裸鲤肌肉组织线粒体超微结构
透射电镜观察发现,青海湖裸鲤常氧组肌肉组织线粒体多呈圆形和椭圆形,线粒体嵴密集,线粒体膜完整(图1(A));重度低氧胁迫8 h和24 h时,线粒体多呈圆形和椭圆形,体积增大,线粒体嵴疏松溶解,有空泡形成(图1(B、C));中度低氧胁迫24 h时,线粒体形态结构正常,线粒体嵴密集,未见空泡形成(图1(D))。

A. 常氧组;B. 重度低氧8 h组;C. 重度低氧24 h组;D. 中度低氧24 h组。M,线粒体
重度低氧胁迫8 h时,肌肉组织线粒体长径和短径显著大于常氧组(< 0.05);重度低氧胁迫24 h时,肌肉组织线粒体长径显著大于常氧组(< 0.05),而重度低氧胁迫24 h时,肌肉组织线粒体短径与常氧组差异不显著(> 0.05);中度低氧胁迫24 h时,肌肉组织线粒体长径和短径与常氧组差异不显著(> 0.05)(表1)。
2.2 青海湖裸鲤肌肉线粒体呼吸链复合体活性
肌肉组织线粒体呼吸链复合体Ⅰ的活性在重度低氧胁迫8 h时显著升高(< 0.05),24 h时降至常氧水平(> 0.05);中度低氧胁迫24 h时复合体Ⅰ的活性显著高于常氧组(< 0.05)(图2(A))。复合体Ⅱ活性在低氧胁迫后与常氧组间差异不显著(> 0.05)(图2(B))。复合体Ⅲ活性在重度低氧胁迫8 h时显著升高(< 0.05);重度低氧胁迫24 h时较8 h时显著降低(< 0.05),与常氧组间差异不显著(> 0.05);中度低氧胁迫24 h时活性显著高于常氧组(<0.05)(图2(C))。复合体Ⅳ活性在重度低氧胁迫后与常氧组间差异不显著(> 0.05);中度低氧胁迫24 h时其活性显著高于常氧组(< 0.05)(图2(D))。
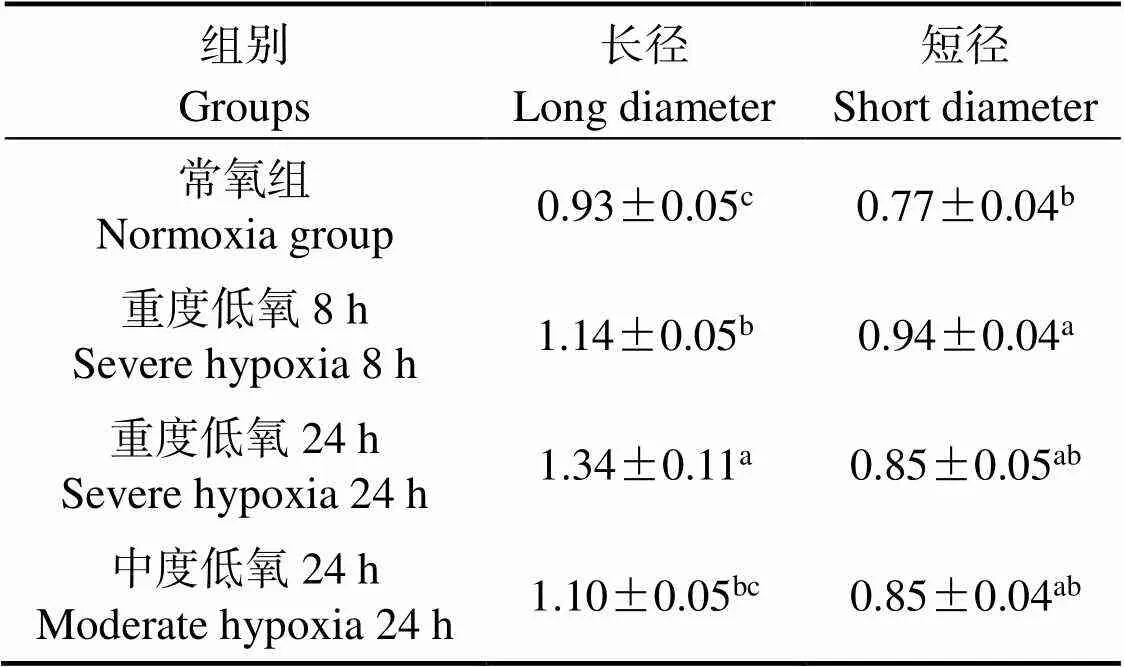
表1 青海湖裸鲤肌肉组织线粒体长径、短径
注:同列数据凡含一个相同字母则组间差异不显著(> 0.05)。
Note: A same letter in a column indicate no significant difference (> 0.05) between different groups.
2.3 青海湖裸鲤肌肉酶活性
肌肉组织H2O2含量在重度低氧胁迫8 h时较常氧组显著增加(< 0.05),重度低氧胁迫24 h时较8 h时显著降低(< 0.05),与常氧组间差异不显著(> 0.05);中度低氧胁迫24 h时H2O2含量有升高趋势,但与常氧组间差异不显著(> 0.05)(图3(A))。MDA含量在重度低氧胁迫8 h时较常氧组显著增加(< 0.05),重度低氧胁迫24 h时增至最大(< 0.05);中度低氧胁迫24 h时显著高于常氧组(< 0.05)(图3(B))。SOD活性在重度低氧胁迫8、24 h时有增大趋势,但与常氧组间差异不显著(> 0.05);中度低氧胁迫24 h时显著高于常氧组(< 0.05)(图3(C))。T-AOC在重度低氧胁迫组均显著增加(< 0.05),胁迫8 h时最大,胁迫24 h时次之(< 0.05);中度低氧胁迫24 h时显著高于常氧组(< 0.05)(图3(D))。GPX活性在重度低氧胁迫组均显著增加,胁迫8 h时最大(< 0.05),24 h时次之(< 0.05);中度低氧胁迫24 h组显著高于重度胁迫24 h组及常氧组(< 0.05)(图3(E))。

凡含一个相同字母则组间差异不显著(P > 0.05)。N示常氧;S8和S24分别示重度低氧胁迫8 h和24 h;M24示中度低氧胁迫24 h。
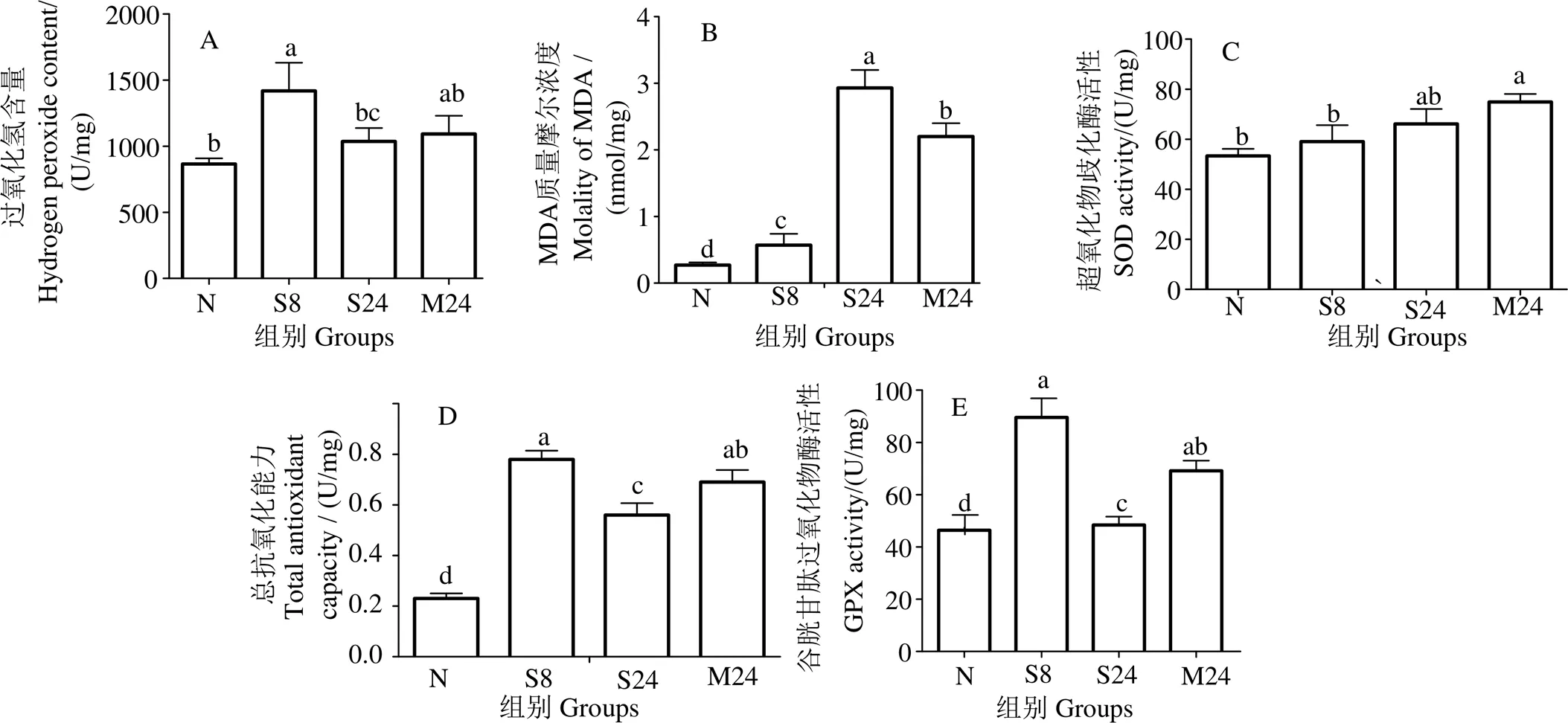
凡含一个相同字母则组间差异不显著(P > 0.05)。N示常氧;S8和S24分别示重度低氧胁迫8 h和24 h;M24示中度低氧胁迫24 h。
3 讨论
3.1 低氧胁迫对青海湖裸鲤肌肉线粒体结构和呼吸功能的影响
线粒体为氧浓度感受器,其形态结构和呼吸功能变化在细胞应对缺氧的反应中起关键作用,低氧可导致线粒体结构损伤和功能障碍。研究表明,对于青海湖裸鲤,中度低氧胁迫未损伤体肾[12]、肝组织[13]结构,重度低氧胁迫未损伤体肾线粒体结构[12],但导致肝线粒体结构损伤[13],表明青海湖裸鲤面临低氧胁迫时,其体内不同组织由于其结构与功能的不同而产生的应激及抗应激反应不同。魏琳等[14]研究发现,低氧可导致凡纳滨对虾()线粒体结构肿胀变性、内嵴溶解、空泡化。本研究中,中度低氧胁迫24 h时仅见部分肌肉线粒体轻度肿胀,其长径和短径与常氧组差异不显著;但重度低氧胁迫后肌肉线粒体长径和短径增大,线粒体嵴疏松溶解,有空泡形成,表明中度低氧胁迫对肌肉线粒体体积、形状结构无显著影响,但重度低氧胁迫后线粒体体积和形状结构发生适应性调整。推测重度低氧胁迫后肌肉组织通过增大线粒体体积来适应外界水环境中DO水平的降低。
线粒体最重要功能是通过氧化磷酸化合成ATP,维持机体能量代谢。线粒体形状结构改变以及线粒体呼吸链复合体酶活性下降均引起线粒体氧化磷酸化功能下降,从而影响ATP合成[15]。陈世喜等[16]认为,低氧胁迫后,水体中DO水平降低将导致有氧呼吸水平下降,为提高供氧组织对氧的摄取,鱼类线粒体呼吸功能适应性增强。本研究中,中度低氧胁迫24 h时青海湖裸鲤肌肉线粒体呼吸链复合体Ⅰ、Ⅲ、Ⅳ的酶活性均有所升高,说明中度低氧胁迫可提高裸鲤肌肉线粒体呼吸链复合体酶活性,从而增强线粒体呼吸功能;重度低氧胁迫8 h时,肌肉组织线粒体呼吸链酶复合体Ⅰ和Ⅲ活性升高,而重度低氧胁迫24 h时活性恢复至常氧水平,这与急性缺氧导致大鼠肝脏线粒体呼吸链酶活性降低的结果不一致[17]。推测重度低氧胁迫8 h时,肌肉组织通过增大线粒体体积和升高线粒体呼吸链酶复合体Ⅰ和Ⅲ活性,增强线粒体呼吸功能应激性而适应低DO环境,随着重度低氧胁迫时间的延长,线粒体呼吸功能恢复至常氧水平。
3.2 低氧胁迫对青海湖裸鲤肌肉组织氧化和抗氧化水平的影响
缺氧等多种外界因素会诱导体内ROS累积而造成组织氧化应激损伤,故线粒体内ROS含量变化可间接反映细胞内氧化应激水平,但因ROS寿命短,通常通过检测H2O2含量来间接反映细胞内ROS水平[18]。本研究中,肌肉组织内H2O2含量在重度低氧胁迫8 h时显著增加,重度和中度低氧胁迫24时与常氧组无显著差异,这与王维政等[19]对军曹鱼()幼鱼肌肉的研究结果一致。表明水体中DO骤然降低引起青海湖裸鲤肌肉组织氧化应激,从而使肌肉组织内ROS增加,但裸鲤通过自身调节可在低氧胁迫24 h内使肌肉ROS恢复至常氧水平。
MDA是ROS攻击生物膜发生脂质过氧化的产物,其含量变化可间接反映机体脂质过氧化程度[20]。本研究中,低氧胁迫使青海湖裸鲤肌肉组织内MDA含量增加,这与常志成等[21]对花鲈()幼鱼肌肉的研究结果一致。可见,在低氧胁迫过程中,青海湖裸鲤肌肉组织内ROS应激性增加,从而使MDA含量升高。
ROS累积易造成组织氧化应激损伤,但鱼体内存在SOD、GPX等可清除过量ROS的抗氧化酶,进而提高鱼体的总抗氧化水平,从而保护细胞免受ROS损伤[22]。因此,检测抗氧化酶活性可间接反映机体的抗氧化水平。孙俊霄等[23]对杂交黄颡鱼(♀×♂)的研究结果显示,低氧胁迫6 h时肝脏组织T-AOC升高,12 h时增至最大,24 h降至常氧水平。本研究中,肌肉组织内T-AOC在重度低氧胁迫8 h时显著增加,24 h时较8 h时显著降低,但仍高于常氧水平,中度低氧胁迫24 h时显著增加,这与孙俊霄等[23]的结果不一致,可能与不同鱼类对低氧响应的时间不一致有关。王维政等[19]研究显示,军曹鱼幼鱼肌肉组织GPX活性在低氧1 d时显著升高,4 ~ 7 d时呈逐渐下降趋势。本研究中,肌肉组织内GPX活性在重度低氧胁迫8 h时显著增加,24 h显著降低,但仍高于常氧水平,这与王维政等的变化趋势相似。可见,在重度低氧胁迫初期,由于青海湖裸鲤肌肉组织内ROS应激性增加,T-AOC和GPX活性随之增强,以清除应激性增加的ROS,从而使肌肉组织免受ROS的氧化应激损伤,随着低氧胁迫时间的延长,大量ROS被清除,T-AOC能力和GPX活性适应性降低。陈世喜等[16]研究发现,卵形鲳鲹()幼鱼肝组织SOD活性在急性低氧胁迫初期增大,后逐渐降至正常水平。本研究中,重度低氧胁迫后肌肉组织SOD活性与常氧组差异不显著,但中度低氧胁迫后SOD活性增加,这与陈世喜等[16]的结果不同,也与对青海湖裸鲤体肾[12]的研究结果不同,可能与不同鱼类,甚至同一鱼类不同器官中SOD的响应模式不同有关。
4 结论
青海湖裸鲤肌肉组织对DO骤变产生应答反应机制,通过调整线粒体体积、形状结构、呼吸链复合体酶活性及相关抗氧化酶活性提高其低氧适应能力。
[1] MAGNONI L J, EDING E, LEGUEN I, et al. Hypoxia, but not an electrolyte-imbalanced diet, reduces feed intake, growth and oxygen consumption in rainbow trout ()[J]. Scientific Reports, 2018, 8(1): 4965.
[2] LAI K P, WANG S Y, LI J W, et al. Hypoxia causes transgenerational impairment of ovarian development and hatching success in fish[J]. Environmental Science & Technology, 2019, 53(7): 3917-3928.
[3] 郭志雄, 曾泽乾, 黄建盛, 等. 急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学学报, 2020, 40(3): 134-140.
[4] RICHARDS J G. Physiological and biochemical adaptations of intertidal fishes to hypoxia[J]. Journal of Experimental Biology, 2011, 214(2): 191-199.
[5] CADENAS S. Mitochondrial uncoupling, ROS generation and cardioprotection[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2018, 1859(9): 940-950.
[6] DAN DJ, ALVAREZ LA, ZHANG X,et al. Reactive oxygen species and mitochondria: A nexus of cellular homeostasis[J]. Redox Biology, 2015, 6: 472-485.
.[7] SINHA N, DABLA P K. Oxidative stress and antioxidants in hypertension-a current review[J]. Current Hypertension Reviews, 2015, 11(2): 132-142.
[8] ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiological Reviews, 2014, 94(3): 909-950.
[9] DI MEO S, REED T T, VENDITTI P, et al. Role of ROS and RNS sources in physiological and pathological conditions[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 1245049.
[10] DIAZ J M, PLUMMER S. Production of extracellular reactive oxygen species by phytoplankton: past and future directions[J]. Journal of Plankton Research, 2018, 40(6): 655-666.
[11] MATEY V, RICHARDS J G, WANG Y X, et al. The effect of hypoxia on gill morphology and ionoregulatory status in the Lake Qinghai scaleless carp,[J]. The Journal of Experimental Biology, 2008, 211(Pt 7): 1063-1074.
[12] 陈付菊, 赵宇田, 付生云, 等. 溶解氧水平对青海湖裸鲤体肾组织结构及抗氧化酶活性的影响[J/OL]. 水生生物学报:1-12 [2021-10-26]. http://kns.cnki.net/kcms/detail/ 42.1230.Q.20210429.1329.002.html.
[13] 陈付菊, 多杰当智, 付生云, 等. 不同溶解氧水平对青海湖裸鲤肝组织结构及抗氧化酶活性的影响[J]. 淡水渔业, 2021, 51(5): 13-20.
[14] 魏琳, 邱立国, 李玉虎, 等. 低氧胁迫下不同品种凡纳滨对虾线粒体超微结构的比较[J]. 热带生物学报, 2016, 7(1): 17-22.
[15] RASMUSSEN U F, KRUSTRUP P, BANGSBO J, et al. The effect of high-intensity exhaustive exercise studied in isolated mitochondria from human skeletal muscle[J]. Pflügers Archiv, 2001, 443(2): 180-187.
[16] 陈世喜, 王鹏飞, 区又君, 等. 急性和慢性低氧胁迫对卵形鲳鲹幼鱼肝组织损伤和抗氧化的影响[J]. 动物学杂志, 2016, 51(6): 1049-1058.
[17] 徐文, 罗芳, 周林, 等. CLA对急性缺氧大鼠肝脏线粒体呼吸链酶活性及氧化应激的影响[J]. 现代生物医学进展, 2010, 10(24): 4630-4633.
[18] 杨明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响[J]. 中国水产科学, 2019, 26(3): 493-503.
[19] 王维政, 曾泽乾, 黄建盛, 等. 低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响 [J]. 广东海洋大学学报, 2020, 40(5): 12-18.
[20]SHEN Z B, YIN Y Q, TANG C P, et al. Pharmacodynamic screening and simulation study of anti-hypoxia active fraction of Xiangdan injection[J]. Journal of Ethnopharmacology, 2010, 127(1): 103-107.
[21] 常志成, 温海深, 张美昭, 等. 溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制[J]. 中国海洋大学学报(自然科学版), 2018, 48(7): 20-28.
[22]SNEZHKINA A V, KUDRYAVTSEVA A V, KARDYMON O L, et al. ROS generation and antioxidant defense systems in normal and malignant cells[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 1-17.
[23] 孙俊霄, 韩广坤, 刘娅, 等. 杂交黄颡鱼与普通黄颡鱼幼鱼生长性能及耐低氧能力的比较[J]. 水生生物学报, 2019, 43(6): 1271-1279.
Effects of Hypoxia Stress on Activities of Mitochondrial Respiratory Chain Complexes and Antioxidant Enzyme in Muscle of Lake Qinghai Scaleless Carp
CHEN Fu-ju1, FU Sheng-yun2, LING Xiao-dong1, CHANG Lan1, LI Xue-yuan1
(1.,,810016,; 2.,810003,)
【】To investigate the change in activities of mitochondrial respiratory chain complexes and antioxidant enzymes in the muscle of the Lake Qinghaiscaleless carpunder hypoxia stress, and explore theirresponse to the stress【】, with an average weight of (97.68 ± 0.12) g, were exposed toDO conditions of (3.0 ± 0.1), (0.7 ± 0.1), and (8.4 ± 0.1) mg/L (the control), respectively. After hypoxia for 8 h and 24 h, the morphology and mitochondria of the muscle were observed, and the relative enzyme activities of mitochondrial respiratory chain complexes Ⅰ–Ⅳ and the activity of the antioxidant enzymes were determined. 【】(1) The long diameters of mitochondrial increased significantly under severe hypoxia (< 0.05). However, the short diameters of mitochondrial increased significantly at 8 h of severe hypoxia (< 0.05). Furthermore, there is no change at 24 h of severe hypoxia and the mitochondrial cristae partially dissolved, and some mitochondria showed vacuolization under severe hypoxia.In addition, there is no significant difference in the long and short diameters of mitochondrial (> 0.05), and there is no vacuoles were seen under moderate hypoxia. (2) The activities of mitochondrial respiratory chain complexes Ⅰ and Ⅲ increased significantly at 8 h (< 0.05) and decreased to normoxia at 24 h under severe hypoxia. However, the activities of complexes Ⅰ and Ⅲ increased significantly at 24 h of moderate hypoxia stress (< 0.05). There is no significant change of respiratory chain complex Ⅱ in above groups (> 0.05). The activities of complexes IV remained unchanged under severe hypoxia, but the activities of complexes IV increased under moderate hypoxia (< 0.05). (3) The concentration of hydrogen peroxide (H2O2) increased significantly at 8 h (< 0.05) and decreased to normoxia at 24 h of severe hypoxia stress. However, there is no significant change in the content of H2O2at 24 h of moderate hypoxia stress (> 0.05). The malondialdehyde (MDA) content markedly increased under severe and moderate hypoxia (< 0.05). The activity of superoxide dismutase (SOD) remained unchanged under severe hypoxia, but the activity of SOD significantly increased at 24 h of moderate hypoxia stress (< 0.05). The concentrations of total antioxidant capacity (T-AOC) and glutathione peroxidase (GPX) markedly increased under severe and moderate hypoxia stress (< 0.05). 【】responds to different oxygen content through the changes of volume, shape and structure of mitochondria, and the activities of mitochondrial respiratory chain complexes and the antioxidant enzymes in order toimprove the ability of hypoxia adaption.
; hypoxia stress; muscle tissue; mitochondrial respiratory chain complexes activity; antioxidant enzyme activity
S917
A
1673-9159(2021)06-0118-07
10.3969/j.issn.1673-9159.2021.06.014
陈付菊,付生云,令小东,等. 低氧胁迫对青海湖裸鲤肌肉线粒体呼吸链复合体酶及抗氧化酶活性的影响[J]. 广东海洋大学学报,2021,41(6):118-124.
2021-06-21
青海省科技厅应用基础研究项目(2018-ZJ-729)
陈付菊(1979―),女,博士研究生,副教授,主要研究方向为高原土著动物低氧适应机制研究。E-mail:chenfuju79@126.com
(责任编辑:刘庆颖)

