林蛙卵蛋白的功能特性及组分鉴定
张 叶,赵昌辉,张铁华
(吉林大学食品科学与工程学院,吉林长春130000)
0 引言
中国林蛙,俗名又称蛤士蟆、雪蛤,主要分布在我国东北地区和中原地区,是一种珍贵的药食兼用的经济型动物[1]。林蛙通常在2月份进入繁殖期,从繁殖期的雌蛙体内取出的输卵管即为林蛙油,而林蛙卵就是剥离输卵管后剩余的副产物[2]。据统计,每只林蛙一年最多可产1 200~1 300颗卵。在每年林蛙的人工养殖场地中,林蛙卵的产量约为林蛙油的8倍。经研究发现,林蛙卵的营养价值并不低,甚至可能高于目前被市场广泛认可的林蛙油。林蛙卵中含有种类丰富的蛋白质,以及不饱和脂肪酸、多种人体必需氨基酸、维生素和雌激素等营养物质[3],具有极大的开发潜力。林蛙卵中蛋白含量多且种类丰富,约占卵总组分的16.8%,王宇等人[4]采用高效液相色谱技术和氨基酸分析仪测定表明,卵蛋白中包含人体营养需要的9种必需氨基酸,其中天冬氨酸和谷氨酸含量最高。陶凤云等人[5]利用有机溶剂分级沉淀加多种色谱技术的方法分离得到一种蛋白质,具有RNA酶活性。这种具有RNA酶活性的林蛙卵蛋白可有效抑制癌细胞生长[6]。张肃等人[7]得出了林蛙卵蛋白对抗疲劳有积极作用的结论。这些研究证实了林蛙卵蛋白的生理活性但没有测定过它的基础功能特性和蛋白组成。
蛋白的功能特性是指其在食品加工过程及运输贮藏条件下在食品体系中起到的特殊作用,物理、化学等多方面作用及共同作用都包含其中。林蛙卵中的蛋白含量高表明其在食品工业中有很大的应用潜力。对林蛙卵蛋白的基本功能特性(如溶解性、持水性、凝胶性、起泡性、乳化性等性质)要有深入的了解,才能根据其功能特点决定在食品配方中的具体用途[8],从而提升林蛙卵蛋白在食品工业中的应用价值。
1 材料及方法
1.1 材料
林蛙干卵,吉林通化康元生物公司提供;正己烷、氢氧化钠、盐酸均为食品级,北京化工厂提供。
1.2 仪器与设备
XMTD-8222型电热恒温水浴锅,北京长源实验设备厂产品;ML204TS型电子分析天平,德国IKAC公司产品;IKAC-HS7型磁力加热搅拌器,德国IKAC公司产品;AVANTIJ-E型高速离心机,美国贝克曼公司产品;PHS-3c型雷磁pH计,中国上海精科仪器有限公司产品;Alphal-2型冷冻干燥机,德国Martin Christ公司产品;SyergyhtHT型酶标仪,美国Biotek公司产品。
1.3 试验方法
1.3.1 林蛙卵蛋白的提取
林蛙卵的蛋白提取参考金红等人[9]、李知兴等人[10]的方法并加以改动。取适量林蛙卵于40℃烘箱中烘干2 h,取出后放入自封袋于干燥器中储存备用。以正己烷作为提取剂对蛙卵进行浸提脱脂,在料液比1∶8(g∶mL),温度40℃的条件下恒温振荡4 h,然后以转速3 000 r/min离心20 min,弃去提取液,反复浸提3次。在通风橱内挥发掉残余有机溶剂,然后将脱脂后的蛙卵经烘干粉碎成脱脂林蛙卵粉。
取脱脂后的蛙卵用粉碎机粉碎,过60目筛,得到林蛙卵粉放入自封袋后于干燥器中储存备用。采用碱溶酸沉法提取林蛙卵蛋白。取一定量脱脂林蛙卵粉与水按1∶10(g∶mL)混合,搅拌30 min使其充分溶胀,用1 mol/L NaOH调pH值至11.0,50℃下恒温水浴搅拌90 min后,以转速5 000 r/min离心20 min,收集上清液。沉淀按原料液比再提取2次,合并3次上清液,用1 mol/L HCl调节pH值至4.5,4℃下静置12 h后以转速8 000 r/min离心20 min,收集沉淀。沉淀加水调pH值至7.0,然后搅拌使沉淀复溶。冷冻干燥得林蛙卵蛋白粉。
1.3.2 林蛙卵蛋白的溶解性
林蛙卵蛋白的溶解度用氮溶解指数NSI来表示。蛋白浓度通过BCA快速测定试剂盒来完成,然后计算氮溶解指数。加好样品的96孔板迅速放到37℃恒温培养箱中保温30 min,显色结束后迅速于波长562 nm处测定吸光度。另取样品液在4℃条件下以转速10 000 r/min离心15 min,离心后的上清液按照同样步骤操作,控制温度和时间条件与之前一致,测定其在波长562 nm处的吸光度。每个样品做3次平行。根据BSA标准品绘制的标准曲线Y=1.168 1X+0.128 2,R2=0.998 4计算样品中的蛋白含量,溶解性(NSI)计算公式如下:

1.3.3 林蛙卵蛋白的持水性
林蛙卵蛋白的持水性测定根据Qin X S等人[11]的方法并稍作修改。准确称取1 g林蛙卵蛋白样品(A1)于50 mL离心管中,缓慢加入蒸馏水,边加水边搅拌,直到样品变成轻微流动性的糊状,但不到能溶解的程度,然后将玻璃棒上的残留洗到离心管中,随后将蛋白糊在恒定温度下保温30 min,静置结束后室温条件下以转速3 200 r/min离心5 min,缓缓倾斜离心管,使其中的多余水分流出,用滤纸吸取壁上残留的水分然后称取蛋白糊质量A2,根据公式(2)计算蛋白持水性,每个样品做3次平行。

1.3.4 林蛙卵蛋白的起泡性
林蛙卵蛋白的起泡性测定参考Kuan Y H等人[12]的方法并适当修改。
(1)起泡性。配制1%质量分数的蛋白样品,调pH值,磁力搅拌30 min使之充分溶解后转移到100 mL容量大小的量筒中并记录初始体积V1,随后以转速10 000 r/min在高速剪切机下固定量筒作用2 min,记录剪切作用结束时的溶液体积V2。每个样品做3次平行。林蛙卵蛋白的起泡能力和起泡稳定性用以下公式计算:
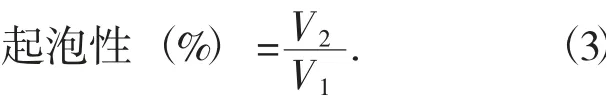
式中:V1——样品初始体积,mL;
V2——均质刚结束时的液体体积,mL。
(2)起泡稳定性。将上述高速剪切结束后的样品静置30 min,然后再记录此时的液体体积V3,用公式(4)计算其起泡稳定性:

式中:V3——样品高速剪切结束30 min后的液体体积,mL。
1.3.5林蛙卵蛋白的乳化性
林蛙卵蛋白的乳化性测定根据Haiying Chen等人[13]的方法并稍作改动。分别配制蛋白质量分数为0.1%,0.2%,0.3%,0.4%,0.5%(W/V)的样品,调pH值至9。然后在9 mL蛋白溶液样品中加入3 mL新鲜购买的葵花籽油,以转速10 000 r/min在高速剪切机下固定量筒作用1 min。作用结束后迅速吸取20 μL溶液与5 mL 0.1%(W/V)的SDS溶液摇晃均匀,然后立即于波长500 nm处测定吸光值(A0),不加样品的0.1% SDS溶液是试验的空白对照;经过剪切作用后的蛋白样品要静置10 min后再次取下清液,并按上述步骤测定吸光值(A1)。林蛙卵蛋白的乳化活力和乳化稳定性分别用乳化活性指数(EAI)和乳化稳定性指数(ESI)来表示,它们的计算公式如下:

式中:D——稀释倍数,D=250;
C——蛋白质浓度,mol/mL;
Φ——油相所占的比例,Φ=1/4;
L——比色皿的厚度,L=1 cm;
Δt=10 min。
1.3.6 林蛙卵蛋白的蛋白组分鉴定
蛋白酶解:取100 μg蛋白使用FASP法进行蛋白质酶解,具体步骤如下:
(1)加入浓度为8 mol/L的Urea将体积补足至200 μL;
(2)向溶液中加入DTT试剂,使它的终浓度为10 mmol/L,然后在56℃水浴下反应30 min;
(3)在向溶液中加入IAA试剂,使它的终浓度为50 mmol/L,室温下用锡纸包裹严密,避光反应40 min;
(4)将反应结束的样品转移至10 K的超滤管中,室温条件下以转速12 000 r/min离心5 min,弃掉滤液;
(5)在滤管中加入8 mol/L的Urea 400 μL,室温下以转速12 000 r/min离心5 min,再弃掉滤液,该步骤重复3次;
(6)向滤管中再次加入50 mmol/L的TEAB溶液200 μL,室温下以转速12 000 r/min离心5 min,弃掉滤液,再重复3次;
(7)然后样品∶酶=50∶1的质量比在超滤管中加入胰蛋白酶,在37℃水浴条件下恒温酶解16 h;酶解结束后,4℃条件下以转速12 000 r/min离心10 min,收集滤液,冻干得到可用于色谱的样品。
采用超高分辨率质谱仪对分级得到的样品进行数据采集。
1.3.7 数据分析
所有试验均做3次重复。采用SPSS 21.0进行显著性分析。通过单因素方差分析来比较差异性(p<0.05),根据方差齐性检验结果选择LSD和Dunnet'C法进行多重比较。试验的所有数据图均使用Origin 9.1软件绘制。
2 结果与分析
2.1 林蛙卵蛋白的溶解性分析
pH值和温度对林蛙卵蛋白溶解性的影响见图1。
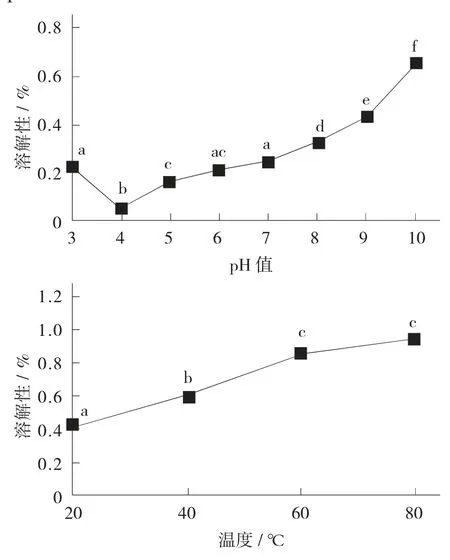
图1 pH值和温度对林蛙卵蛋白溶解性的影响
在温度一定的条件下,林蛙卵蛋白的溶解性在pH值为4时处达到最低值,推测此处为林蛙卵蛋白的等电点附近,净电荷值约为0。在远离pH值4的酸碱环境下,林蛙卵蛋白的溶解性有所上升,但未达到80%。pH值条件恒定时,改变环境温度,发现林蛙卵蛋白在20~80℃范围内随温度升高而呈上升趋势,80℃条件下氮溶解指数接近100%。
2.2 林蛙卵蛋白的持水性分析
温度和pH值对林蛙卵蛋白持水性的影响见图2。

图2 温度和pH值对林蛙卵蛋白持水性的影响
在pH值11,反应时间30 min的条件下,林蛙卵蛋白的持水性在30~60℃内先上升后下降并趋于平缓。当温度在30~40℃时,林蛙卵蛋白的持水性随着温度的升高而增大,在40℃时,持水性最佳达到5.93 g/g;继续升高温度时,蛋白质分子三级结构可能发生变化,锁住水分子的能力减弱,溶解性上升,因此持水性表现为下降[14]。在室温,反应时间30 min的条件下,卵蛋白持水性在pH值3~11的范围内呈现先下降后上升的趋势。当pH值在等电点(pH值4.5)附近时,蛋白质分子本身呈现电中性,蛋白质分子间相互缔合收缩,持水性最低为5.576 g/g。
2.3 林蛙卵蛋白的起泡性分析
pH值对林蛙卵蛋白起泡性的影响见图3。
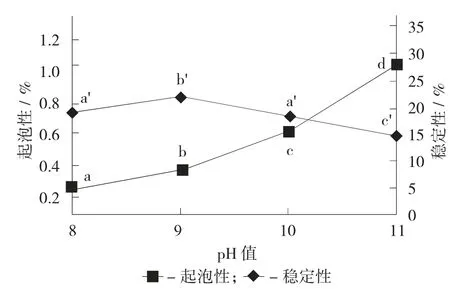
图3 pH值对林蛙卵蛋白起泡性的影响
在蛋白质量分数1%的条件下,林蛙卵蛋白的起泡性在pH值8~11范围内呈增强的趋势,原因可能是随着越来越接近蛋白的最适溶解pH值,参与搅打成膜的蛋白质分子增多,更多的蛋白分子吸附到气-液界面,而蛋白质分子间也更易相互结合,从而形成更多的泡沫。而蛋白的起泡稳定性较差可能与样品整体溶解度较低有关[15]。
2.4 林蛙卵蛋白的乳化性分析
蛋白质量浓度对林蛙卵蛋白乳化性的影响见图4。

图4 蛋白质量浓度对林蛙卵蛋白乳化性的影响
在室温、pH值11的条件下,在0.1%~0.5%范围内,林蛙卵蛋白的EAI值随质量浓度升高而减小,与扁桃仁蛋白[16]具有类似的乳化特性。这可能是由于在较低的蛋白浓度下,分子扩散系数较大,有利于新液滴在O/W界面的形成,因此EAI值较高;而在较高的蛋白浓度下,蛋白分子迁移受到阻止,可能降低蛋白吸附的有效性,导致EAI下降。而乳化稳定性呈上升趋势可能是因为液滴尺寸减小,从而使界面蛋白浓度增加,有效地阻止了液滴间的絮凝。
2.5 林蛙卵蛋白的蛋白组分分析
将质谱采集到的样品数据用Proteome Discoverer 2.1.0182(Thermo Fisher Scientific,Rockford,IL,USA)进行蛋白质鉴定分析,相关数据处理参数设置如下:
搜库引擎:Sequest HT;蛋白质数据库:(TaxId:10090;网址https://www.uniprot.org/uniprot/?query=mouse&sort=score);Enzyme:Trypsin;Miss Cleavages:2;Variable Modifications:Oxidation(M),Acetyl(Protein N-term),Deamidated(N,Q);Fixed modifications:Carbamidomethyl(C);Peptide Mass Tolerance:±10 ppm;Fragment Mass Tolerance:±0.02 Da;Peptide FDR:Less than 1%;Protein Q Value:Less than 1%。
蛋白质相对分子量分布图见图5。

图5 蛋白质相对分子量分布图
整理数据结果可得,林蛙卵蛋白样品中共包含425种蛋白/肽段,蛋白主要集中在50~200 kDa的分子量区间,且大部分蛋白是由2~8个特异性肽段组成。从鉴定出的425种蛋白中选取PE值小于3的蛋白(PE=1,2,3,4,5,值越小代表鉴定蛋白可靠性越高),利用Uniprot ID在数据库中查询其对应的蛋白种类及物种来源等信息。
蛋白质相对分子量分布图见图5,PE值小于3的蛋白种类见表1。

表1 PE值小于3的蛋白种类

(续表1)
3 结论
对林蛙卵中的混合蛋白进行碱溶酸沉法提取,得到的蛋白粉通过生物化学手段测定其功能特性,包括溶解性、持水性、起泡性和乳化性。结果发现,林蛙卵蛋白的溶解性较差,在等电点pH值4.5时达到最低值,在pH值>9时和温度60℃以上时,林蛙卵蛋白的溶解性有显著增强,NSI值在0.6以上。与之相反,林蛙卵蛋白的持水性良好,在40℃时达到最佳值5.93 g/g,在远离等电点的pH值下持水性呈上升趋势。林蛙卵蛋白的起泡能力一般与其溶解性较差有关,但乳化能力较好,乳化稳定性随质量浓度增加而增加。另外,采用液质联用技术对蛋白中的蛋白和多肽种类进行测定,得知林蛙卵蛋白中有约425种蛋白/肽段,与美洲牛蛙、林蛙等有较好的同源性,蛋白种类以酶居多,分子量主要集中在50~200 kDa。为林蛙卵蛋白今后在食品加工中应用奠定了良好的理论基础。

