传统中式火腿加工过程中N-羟乙酰神经氨酸的动态变化
邰胜梅 姚敏 徐阿奇 李仲佰 龚小会 梁美莲 常瑞 朱秋劲




摘 要:为探究传统中式火腿加工过程中不同形态N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)之间的关系,采用高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detector,HPLC-FLD)法测定样品中总Neu5Gc、游离态Neu5Gc、结合态Neu5Gc的含量。结果表明:上述3 种形态的Neu5Gc含量随着加工时间的延长均呈前期上升后期降低的趋势;浅层肌肉半膜肌和深层肌肉股二头肌中总Neu5Gc和结合态Neu5Gc的含量变化规律相似,因水分含量降低程度的不同而使股二头肌的变化规律滞后。发酵后期水分损失幅度变缓,股二头肌中Neu5Gc解离速率高于半膜肌;新鲜猪后腿原料中游离态Neu5Gc含量极少,甚至低于检测限,结合态Neu5Gc含量与总Neu5Gc含量(15.00~30.62 µg/g)接近。发酵半年、1 年和2 年的火腿中总Neu5Gc含量分别为(15.09±0.39)、(14.52±0.38)、(28.30±0.43)µg/g,均与猪后腿原料中的Neu5Gc含量相近。為进一步探究Neu5Gc的变化,对样品进行冷冻干燥处理以避免水分含量变化对Neu5Gc含量的影响,结果表明,随着加工时间的延长,总Neu5Gc、结合态Neu5Gc的含量逐渐降低,且发酵期降低明显,具有显著差异性(P<0.05);游离态Neu5G变化无明显规律,但与空白样品相比,其含量呈增加趋势。
关键词:N-羟乙酰神经氨酸;高效液相色谱-荧光检测法;传统中式火腿;解离;加工处理
Dynamic Change of N-Glycolylneuraminic Acid in Chinese Dry-Cured Ham during Processing
TAI Shengmei1,2, YAO Min3, XU Aqi1, LI Zhongbai4, GONG Xiaohui1, LIANG Meilian1, CHANG Rui1,2, ZHU Qiujin1,*
(1. Guizhou Province Key Laboratory of Agricultural and Livestock Products Storage and Processing, School of Liquor and Food Engineering, Guizhou University, Guiyang 550025, China; 2. School of Food Science and Technology, Jiangnan University,
Wuxi 214122, China; 3. Guizhou Breeding Livestock and Poultry Germplasm Testing Center, Guiyang 550001, China;
4. Panzhou Agricultural Bureau of Guizhou Province, Panzhou 561601, China)
Abstract: The purpose of this study was to explore the relationship between different forms of N-glycolylneuraminic acid (Neu5Gc) during traditional Chinese ham processing. The contents of total Neu5Gc, free Neu5Gc and conjugated Neu5Gc in samples, as determined by high performance liquid chromatography with fluorescence detector (HPLC-FLD), increased first and decreased later. The contents of total Neu5Gc and conjugated Neu5Gc in Semimembranosus muscle (SM) and Biceps femoris muscle (BF) changed in a similar trend, with BF lagging behind SM due to the different degrees of decrease in water content. In the late stage of fermentation, water was lost slowly, and the dissociation rate of Neu5Gc in BF was higher than that in SM. The content of free Neu5Gc in fresh hind legs was very low, even lower than the detection limit, and the content of conjugated Neu5Gc was close to the content of total Neu5Gc (15.00–30.62 μg/g). Total Neu5Gc contents in hams fermented for six months, one year and two years were (15.09 ± 0.39), (14.52 ± 0.38) and (28.30 ± 0.43) μg/g, which were similar to that in fresh hind legs. In order to further explore the change of Neu5Gc, the samples were freeze-dried to avoid the influence of water content change on Neu5Gc content. The contents of total Neu5Gc and conjugated Neu5Gc decreased gradually, especially during the fermentation period, with a significant difference being observed (P < 0.05). The content of free Neu5G changed irregularly, but showed an increasing trend compared with the blank sample.
Keywords: N-glycolylneuraminic acid; high performance liquid chromatography-fluorescence detection method; Chinese dry-cured ham; dissociation; processing
DOI:10.7506/spkx1002-6630-20210517-138
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2021)11-0001-08
引文格式:
邰胜梅, 姚敏, 徐阿奇, 等. 传统中式火腿加工过程中N-羟乙酰神经氨酸的动态变化[J]. 肉类研究, 2021, 35(11): 1-8. DOI:10.7506/rlyj1001-8123-20210517-138. http://www.rlyj.net.cn
TAI Shengmei, YAO Min, XU Aqi, et al. Dynamic change of N-glycolylneuraminic acid in Chinese dry-cured ham during processing[J]. Meat Research, 2021, 35(11): 1-8. DOI:10.7506/rlyj1001-8123-20210517-138. http://www.rlyj.net.cn
传统中式火腿富含蛋白和许多重要微量元素,满足人們对红肉制品口感和营养的需求[1-3]。但研究表明,红肉内存在一种唾液酸——N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc),随着红肉及其加工肉制品的过多摄入可能会引发癌症[4-6],增加患结肠癌、乳腺癌、冠心病等疾病的风险[7-11]。
Neu5Gc是一种酸性氨基糖类[12],其结构是含11 个碳原子的9碳单糖衍生物,是50多种唾液酸中最常见的3 种核心单体之一[13-14],主要位于动物细胞膜糖蛋白上和糖脂末端[15]。健康人体自身不能合成Neu5Gc,但可以从外源性食物中获得Neu5Gc[16]。已有资料证实人体中Neu5Gc的唯一来源是红肉、奶制品等动物源食品的摄入,尤其是红肉[17]。膳食Neu5Gc可形成“自身异种抗原”[18],通过人体组织代谢[16]在体内积累,与人体存在的抗Neu5Gc抗体[19]结合引发持续免疫反应,可能产生或促进慢性炎症,从而导致癌症或其他慢性炎症加剧[9,17,20-22]。庄滢滢等[23]研究发现Neu5Gc摄入量与低度慢性炎症因子C-反应蛋白和白细胞介素6水平呈正相关。Samraj等[17]采用富含Neu5Gc的食物(0.25 mg/g颌下腺黏蛋白)饲喂7 只Neu5Gc缺陷小鼠,短期喂食时其中2 只出现全身炎症迹象,而长期暴露于这种饮食导致这2 只小鼠出现早期肝细胞癌症状,癌症发病率增加5 倍。红肉中的Neu5Gc主要以结合态存在,其含量约为游离态Neu5Gc含量的
30 倍[24-25]。饮食中游离态Neu5Gc会迅速随尿液和粪便排出体外,只有结合态Neu5Gc能在人体肠道、血液和肝脏中稳定存在,引发炎症反应[17]。为降低食物中总Neu5Gc的含量可能会促使人们减少红肉摄入量,因此,探析将结合态Neu5Gc转化为游离态Neu5Gc的行之有效的方法十分必要。
目前可以通过物理法、生物法、酶法等降低食物中Neu5Gc含量,但关于游离态和结合态Neu5Gc之间转化的深入研究报道不足[26-32]。郑婉婷等[33]发现新鲜猪肉经腌制处理后3 种不同形态Neu5Gc含量均降低。晏印雪等[27]研究发现发酵肉制品中Neu5Gc含量均低于未发酵肉制品。火腿加工过程中经过失水、发酵和成熟等工艺,使火腿理化性质发生变化,因此,研究加工过程中Neu5Gc的动态变化有利于拓展红肉制品中Neu5Gc的降解方法和解析其中的变化机理。
本研究采用盘县火腿制作工艺加工新鲜猪后腿,以新鲜猪后腿和不同加工时间的火腿为实验材料,采用高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detector,HPLC-FLD)法对传统中式火腿加工过程中3 种不同形态Neu5Gc的含量进行动态监测,探寻不同加工阶段对不同部位肌肉(股二头肌和半膜肌)制作火腿中结合态和游离态Neu5Gc含量变化的影响。
1 材料与方法
1.1 材料与试剂
15 只新鲜猪后腿由贵州省贵阳花溪巨龙屠宰场提供,质量(15.22±0.50)kg,猪品种为长白猪,其年龄、饲养条件相同;半年、1 年和2 年的盘县火腿购于贵州杨老奶食品有限公司。
Neu5Gc标准品、1,2-二氨基-4,5-亚甲基二氧苯盐酸盐(1,2-diamino-4,5-methylenedioxybenzene dihydrochloride,DMB)、β-巯基乙醇(色谱纯) 美国
Sigma公司;甲醇、乙腈(均为色谱纯) 德国Applichem公司;硫酸铵、冰醋酸、亚硫酸钠、硫代硫酸钠(均为分析级) 国药集团化学试剂有限公司。
1.2 仪器与设备
1260高效液相色谱仪(配有荧光检测器和自动进样器)、ZORBAX Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm) 美国安捷伦科技有限公司;
CTFD-12S冷冻干燥机 青岛永合创信电子科技有限公司;
S825-12DT超声清洗器 上海冠特超声仪器有限公司;
DY89-II电动玻璃匀浆机 上海安亭科学仪器厂;AR224CN电子分析天平 奥豪斯仪器(贵州)有限公司;H2-16KR台式高速冷冻离心机 湖南可成仪器设备有限公司。
1.3 方法
1.3.1 样品制备和预处理
盘县火腿加工工艺参考文献[34],主要工艺:新鲜猪后腿预冷12 h→鲜腿修割、定形→腌制(分别按腿胚质量的6%、3%和1.5%上盐腌制3 次,间隔时间分别为2、3、3 d;3 次上盐后,剩余腌制期阶段视腌制情况进行补盐,补盐量控制在腿胚质量的1.5%)→上挂晾晒→发酵成熟
新鲜肉样:分别取0、15、40(腌制期)、60(晾晒期)、80、100、120 d(发酵期)的火腿半膜肌、股二头肌以及成品火腿,以腌制0 d的肉样(新鲜肉样)为对照组。15 只新鲜猪后腿采用上述工艺进行加工,其中7 只每个时间点均取样,每次取样部位尽量保持一致,每只火腿取6 个不同点,每只腿取至少100 g,现场切块包装,置于-20 ℃冰箱备用。然后再选取5 只火腿(编号为腿Ⅰ、鲜腿Ⅱ、鲜腿Ⅲ、鲜腿Ⅳ、鲜腿Ⅴ)用于比较新鲜猪后腿(0 d)与发酵结束时(120 d)火腿之间3 种形态Neu5Gc的变化,取样步骤同上。
干基肉样:分别对0、40(腌制期)、60(晾晒期)、90、120 d(发酵期)的火腿半膜肌、股二头肌进行取样。样品经冷冻干燥处理,置于-80 ℃冰箱备用,用于排除水分含量对加工过程中不同形态Neu5Gc含量变化的影响。其余腿胚备用。
1.3.2 总Neu5Gc含量测定
参考Martin等[35]的方法稍作改进。准确称取(1.005 5±0.000 5)g样品,加入10 mL质量分数30%饱和硫酸铵溶液,用匀浆机研磨匀浆,室温下放置2 h,进行冷冻干燥。冷冻干燥后的粉末加入10 mL 2 mol/L醋酸溶液,于80 ℃水浴3 h,然后12 000 r/min、4 ℃离心15 min,过滤,再次冷冻干燥。冷冻干燥粉末溶于1 mL超纯水中,加入0.2 mL 0.1 mol/L NaOH溶液,37 ℃水浴30 min,过滤,采用HPLC-FLD法检测。每组做3 次平行。
1.3.3 游离态Neu5Gc含量测定
参考Ji Suna等[36]的方法稍作改进。准确称取(1.005 5±0.000 5)g样品,加入10 mL质量分数30%饱和硫酸铵溶液,匀浆后室温下放置2 h,以12 000 r/min、4 ℃离心15 min,过滤,收集沉淀进行冷冻干燥。冷冻干燥粉末溶于1 mL超纯水中,加入0.2 mL 0.1 mol/L NaOH溶液,37 ℃水浴30 min,过滤,采用HPLC-FLD法检测。每组做3 次平行。
1.3.4 HPLC-FLD法检测Neu5Gc含量
DMB衍生液的配制及衍生条件:参考Martin等[35]的方法配制含8 mmol/L DMB溶液、1.5 mol/L冰醋酸、0.25 mol/L
硫代硫酸钠、0.25 mol/L亚硫酸钠、0.8 mmol/L β-巯基乙醇的衍生液,向标准品中按照体积比9∶1加入DMB衍生液,50 ℃避光衍生2.5 h。衍生结束后,用有机相过滤器过滤,放入HPLC仪中检测。HPLC检测条件[35,37]:ZORBAX Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm),柱温30 ℃,FLD激发波长373 nm、发射波长448 nm,流动相为乙腈-甲醇-超纯水(8∶7∶85,V/V),流速0.9 mL/min,进样体积10 μL。
配制1 mmol/L Neu5Gc标准品溶液,分别取25、50、100、150、200 μL 1 mmol/L Neu5Gc标准品溶液配制浓度分别为50、100、200、300、400 μmol/L的混合标准液。按照上述步骤进行衍生化和HPLC-FLD法检测。以Neu5Gc标准品浓度为纵坐标,Neu5Gc标准品峰面积为横坐标绘制标准曲线,得到标准曲线方程y=0.305 0x+6.769 1(R2=0.999 4)。
总Neu5Gc和游离态Neu5Gc含量采用HPLC-FLD法检测通过标准曲线方程计算得到。结合态Neu5Gc含量为总Neu5Gc含量与游离态Neu5Gc含量之差。
1.3.5 水分含量测定
采用直接干燥法,称取5 g绞碎肉样(精确至0.01 g),用水分测定仪测定水分含量。每个样品测定2 次,结果取平均值。
1.4 数据处理
实验结果以平均值±标准差表示;采用Origin 2019b软件制作绘图;采用SPSS 17.0软件中Tukey s-b(K)法进行单因素方差分析,P<0.05表示有显著性差异。
2 结果与分析
2.1 传统中式火腿加工过程中新鲜肉样Neu5Gc的变化
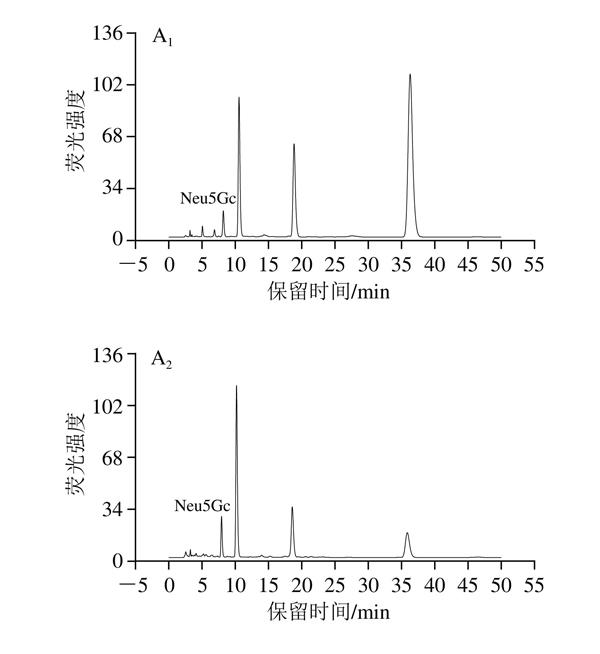
Neu5Gc的保留时间为7.901~8.528 min,由图1A可知,火腿加工不同时期所测Neu5Gc色谱图分离效果良好,0 d时总Neu5Gc色谱图中杂峰很少,随着时间的延长,杂峰逐渐增多,说明火腿加工过程中物质间不断转化,这些杂峰可能是蛋白质水解、脂质氧化等化学反应的产物[38-40]。由图2B可知,火腿加工过程中所测游离态Neu5Gc色谱图分离效果良好,但杂峰较多,说明未酸解的样品所得色谱图杂峰较多,且游离态Neu5Gc含量很低,可见样品预处理中酸解后不仅可以检测总Neu5Gc含量,且减少了其他物質干扰,保证Neu5Gc色谱图的分离效果。
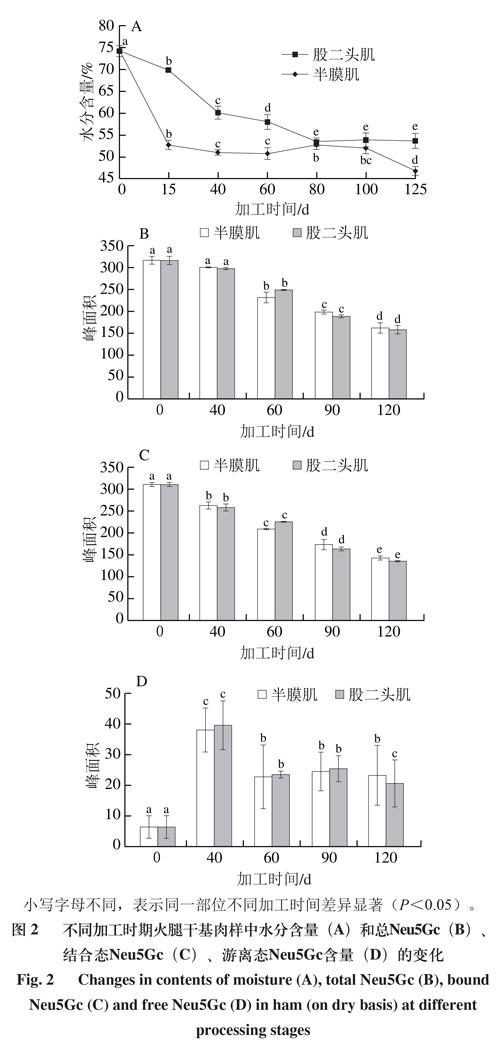
2.2 传统中式火腿加工过程中干基肉样Neu5Gc的变化
水分含量是影响火腿加工过程中Neu5Gc含量的重要因素。由图2A可知,随着加工时间的延长,至120 d时火腿股二头肌和半膜肌的水分含量由最初的74.13%分别降低至53.56%和46.61%。为了排除水分含量变化对Neu5Gc含量的影响,样品经冷冻干燥处理后按照新鲜样品的检测方法测定火腿干基肉样中的Neu5Gc含量。由图2B~D可知,随着加工时间的延长,半膜肌和股二头肌中总Neu5Gc和结合态Neu5Gc含量均逐渐降低(P<0.05),而游离态Neu5Gc含量先增加后减少(P<0.05)。腌制期间(0~40 d)水分和盐分发生迁移,此阶段股二头肌和半膜肌中结合态Neu5Gc含量均降低,游离态Neu5Gc急剧增加,但总Neu5Gc含量变化不显著;晾晒期间(40~60 d)温度升高使肉样组织中酶活性和化学反应效率提高,游离态Neu5Gc的降解速率大于结合态Neu5Gc的解离速率,导致3 种形态Neu5Gc的含量均降低;发酵期(60~120 d)糖蛋白和脂质末端的结合态Neu5Gc继续解离成为游离态Neu5Gc[41-42],但其解离速率低于游离态Neu5Gc的降解速率,导致总Neu5Gc和结合态Neu5Gc含量继续降低,游离态Neu5Gc含量较稳定。晾晒期结束时,半膜肌中3 种形态Neu5Gc的含量均低于股二头肌;进入发酵期后,随着发酵时间的延长,股二头肌中3 种形态Neu5Gc的含量整体低于半膜肌。不同加工阶段干基肉样中3 种形态Neu5Gc含量变化趋势揭示,传统中式火腿加工过程中总Neu5Gc和结合态Neu5Gc含量逐步降低。晏印雪等[27]研究发现不同发酵红肉制品中Neu5Gc含量存在显著差异(P<0.05),且均低于未发酵红肉制品中的Neu5Gc含量,揭示了发酵对Neu5Gc降解的影响。
2.3 传统中式火腿典型加工工艺对3 种形态Neu5Gc转变的影响
由表1可知,随着加工时间的延长,火腿样品中总Neu5Gc和结合态Neu5Gc含量均呈先升高后降低的趋势,这是由于腌制期与晾晒期火腿中水分含量大幅度减少(图2A),导致在单位质量下干物质含量增加,而Neu5Gc主要以结合态存在于糖蛋白和糖脂的糖基化末端[41-42],因此导致总Neu5Gc和结合态Neu5Gc含量的增加。发酵期间(60~120 d),火腿半膜肌中总Neu5Gc和结合态Neu5Gc含量降低,120 d时总Neu5Gc和结合态Neu5Gc含量与鲜腿(0 d)时具有显著差异(P<0.05),股二头肌中总Neu5Gc和结合态Neu5Gc含量变化规律与半膜肌相似。Neu5Gc含量的升高主要与水分流失有关。在腌制期(0~40 d),火腿股二头肌总Neu5Gc的增加量低于半膜肌,可能是因为股二头肌失水速率低于半膜肌的原因所致。晾晒期(40~60 d),火腿股二头肌总Neu5Gc继续增加,而半膜肌总Neu5Gc开始降低,表明股二头肌中Neu5Gc的变化慢于半膜肌。发酵期(60~120 d),股二头肌总Neu5Gc和结合态Neu5Gc的减少量均高于半膜肌,说明发酵期股二头肌结合态Neu5Gc的解离速度较半膜肌快,具体原因有待深入研究。
鲜腿(0 d)的游离态Neu5Gc含量很低。Ji Suna等[36]等的研究结果表明,游离态Neu5Gc含量在3、38 日龄和成年猪肌肉中的变化不具有规律性,但总Neu5Gc、结合态Neu5Gc含量是游离态Neu5Gc的数十倍。由表1可知,随着加工时间的延长,游离态Neu5Gc含量先增加后降低。游离态Neu5Gc含量增加,一是由于水分流失,干物质含量相对增加;二是火腿加工过程中结合态Neu5Gc与糖蛋白和脂质末端解离。发酵期结合态Neu5Gc解离速率低于游离态Neu5Gc的降解速率,从而导致游离态Neu5Gc含量的降低。发酵期游离态Neu5Gc显著高于鲜腿(P<0.05)。
2.4 不同成熟期传统中式火腿中Neu5Gc含量的变化
由表2可知,新鲜猪后腿中总Neu5Gc含量为15.00~30.62 µg/g,与报道中结果[33,43-44]一致。经120 d加工(发酵60 d)后,其中总Neu5Gc和结合态Neu5Gc含量均降低,游离态Neu5Gc含量增加。
上述传统中式火腿因发酵期短,仅60 d,仍属新制火腿。为进一步了解长时间发酵的传统中式火腿中Neu5Gc变化,选择发酵半年、1 年和2 年的成品火腿检测其中3 种形态Neu5Gc含量。由表3可知,发酵半年、1 年和2 年成品火腿中总Neu5Gc含量分别为15.09、14.52、28.30 µg/g,游离态Neu5Gc含量分别为2.69、6.18、7.46 µg/g,结合态Neu5Gc含量分别为14.51、10.46、22.95 µg/g。与新制火腿加工过程(0~120 d)中Neu5Gc的变化不同,长时间发酵成品火腿中游离态Neu5Gc含量明显增多,与文琦[43]的研究结果一致。
年龄、饲养条件等不同均会使火腿中Neu5Gc含量不同[45],导致差异的原因有待研究。无论发酵期长短,新鲜猪后腿和成品火腿间的总Neu5Gc含量相近,与新鲜猪后腿相比,成品火腿中水分含量降低,但未导致总Neu5Gc含量显著升高,间接证明传统中式火腿的加工过程具有降低Neu5Gc含量的作用,其降解机制还需深入研讨。
3 结 论
本实验对传统中式火腿加工过程中以及企业成品火腿中Neu5Gc含量进行检测。随着加工时间的延长,总Neu5Gc、结合态Neu5G、游离态Neu5Gc的含量均呈先升高后降低的趋势;新鲜猪后腿中几乎不含或含有极少量的游离态Neu5Gc,但加工过程中火腿游离态Neu5Gc含量有所增加;发酵半年、1 年和2 年的成品火腿中也发现了游离态Neu5Gc,明显高于新鲜猪后腿中游离态Neu5Gc;在不同加工时期,干基肉样中总Neu5Gc、結合态Neu5Gc含量逐渐降低,且发酵期降低幅度较大,差异性显著(P<0.05),游离态Neu5Gc含量先升高后降低。
綜上,无论是在实验室腌制火腿还是成品火腿中,均发现火腿加工工艺有利于结合态Neu5Gc从糖蛋白和脂蛋白末端的解离,从而转化为游离态Neu5Gc,游离态Neu5Gc进一步的降解导致了总Neu5Gc的降低。目前,尚未有关于发酵过程中化学、微生物变化对火腿中不同形态Neu5Gc转化影响的研究,进一步研究应阐释发酵期间这些变化对Neu5Gc降解的影响。
参考文献:
[1] CILLA I, MARTINEZ L, BELTRAN J A, et al. Factors affecting acceptability of dry-cured ham throughout extended maturation under “bodega” conditions[J]. Meat Science, 2005, 69(4): 789-795. DOI:10.1016/j.meatsci.2004.11.012.
[2] FERGUSON L R. Meat and cancer[J]. Meat Science, 2010, 84(2): 308-313. DOI:10.1016/j.meatsci.2009.06.032.
[3] WYNESS L, WEICHSELBAUM E, O’CONNOR A, et al. Red meat in the diet: an update[J]. Nutrition Bulletin, 2011, 36(1): 34-77. DOI:10.1111/j.1467-3010.2010.01871.x.
[4] 刘沛, 王舒, 李变荣. 血清唾液酸在恶性肿瘤诊断中的临床应用[J]. 检验医学与临床, 2012, 9(6): 687-688. DOI:10.3969/j.issn.1672-9455.2012.06.023.
[5] SHIGETA S. Recent progress in antiviral chemotherapy for respiratory syncytial virus infections[J]. Expert Opinion on Investigational Drugs, 2000, 9(2): 221-235. DOI:10.1517/13543784.9.2.221.
[6] MALYKH Y N, SCHAUER R, SHAW L. N-glycolylneuraminic acid in human tumours[J]. Biochimie, 2001, 83(7): 623-634. DOI:10.1016/S0300-9084(01)01303-7.
[7] VARKI A. N-glycolylneuraminic acid deficiency in humans[J]. Biochimie, 2001, 83(7): 615-622. DOI:10.1016/S0300-9084(01)01303-7.
[8] 范杏丹, 李红卫. 红肉、N-羟乙酰神经氨酸与癌症关系的研究进展[J]. 食品科学, 2014, 35(15): 326-329. DOI:10.7506/spkx1002-6630-201415064.
[9] ALISSON-SILVA F, KAWANISHI K, VARKI A. Human risk of diseases associated with red meat intake: analysis of current theories and proposed role for metabolic incorporation of a non-human sialic acid[J]. Molecular Aspects of Medicine, 2016, 51(2): 16-30. DOI:10.1016/j.mam.2016.07.002.
[10] ZAROGOULIDIS K, ELEFTHERIOU P, DOMVRI K, et al. Determination of antibodies against the red meat derived antigen Neu5Gc in patients with lung cancer. Probable association with disease development and progress[J]. European Respiratory Journal, 2015, 46(6): PA533. DOI:10.1183/13993003.congress-2015.PA533.
[11] SAMRAJ A N, LAUBLI H, VARKI N, et al. Involvement of a non-human sialic acid in human cancer[J]. Frontiers in Oncology, 2014, 4: 83. DOI:10.3389/fonc.2014.00083.
[12] LLOYD K O, FURUKAWA K. Biosynthesis and functions of gangliosides: recent advances[J]. Glycoconjugate Journal, 1998, 15(7): 627-636. DOI:10.1023/A:1006924128550.
[13] TEN BRUGGENCATE S J M, BOVEE-OUDENHOVEN I M J, FEITSMA A L, et al. Functional role and mechanisms of sialyllactose and other sialylated milk oligosaccharides[J]. Nutrition Reviews, 2014, 72(6): 377-389. DOI:10.1111/nure.12106.
[14] CHEN X, VARKI A. Advances in the biology and chemistry of sialic acids[J]. ACS Chemical Biology, 2010, 5(2): 163-176. DOI:10.1021/cb900266r.
[15] SILLANAUKEE P, PONNIO M, JAASKELAINEN I P. Occurrence of sialic acids in healthy humans and different disorders[J]. European Journal of Clinical Investigation, 1999, 29(5): 413-425. DOI:10.1046/j.1365-2362.1999.00485.x.
[16] HEDLUND M, TANGVORANUNTAKUL P, TAKEMATSU H, et al. N-glycolylneuraminic acid deficiency in mice: implications for human biology and evolution[J]. Molecular and Cellular Biology, 2007, 27(12): 4340-4346. DOI:10.1128/MCB.00379-07.
[17] SAMRAJ A N, PEARCE O M T, LAUBLI H, et al. A red meat-derived glycan promotes inflammation and cancer progression[J]. Proceedings of The National Academy of Sciences, 2015, 112(2): 542-547. DOI:10.1073/pnas.1417508112.
[18] ECSEDY J A, MANFREDI M G, YOHE H C, et al. Ganglioside biosynthetic gene expression in experimental mouse brain tumors[J]. Cancer Research, 1997, 57(8): 1580-1583.
[19] PADLER-KARAVANI V, YU H, CAO H, et al. Diversity in specificity, abundance, and composition of anti-Neu5Gc antibodies in normal humans: Potential implications for disease[J]. Glycobiology, 2008, 18(10): 818-830. DOI:10.1093/glycob/cwn072.
[20] BARDOR M, NGUYEN D H, DIAZ S, et al. Mechanism of uptake and incorporation of the non-human sialic acid N-glycolylneuraminic acid into human cells[J]. Journal of Biological Chemistry, 2005, 280(6): 4228-4237. DOI:10.1074/jbc.M412040200.
[21] 朱秋劲, 梁美莲, 汪瑞敏, 等. 红肉中N-羟乙酰神经氨酸解離方法的研究进展[J]. 食品安全质量检测学报, 2016, 7(10): 3879-3883. DOI:10.19812/j.cnki.jfsq11-5956/ts.2016.10.006.
[22] MALYKH Y N, KING T P, LOGAN E, et al. Regulation of N-glycolylneuraminic acid biosynthesis in developing pig small intestine[J]. Biochemical Journal, 2003, 370(2): 601-607. DOI:10.1042/BJ20021049.
[23] 庄滢滢, 郑晗盈, 兰慧, 等. 膳食N-羟乙酰神经氨酸摄入水平与机体慢性炎症状态的相关性研究[J]. 中华预防医学杂志, 2020, 54(6): 668-672. DOI:10.3760/cma.j.cn112150-20191021-00802.
[24] MURALIKRISHNA G, REUTER G, PETERKATALINIC J, et al. Identification of a new ganglioside from the starfish asterias-rubens[J]. Carbohydrate Research, 1992, 236: 321-326. DOI:10.1042/BJ20021049.
[25] IWASAKI M, INOUE S, KITAJIMA K, et al. Novel oligosaccharide chains on polysialoglycoproteins isolated from rainbow trout eggs. A unique carbohydrate sequence with a sialidase-resistant sialyl group, DGa1NAc beta 1 leads to 4(NeuGc2 leads to 3)DGa1NAc[J]. Biochemistry, 1984, 23(2): 305-310. DOI:10.1021/bi00297a020.
[26] 李洪英, 常瑞, 朱秋勁, 等. 染料木黄酮对大鼠体内N-羟乙酰神经氨酸含量的影响及其与唾液酸转移酶相互作用的探讨[J]. 生物工程学报, 2019, 35(5): 857-870. DOI:10.13345/j.cjb.180505.
[27] 晏印雪, 朱秋劲, 梁美莲, 等. 高效液相色谱-荧光检测法测定发酵红肉制品中Neu5Gc[J]. 食品与生物技术学报, 2019, 38(5): 66-72. DOI:10.3969/j.issn.1673-1689.2019.05.010.
[28] 常瑞, 曾雪峰, 朱秋劲. 溶剂和外电场下N-羟乙酰神经氨酸的理论光谱研究[J]. 原子与分子物理学报, 2020, 37(2): 185-193. DOI:10.3969/j.issn.1000-0364. 2020. 02. 005.
[29] 常瑞, 罗先锟, 何江, 等. 菊粉酶降低N-羟乙酰神经氨酸含量机制的分子模拟研究[J]. 核农学报, 2020, 34(9): 2032-2044. DOI:10.11869/j.issn.100-8551.2020.09.2032.
[30] 周樱子, 朱秋劲, 常瑞, 等. 山奈酚和槲皮素对大鼠体内Neu5Gc合成的影响及分子机制探究[J]. 中国生物化学与分子生物学报, 2019, 35(1): 101-111. DOI:10.13865/j.cnki.cjbmb.2019.01.14.
[31] 梁美莲, 朱秋劲, 刘春丽, 等. 不同加工处理方式对牛肉中Neu5Gc解离的影响[J]. 食品科学, 2018, 39(10): 28-34. DOI:10.7506/spkx1002-6630-201810005.
[32] 徐阿奇. 几种物理加工方法对红肉中Neu5Gc解离效果的影响[D]. 贵阳: 贵州大学, 2019: 36-48.
[33] 郑婉婷, 何恩祺, 何荣鑫, 等.肉制品中唾液酸含量和形态分析及在加工中的变化[J]. 现代食品科技, 2020, 36(10): 100-107. DOI:10.13982/j.mfst.1673-9078.2020.10.0520.
[34] 濮国群, 蒋媚梅. 盘县火腿加工流程初[J]. 农民致富之友, 2015(9): 149.
[35] MARTIN M J, VAZQUEZ E, RUEDA R. Application of a sensitive fluorometric HPLC assay to determine the sialic acid content of infant formulas[J]. Analytical and Bioanalytical Chemistry, 2007, 387(8): 2943-2949. DOI:10.1007/s00216-007-1160-z.
[36] JI Suna, WANG Fang, CHEN Yue, et al. Developmental changes in the level of free and conjugated sialic acids, Neu5Ac, Neu5Gc and KDN in different organs of pig: a LC-MS/MS quantitative analyses[J]. Glycoconjugate Journal, 2017, 34(1): 21-30. DOI:10.1007/s10719-016-9724-9.
[37] LI H, FAN X. Quantitative analysis of sialic acids in Chinese conventional foods by HPLC-FLD[J]. Open Journal of Preventive Medicine, 2014, 4(2): 57-63. DOI:10.1016/j.carbpol.2021.117741.
[38] WEI Youbing, WU Xiang, ZHOU Hui, et al. Protein hydrolysis and lipid oxidation during salami fermentation and ripening[J]. 食品科学, 2019, 40(20): 67-73 . DOI:10.7506/spkx1002-6630-20181101-008.
[39] KOUTINA G, JONGBERG S, SKIBSTED L H. Protein and lipid oxidation in parma ham during production[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9737-9745. DOI:10.1021/jf3026887.
[40] WANG Zhenyu, GAO Xiaoguang, ZHANG Jihong, et al. Changes of intramuscular fat composition, lipid oxidation and lipase activity in Biceps femoris and Semimembranosus of Xuanwei ham during controlled salting stages[J]. Journal of Integrative Agriculture, 2013, 12(11): 1993-2001. DOI:10.1016/S2095-3119(13)60637-1.
[41] ANGATA T, VARKI A. Chemical diversity in the sialic acids and related alpha-keto acids: an evolutionary perspective[J]. Chemical Reviews, 2002, 102(2): 439-469. DOI:10.1021/cr000407m.
[42] VARKI A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins[J]. Nature, 2007, 446: 1023-1029. DOI:10.1038/nature05816.
[43] 文琦. 不同加工方式对红肉中Neu5Gc的影响及在体外消化过程中的变化[D]. 长沙: 湖南农业大学, 2019: 20-23.
[44] 蒋芸, 付浩, 冯昌雨, 等. 不同处理方式对红肉中N-羟乙酰神经氨酸解离的影响[J]. 肉类研究, 2015, 29(12): 52-57. DOI:10.15922/j.cnki.rlyj.2015.12.010.
[45] JI Suna, WANG Fang, CHEN Yue, et al. LC-MS/MS quantification of Neu5Ac, Neu5Gc and KDN levels in different organs and ages of pig: impact Neu5Gc intake and health[J]. Journal of Nutrition & Intermediary Metabolism, 2017, 8: 88. DOI:10.1016/j.jnim.2017.04.102.
收稿日期:2021-05-17
基金项目:贵州省科技计划项目(黔科合支撑[2019]2374号);贵州省高层次创新型人才培养项目(黔科合平台人才[2017]5788);
貴州省生态特色肉制品科技创新人才团队(黔科合平台人才[2020]5004)
第一作者简介:邰胜梅(1996—)(ORCID: 0000-0002-1967-246X),女,硕士研究生,研究方向为食品安全检测与控制。
E-mail: 847763581@qq.com
*通信作者简介:朱秋劲(1969—)(ORCID: 0000-0002-0392-4992),男,教授,博士,研究方向为食品营养与安全和畜产品加工。E-mail:ls.qjzhu@gzu.edu.cn

