3种猪自然细胞毒性受体多克隆抗体制备与鉴定
杜 谦,杨 楠,史腾飞,朱 磊,黄 勇,童德文
(西北农林科技大学 动物医学学院,陕西 杨凌 712100)
自然杀伤(natural killer,NK)细胞是机体先天免疫的重要组成部分,与机体的抗病毒感染和免疫调节密切相关[1]。在机体抵抗病毒感染过程中,NK细胞主要通过自然杀伤作用直接靶向杀伤被感染的细胞,进而控制病毒的感染。在机体产生了针对病毒抗原的特异性抗体后,NK细胞可以通过抗体依赖的细胞介导的细胞毒性作用(antibody dependent cell mediated cytotoxicity,ADCC)来杀伤被感染的靶细胞,从而进一步达到清除病毒的目的[2]。另外,NK细胞还具有间接的免疫调节功能,它可以与机体其他多种免疫细胞相互作用,调控这些免疫细胞的数量和功能,从而调节机体的免疫功能,增强机体免疫系统对病毒反应能力[3]。NK细胞的这些功能受其细胞膜上相应受体产生的抑制和激活信号控制[4]。自然细胞毒性受体(natural cytotoxicity receptors,NCRs)是一类NK细胞的重要受体[5],主要由3种Ⅰ型跨膜蛋白NCR1(NKp46)、NCR2(NKp44)和NCR3(NKp30)组成,分别由基因NCR1、NCR2和NCR3编码[6]。NK细胞上这些受体的选择性参与可以刺激NK细胞产生细胞毒性,当NCRs与靶细胞上的相应配体(NCR ligands,NCRLs)结合,NK细胞被激活后,通过定向分泌穿孔蛋白和颗粒酶至靶细胞,同时通过分泌包括γ干扰素(IFN-γ)和肿瘤坏死因子-α(TNF-α)在内的细胞因子,启动靶细胞的凋亡程序,进而杀伤靶细胞[7]。NCRs以跨膜蛋白的形式贯穿NK细胞的细胞膜,其结构域可分为跨膜域、胞内域和胞外域3部分,其中胞外域一般指膜蛋白位于细胞外的区段,具有识别配体分子并激活信号通路的作用,因而多以NCRs胞外域作为抗原制备抗体,进而研究这些受体在病毒防御中的作用[8]。
猪圆环病毒2型(porcine circovirus type 2,PCV2)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)和非洲猪瘟病毒(African swine fever virus,ASFV)等多种病原感染后均可引起猪淋巴细胞数量减少[9-11],而这种淋巴细胞数量减少可能与NK细胞的异常激活有关[12]。因此,研究PCV2、PRRSV和ASFV等病毒感染后猪NK细胞的自然细胞毒性受体(porine NCRs,pNCRs)的功能对于阐述这些病毒的致病机制至关重要。但是,目前尚无制备pNCRs抗体的相关报道,制约了进一步深入研究pNCRs的功能及其在病毒致病过程中作用及机制。本研究拟通过在线软件预测和分析pNCRs的胞外域编码序列,原核表达重组pNCRs胞外域(outside cellular regions of pNCRs,opNCRs)目的蛋白,将重组蛋白免疫新西兰白兔后制备具有高效价和良好特异性的兔抗pNCRs多克隆抗体,为进一步研究pNCRs在病毒致病过程中的作用及机制提供材料。
1 材料与方法
1.1 菌株、质粒和试验动物大肠杆菌Rosetta感受态细胞、大肠杆菌DH5α感受态细胞、pET-32a质粒均由西北农林科技大学动物病理学实验室保存。8周龄雌性新西兰白兔购自成都达硕实验动物有限公司。
1.2 主要试剂琼脂糖凝胶核酸回收试剂盒、质粒小提试剂盒购自美国Omega公司,蛋白Marker购自碧云天生物技术有限公司,2×Taq PCR PreMix购自日本TaKaRa公司,NheⅠ、EcoRⅠ和XhoⅠ等限制性核酸内切酶以及T4DNA Ligase、DL2000 DNA Marker等均购自大连宝生物工程有限公司,镍离子螯合磁珠购自海狸生物科技有限公司,HRP标记羊抗兔IgG购自西安晶彩生物技术有限公司,FITC标记的羊抗兔IgG购自Proteintech,抗猪CD3单克隆抗体和抗猪CD8单克隆抗体购自BD Bioscience。
1.3 3种猪pNCRs胞外域预测和分析在NCBI(https://www.ncbi.nlm.nih.gov/)检索猪pNCR1、pNCR2和pNCR3的基因编码序列及相应的氨基酸编码序列,将检索到的序列通过在线软件TMHMM Server v.2.0(http://www.cbs.dtu.dk/ services/TMHMM/)预测猪pNCR1、pNCR2和pNCR3胞外域的氨基酸序列,及其相应的基因编码序列,最后将在线软件预测结果和已知的人NCRs胞外域信息比对,确定猪pNCR1、pNCR2和pNCR3的胞外域编码序列。
1.4 引物设计与合成根据上述预测和分析获得的pNCR1、pNCR2及pNCR3胞外域基因编码序列,使用Primer Premier 5.0设计pNCR1、pNCR2及pNCR3胞外域基因特异性引物,并根据目的载体pET-32a设计相应的酶切位点。引物序列见表1。

表1 pNCR1、pNCR2及pNCR3胞外域基因编码序列引物
1.5 目的基因opNCR1、opNCR2及opNCR3扩增以猪cDNA为模板,PCR扩增目的基因opNCR1、opNCR2及opNCR3。反应体系为:Primer-F(10 μmol /L)1.0 μL、Primer-R(10 μmol/L)1.0 μL、模板1.0 μL、2×PCR Master Mix 12.5 μL、ddH2O 9.5 μL。反应条件为:94℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸2 min,共30个循环;72℃延伸10 min。
1.6 重组表达载体pET-opNCR1、pET-opNCR2、pET-opNCR3构建用限制性核酸内切酶EcoRⅠ和XhoⅠ双酶切PCR回收产物opNCR1、opNCR2、opNCR3及pET-32a空质粒,琼脂糖凝胶电泳回收酶切产物。将经双酶切的opNCR1、opNCR2和opNCR3分别与经双酶切的pET-32a质粒用T4连接酶于16℃水浴条件中过夜连接16 h左右,接着将连接产物加入50 μL DH5α感受态细胞中,冰上孵育30 min,42℃热激90 s,然后冰上孵育2~3 min后,加入1 mL无抗性LB培养液,接着37℃、220 r/min摇床中孵育45 min,室温离心后涂板。培养12~14 h后挑取单克隆扩大培养。经过PCR和双酶切鉴定后,阳性克隆送往上海生工生物公司测序。
1.7 重组蛋白opNCR1、opNCR2及opNCR3诱导表达将经鉴定构建成功的重组质粒pET-opNCR1、pET-opNCR2、pET-opNCR3以及空载pET-32a的保存菌液活化后,分别将其按照1∶100的比例接种于8 mL含0.1% Amp的LB培养液中进行培养。当菌液D600 nm=0.4~0.6时,加入终浓度为1 mmol/L的IPTG,在转速为180 r/min的摇床上28℃诱导表达5 h,离心收集菌体,用1 mL PBS将菌体重悬,将菌液经超声裂解15 min后离心并重悬,分别取超声后上清和沉淀重悬液各80 μL,加入20 μL含β巯基乙醇的蛋白上样缓冲液,沸水浴10 min。SDS-PAGE检测目的蛋白的表达。
1.8 opNCRs蛋白表达纯化和浓缩按照1.7中的方法诱导重组opNCRs蛋白表达,使用镍离子螯合磁珠进行重组opNCRs蛋白的纯化。按照说明书进行纯化,收集洗脱液体。接着将洗脱液透析并用超滤管浓缩,-20℃保存。
1.9 动物免疫试验将8周龄雌性新西兰白兔随机分为4组,每组4只,试验动物分组为:第1组为opNCR1组,第2组为opNCR2组,第3组为opNCR3组,第4组为空白对照组。以纯化后的opNCR1、opNCR2和opNCR3重组蛋白作为免疫原,并按照表2进行背部皮下多点注射。第2次加强免疫14 d 后,收集血清并检测血清相应效价及抗体特异性。

表2 动物免疫程序
1.10 抗体血清效价检测将纯化的opNCR1、opNCR2和opNCR1蛋白用ELISA包被液稀释成5 mg/L,加入ELISA专用96孔板,4℃包被过夜,PBST洗3次;加入5%脱脂奶粉室温封闭2 h,PBST洗3次;将采集的兔血清1∶100稀释后,进行2倍倍比稀释,分别加入96孔板各孔中,孵育1 h,PBST洗3次;各孔加入HRP标记羊抗兔IgG(1∶5 000),37℃孵育1 h,PBST洗3次;最后加入TMB显色液,充分显色后加入终止液,酶标仪读取D450 nm值,当检测孔与阴性孔的比值≥2.1时的最大稀释倍数为该血清的抗体滴度。
1.11 Western blot采集健康猪外周血,利用淋巴细胞分离液分离猪外周血单个核细胞,然后利用磁珠分选分离猪NK细胞。将分离的猪NK细胞裂解,提取总蛋白作为目的蛋白样,制备SDS-PAGE凝胶,加样后电泳直到样品电泳至胶底。电泳结束后,用经甲醇活化过的PVDF膜进行转膜。5%脱脂奶粉室温封闭2 h,将获得的兔抗opNCRs多克隆抗体分别以其最高稀释倍数进行稀释后孵育PVDF膜,4℃过夜后,PBST清洗3次。HRP标记羊抗兔IgG室温震荡孵育2 h,PBST清洗3次,使用化学发光剂在暗室中进行显影。
1.12 流式细胞术采集健康猪外周血,分离猪外周血单个核细胞,将其稀释为106个细胞/支,以100 μL PBS重悬,分别加入抗猪CD3单克隆抗体、抗猪CD8单克隆抗体以及制备的兔抗opNCRs多克隆抗体,室温孵育30 min,PBS清洗2次,分别加入FITC标记的羊抗兔IgG抗体,室温孵育30 min,PBS清洗2次,离心后以100 μL PBS重悬,流式细胞仪检测。
2 结果
2.1 3种猪pNCRs胞外域预测结果在NCBI检索确定pNCR1、pNCR2和pNCR3的mRNA编码序列分别为NM_001123143.1、XM_021098670.1和EU282355.1。使用在线软件TMHMM预测pNCR1、pNCR2和pNCR3的胞外域,结果显示:pNCR1的胞外域为1~255 aa,pNCR2的胞外域为1~347 aa,pNCR3的胞外域为1~95 aa(图1)。将在线软件预测结果与人NCRs的胞外域信息比对后,确定pNCR1的胞外域为1~255 aa、pNCR2的胞外域为1~192 aa、pNCR3的胞外域为1~95 aa。
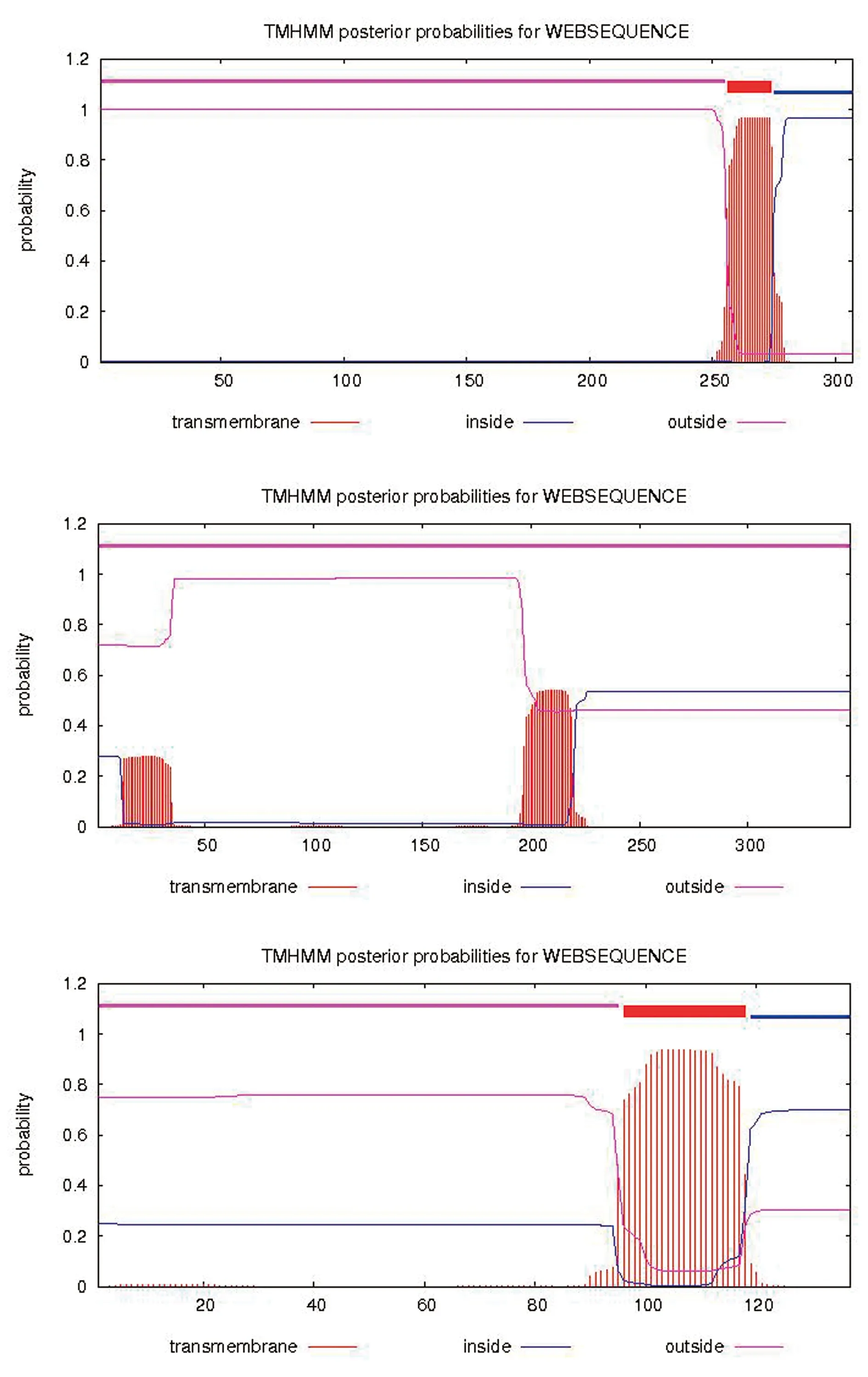
transmembrane.跨膜域;inside.胞内域;outside.胞外域图1 pNCR1、 pNCR2、pNCR3胞外域分析结果
2.2 重组表达载体pET-opNCR1、pET-opNCR2、pET-opNCR3构建与鉴定结果PCR扩增目的基因pNCR1、pNCR2和pNCR3胞外域序列后,分别连接至pET-32a质粒上,涂板挑取阳性克隆菌落扩大培养后提取质粒,利用双酶切和测序鉴定重组质粒构建情况。结果如图4,5所示,PCR扩增获得了pNCR1、pNCR2和pNCR3胞外域编码基因,分别在约765,576和285 bp处出现特异性条带,与预期片段大小一致(图4);将重组质粒进行双酶切鉴定,分别在约5 000,765,576和285 bp处出现特异性条带,与预期片段大小一致(图5);最后经测序,结果与NCBI上公布的猪pNCR1、pNCR2和pNCR3序列一致,表明重组表达载体pET-opNCR1、pET-opNCR2、pET-opNCR3构建成功。

M.DL2000 DNA Marker;1,2.opNCR1的PCR结果;3,4.opNCR2的PCR结果;5,6.opNCR3的PCR结果图4 opNCR1、opNCR2和opNCR1基因扩增产物

M.1 kb plus DNA Marker;1,2.pET-opNCR1的酶切鉴定;3,4.pET-opNCR2的酶切鉴定;5,6.pET-opNCR3的酶切鉴定图5 重组载体双酶切鉴定结果
2.3 重组蛋白opNCR1、opNCR2及opNCR3诱导表达及纯化结果将构建的pET-opNCR1、pET-opNCR2、pET-opNCR3重组表达载体在大肠杆菌Rosetta表达系统中诱导表达,并将表达产物经由磁珠纯化,SDS-PAGE鉴定目的蛋白opNCR1、opNCR2和opNCR3表达及纯化结果。结果如图6~8所示,目的蛋白opNCR1、opNCR2和opNCR3均被成功诱导表达,其中opNCR1主要存在于包涵体中,而opNCR2和opNCR3在表达上清和包涵体中均存在;将opNCR1、opNCR2和opNCR3经由磁珠纯化后分别获得了大小为约48,41和30 kDa的纯化目的蛋白。计算opNCR1、opNCR2和opNCR3蛋白的得率分别为38.3%,11.2%和12.8%。
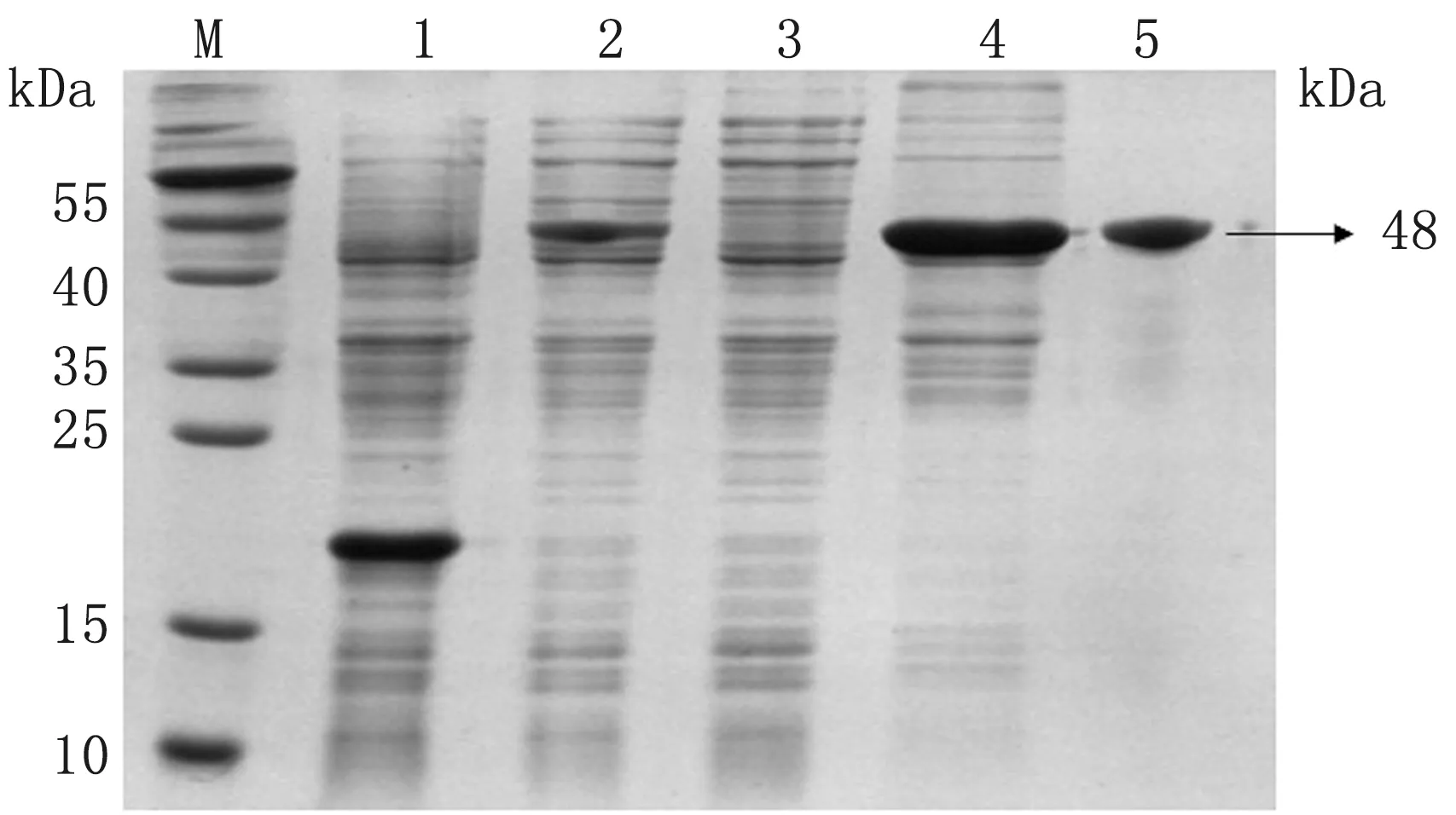
M.DNA Marker;1.pET-32a空载诱导;2.pET-opNCR1蛋白诱导后全菌;3.pET-opNCR1蛋白诱导后上清;4.pET-opNCR1包涵体;5.纯化的opNCR1蛋白。下同图6 重组载体蛋白表达鉴定结果
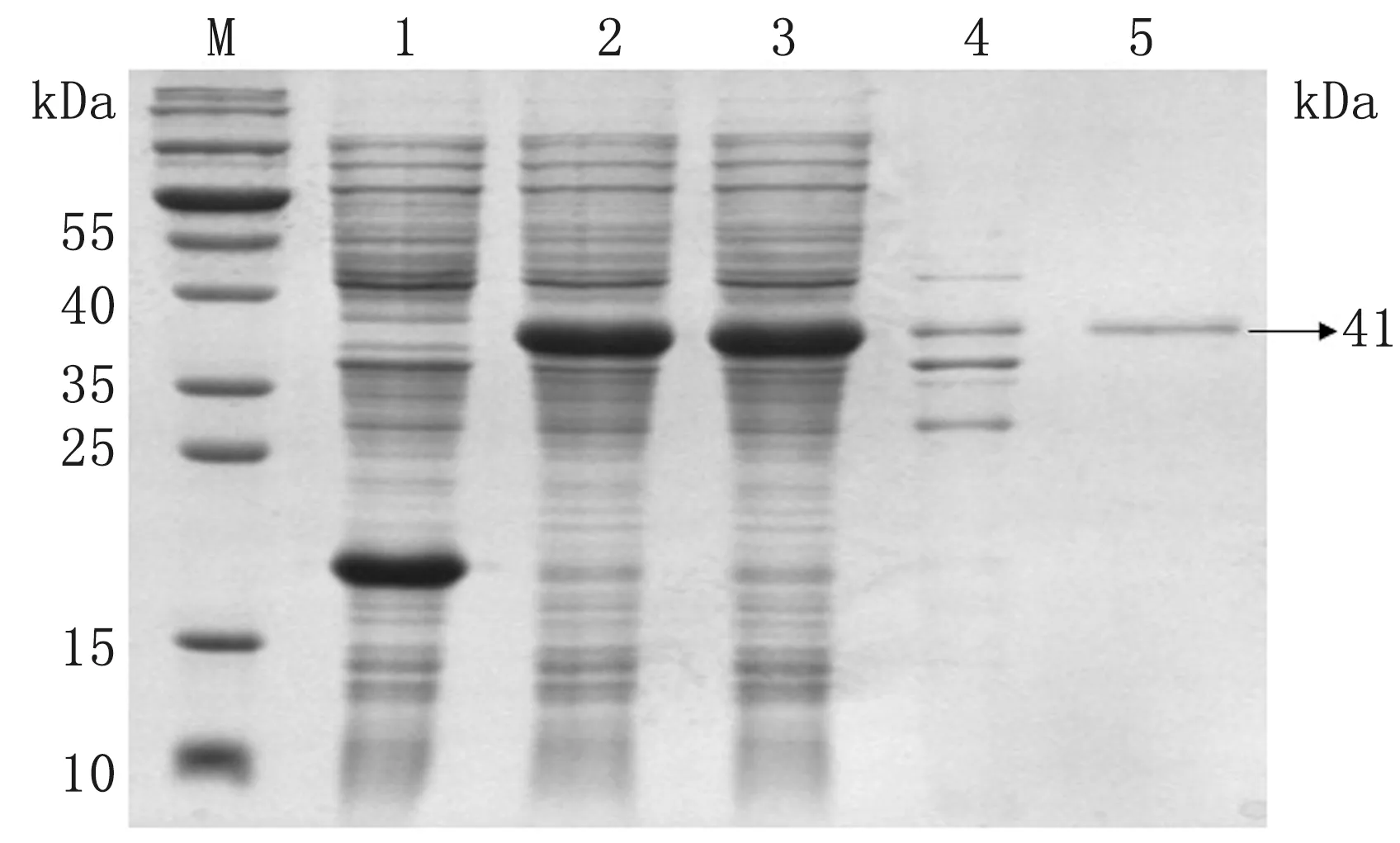
图7 重组载体蛋白表达鉴定结果
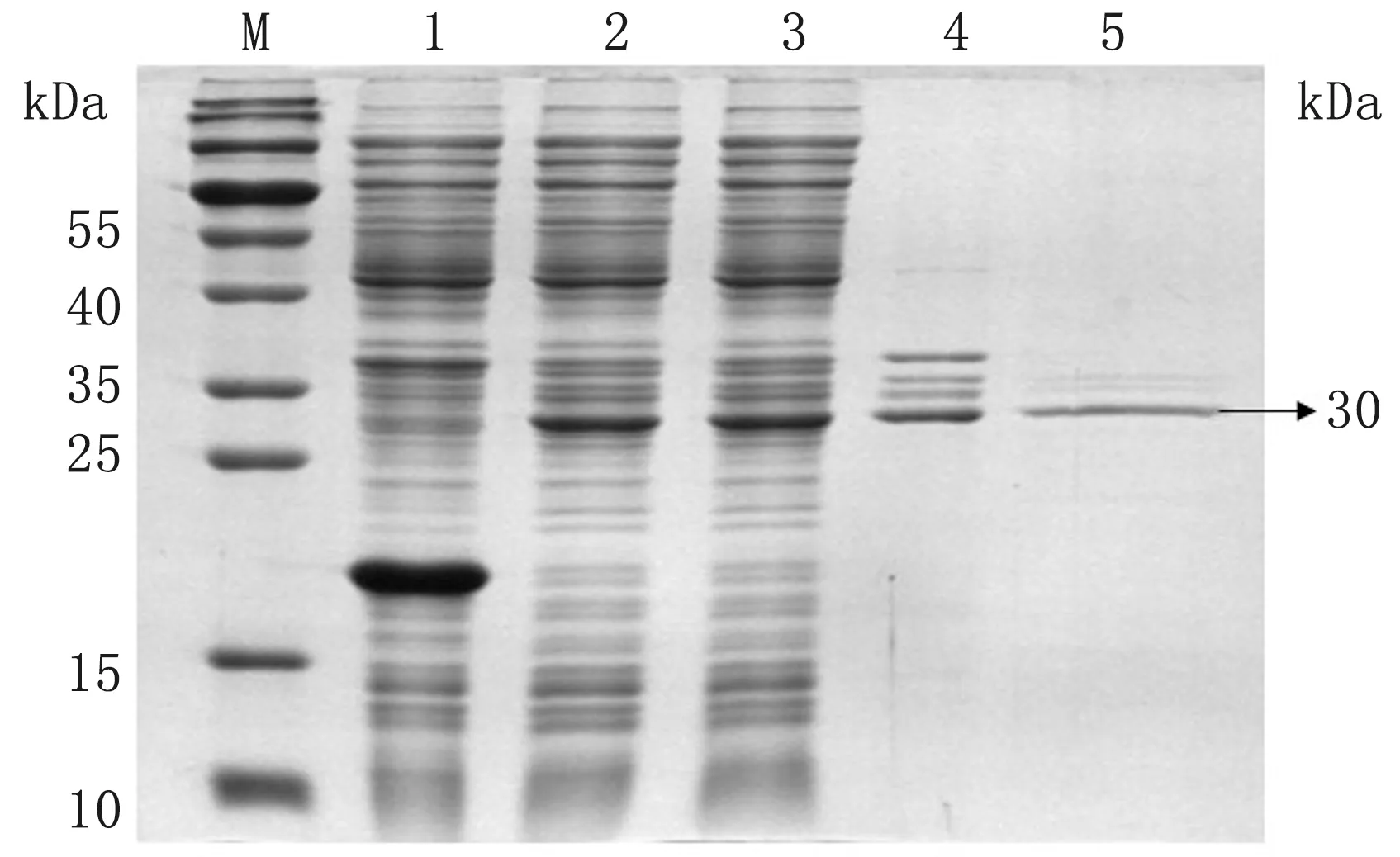
图8 重组载体蛋白表达鉴定结果
2.4 抗体效价检测结果将纯化的重组opNCR1、opNCR2和opNCR3目的蛋白分别免疫新西兰白兔后,收集血清,间接ELISA检测获得的opNCR1、opNCR2和opNCR3多克隆抗体效价。结果如图9所示,获得的兔抗opNCR1、opNCR2和opNCR3多克隆抗体的效价分别达到1∶25 600,1∶12 800和1∶25 600,表明获得的兔抗opNCR1、opNCR2和opNCR3多克隆抗体均具有较高的效价。
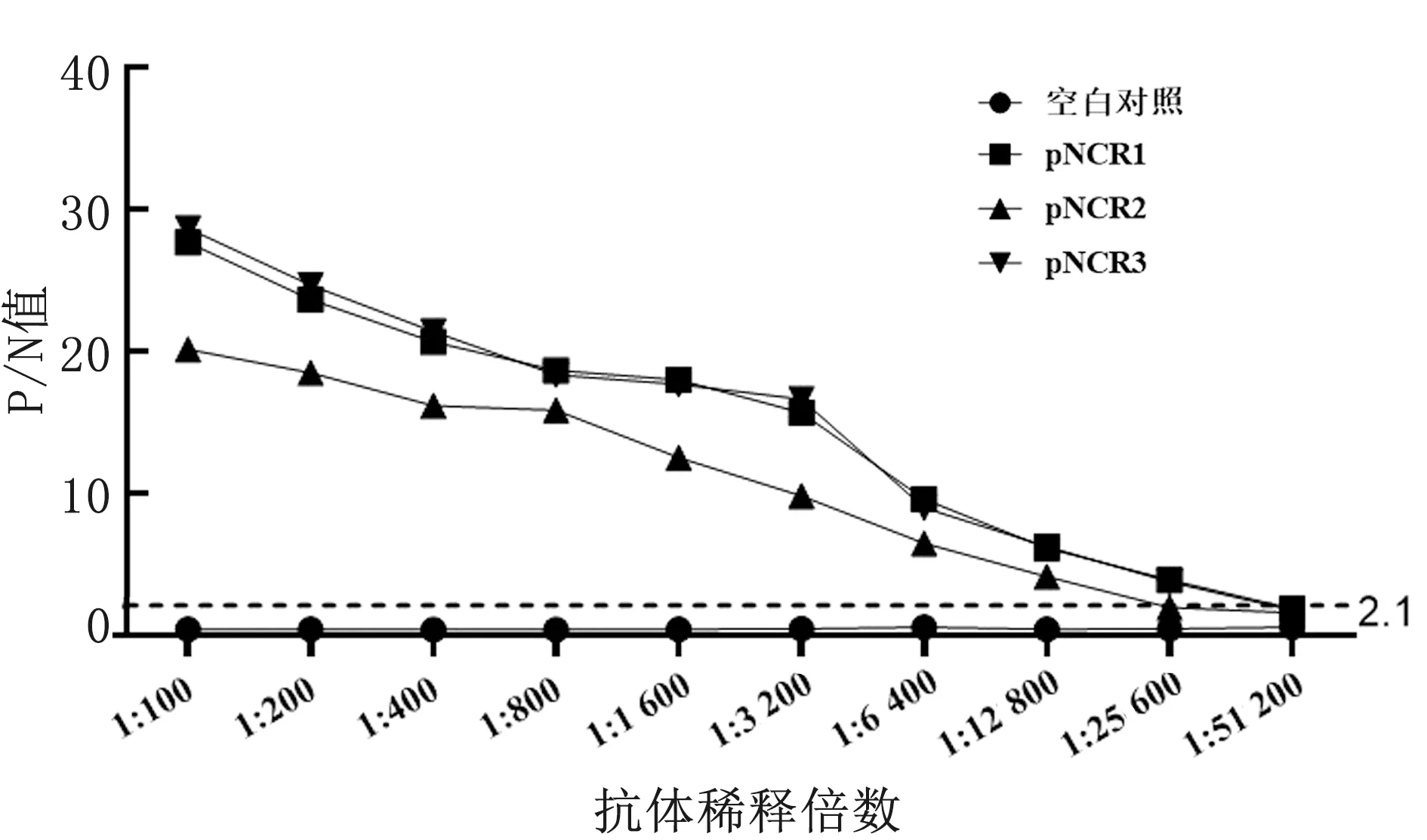
P/N值为检测孔与阴性孔的比值,当P/N≥2.1时的最大稀释倍数即为该多克隆抗体效价图9 抗体效价检测结果
2.5 Western blot检测结果将分离的猪NK细胞裂解并提取总蛋白后作为目的蛋白样,分别以1∶25 600,1∶12 800,1∶25 600稀释后的兔抗opNCR1、opNCR2和opNCR3多克隆抗体作为一抗,Western blot检测目的蛋白的表达并将试验结果进行灰度分析。结果显示,在NK细胞裂解蛋白中分别检测到了大小约为48,41和30 kDa的pNCR1、pNCR2和pNCR3特异性条带,而采用阴性血清对照(NC)均未检测到相应蛋白表达,灰度分析检测结果差异均极显著(图10)。
2.4.3流式细胞术检测结果 分离健康猪外周血单个核细胞,分别加入抗猪CD3单克隆抗体、抗猪CD8单克隆抗体、制备的兔抗opNCRs多克隆抗体及FITC标记的二抗,室温孵育后流式细胞仪检测。结果显示,流式细胞术均能检测到NK细胞表面pNCR1、pNCR2和pNCR3的表达,其中pNCR1和pNCR3阳性的NK细胞所占比例分别能达到60.2% 和59.5%,而pNCR2阳性的NK细胞所占比例仅为0.65%,但应用所制备的兔抗pNCR1、pNCR2和pNCR3多克隆抗体检测到NK细胞表面的pNCR1、pNCR2和pNCR3表达水平均显著高于阴性血清(图11)。

A.流式细胞术检测结果;B.pNCRs阳性率统计结果;*和**.分别代表抗opNCRs多克隆抗体相比阴性血清(NC)结果差异显著(P<0.05)和差异极显著(P<0.01)图11 流式细胞术检测检测NK细胞pNCRs表达结果

A.pNCR1检测结果及灰度分析结果;B.pNCR2检测结果及灰度分析结果;C.pNCR3检测结果及灰度分析结果;**.代表抗opNCRs多克隆抗体相比阴性血清(NC)结果极显著(P<0.01)图10 Western blot检测NK细胞pNCRs表达结果
3 讨论
NCRs是NK细胞表面特有的标志物[13],在NK细胞调控淋巴细胞数量过程中发挥着重要的作用。获得性淋巴细胞减少症是通常由细菌或病毒等病原感染导致的一种伴有外周血淋巴细胞数量减少的综合征,使机体更易于被其它病原感染[14]。HIV是最常见的导致淋巴细胞减少症的病原,研究发现HIV感染机体后能上调NK细胞NCR2的表达,同时诱导CD4+T细胞高表达NCR2L,激活NK细胞进而杀伤CD4+T淋巴细胞,导致淋巴细胞减少[12]。同时,研究发现PCV2感染仔猪后,仔猪淋巴细胞数量减少[9];PRRSV可导致T细胞耗竭[10];ASFV感染早期淋巴细胞和单核细胞数量减少[11]。这些病原感染导致的淋巴细胞减少可能与被感染猪体内NK细胞的异常激活有关,但目前尚无制备pNCRs抗体的相关报道。因此,本研究通过pET-32a原核表达系统获得了opNCR1、opNCR2和opNCR3可溶性重组目的蛋白,免疫新西兰白兔后获得了兔抗opNCR1、opNCR2和opNCR3多克隆抗体,可用于Western blot和流式细胞术检测NK细胞pNCR1、pNCR2和pNCR3的表达。
NCRs可分为3个结构域:跨膜域、胞内域和胞外域。NCRs的胞外域即位于细胞外部的区段,是识别配体并传导信号的主要功能域,在NK细胞的活化过程中起着至关重要的作用[8]。NCR1是一种Ⅰ型跨膜糖蛋白,其细胞外部分有2个C2型Ig样区域,类似于白细胞免疫球蛋白样受体和杀伤抑制受体[15];NCR2是Ig超家族的成员,其特征是一个胞外的V型Ig样区域和一个细胞质尾部包含一个基于酪氨酸的免疫受体抑制基序[16];NCR3也是Ig超家族的成员,包含一个负责于配体结合的细胞外免疫球蛋白域,一个带正电荷的精氨酸残基的跨膜结构域和没有附加信号域的细胞内结构域[17]。目前的研究证实,人NK细胞可表达NCR1、NCR2和NCR3,而小鼠NK细胞仅表达NCR1,不存在NCR2和NCR3的同源基因[18]。因此本研究前期将检索到的pNCR1、pNCR2和pNCR3基因编码序列与人的同源序列进行了比对,pNCR1基因与人NCR1基因编码序列同源性为72%,pNCR2基因与人NCR2基因编码序列同源性为70.3%,pNCR3基因与人NCR3基因编码序列同源性为80%,pNCRs与人NCRs之间较高的同源性可能有助于预测和分析pNCRs的结构。随后,本研究通过在线软件预测了猪pNCR1、pNCR2和pNCR3的胞外域,结果显示pNCR1的胞外域为1~255 aa,pNCR3的胞外域为1~95 aa,而pNCR2的胞外域为其全长为1~347 aa,这显然与该蛋白的实际结构不符。因此,本研究参考人NCR2的胞外域信息,分析并确定了pNCR2的胞外域应为1~198 aa。
有研究表明,在人体内,NCR1和NCR3在静息和激活的NK细胞上均有表达,而NCR2只有在NK细胞被激活后才被诱导表达[19]。但是,NCR1、NCR2和NCR3均被证明能介导NK细胞对病毒感染靶细胞的识别和激活NK细胞,从而杀死靶细胞。例如,新城疫病毒感染的靶细胞上NCR1和NCR2的配体表达上调,激活NK细胞,从而杀伤靶细胞[20]。登革热病毒和西尼罗河病毒感染的细胞中,病毒囊膜蛋白转位至靶细胞表面,被NK细胞的NCR2识别,激活NK细胞并杀伤靶细胞[21]。本研究利用制备的兔抗opNCRs多克隆抗体检测健康猪NK细胞表面NCRs表达时发现,在健康猪的NK细胞表面pNCR2表达丰度特别低,这和上述文献报道中,NCR2只在被激活的NK细胞上表达的结果一致[19]。表明在猪NK细胞中,NCRs的表达与人的同源蛋白具有高度的相似性。综合上述结果,本研究成功获得猪opNCR1、opNCR2和opNCR3多克隆抗体,将为进一步研究猪的pNCR1、pNCR2和pNCR3生物学功能以及揭示猪的一些重要病毒致病机制奠定基础。

