基于PMA-mqPCR同时检测阿胶制品中沙门氏菌和金黄色葡萄球菌
◎ 梁涛波,龙 慧,王 丹,仉 薇,占忠旭,吴 鑫
(1.江西省食品检验检测研究院,江西 南昌 330001;2.南昌市疾病预防控制中心,江西 南昌 330038)
阿胶是一种重要的药食同源物质[1],能用于中药治疗患者,也用于食品领域生产制造各种阿胶制品,如即食阿胶糕、阿胶红糖茶等。有研究表明,阿胶用于食品生产在加工、运输和储存过程中容易受到微生物污染[2-3],尤其是小作坊生产的产品其微生物安全应当予以重视[4]。根据近年来的研究调查显示,沙门氏菌在1996—2015年引起166起食物中毒事件,造成8 996人感染[5],金黄色葡萄球菌在2003—2015年引起86起食物中毒事件,造成2 431人感染[6],这两种致病菌引起的食品微生物污染尤为严重。我国食品安全国家标准明确规定了这两种病原菌的限量标准,其中沙门氏菌不得检出,而且一些阿胶制品的企业标准也有明确规定。因此,准确检测阿胶制品中是否携带有活的上述致病菌及其数量,对于及时控制因其导致的感染危害具有重要意义。
目前致病菌活菌检验最常用的方法是传统培养检测法,但该方法程序繁杂、耗时长,样本中可能含有杂菌而产生竞争性抑制,也存在对持留菌、休眠菌及代谢异质菌无法成功培养的缺陷,实际操作中可能会发生漏检等情况。随着活菌的快速检测新技术不断出现,研究者们将细菌是否具有新陈代谢活性进而产生生物活性物质,或是否具有完整的细胞结构作为判断活菌的标准,相继开发了ATP生物发光法、免疫学方法、mRNA检测法、死菌/活菌荧光染色法、流式细胞术以及PCR方法等其他活菌检测方法[7-8]。近年来,也有研究者将PCR与核酸交联染料结合用于致病菌活菌检测[9],其检测灵敏度高、特异性强,而且能够实现多重检测,满足不同目标菌的同时检测[10-11]。基于此,本研究根据沙门氏菌和金黄色葡萄球菌特异性基因设计引物和探针、优化反应条件,建立多重荧光定量PCR检测体系,并结合叠氮溴化丙锭(Propidium Monoazide,PMA)预处理实现活菌检测。本研究建立的PMA-mqPCR为检测阿胶制品中活的常见致病菌提供了新参考,对控制阿胶制品的微生物安全具有重要意义。
1 材料与方法
1.1 试剂与仪器
脑心浸出液和营养琼脂(北京陆桥技术股份有限公司)、Premix Ex Taq™(宝日医生物技术(北京)有限公司)、恒温水浴锅(上海智城分析仪器制造有限公司)、高速离心机(赛默飞世尔科技)、恒温培养箱(上海一恒科技有限公司)和荧光定量PCR仪(伯乐生命医学产品(上海)有限公司,CFX96 Touch)。
1.2 菌株和培养
本研究选取了10株标准细菌,菌株信息及来源见表1,包含目标菌4株:沙门氏菌(2株),金黄色葡萄球菌(2株);非目标菌6株:大肠埃希氏菌(2株)、铜绿假单胞菌(1株)、蜡样芽孢杆菌(1株)、粪肠球菌(1株)和克罗诺杆菌(1株)。所有的菌株分别在脑心浸出液和营养琼脂(北京陆桥技术股份有限公司)中进行复苏和纯化培养,然后接种在脑心浸出液中获取菌悬液。取1 mL细菌悬液放置在金属浴中80 ℃热处理10 min,得到沙门氏菌和金黄色葡萄球菌的死菌悬液,并进行平板涂布,确定不存在活菌。
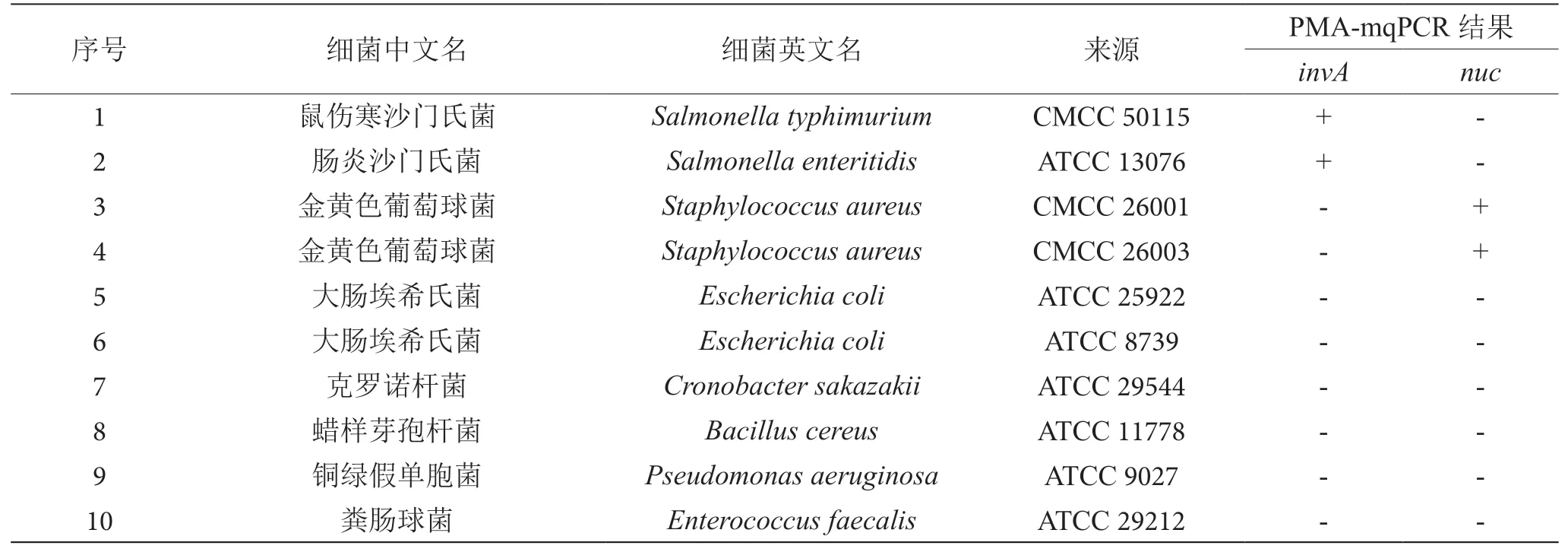
表1 菌株信息及来源表
1.3 引物和探针设计
根据NCBI数据库提供的invA(沙门氏菌)和nuc(金黄色葡萄球菌)序列,使用Beacon designer 8软件设计引物和探针,并通过BLAST进行特异性比对,表2为本研究使用的引物和探针序列,引物和探针序列委托通用生物系统(安徽)有限公司合成。
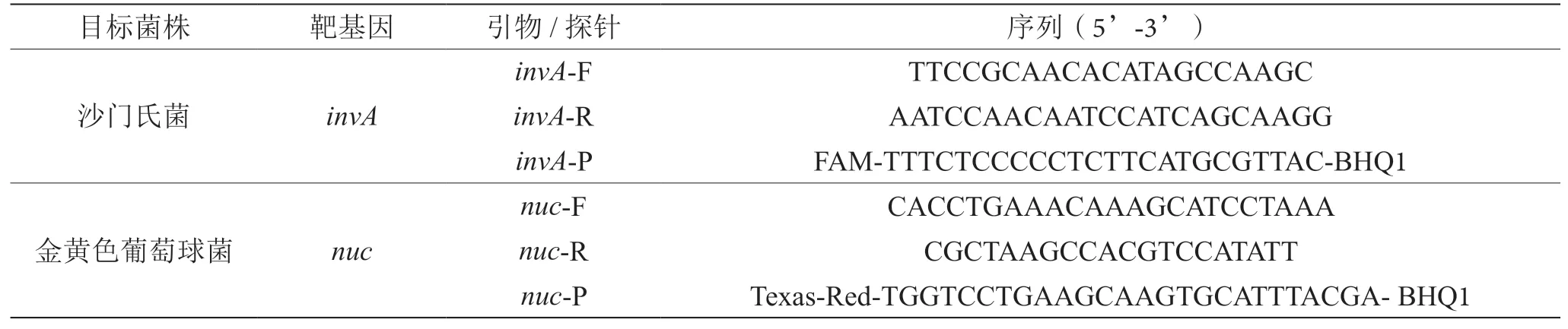
表2 引物和探针序列表
1.4 PMA浓度的优化
准备浓度为1 mg·mL-1的PMA溶液,取不同体积的PMA加入浓度为108CFU·mL-1沙门氏菌和金黄色葡萄球死菌和活菌中,使得PMA终浓度为0 μg·mL-1、10 μg·mL-1、20 μg·mL-1、30 μg·mL-1和40 μg·mL-1,随后将其放置在暗处室温孵育5 min,取出放置在冰盒上,并使用500 W卤素灯在距离样品管20 cm处曝光5 min,其间每隔30 s进行轻微振动,然后使用1×PBS缓冲液清洗2次,去除多余未交联的PMA,最后重悬在200 μL超纯水中,并使用水煮法提取基因组DNA[12]。不同浓度PMA处理组获取的基因组DNA用于qPCR扩增,并通过Ct值确定最佳的PMA浓度。
1.5 mqPCR方法的建立
qPCR反应体系为25 μL:12.5 μL Premix Ex Taq™(Takara),0.5~1.0 μL invA-F(10 μmol·L-1)、0.5~1.0 μL invA-R(10 μmol·L-1),0.5~1.0 μL invA-P(10 μmol·L-1),0.5~1.0 μL nuc-F(10 μmol·L-1)、0.5~1.0 μL nuc-R(10 μmol·L-1),0.5~1.0 μL nuc-P(10 μmol·L-1),
DNA模版各2 μL。反应程序:95 ℃ 5 min 预变性,95 ℃ 15 s变性,60 ℃ 30 s退火和延伸,40个循环,在退火和延伸阶段采集荧光信号。通过梯度qPCR优化退火和延伸温度,温度范围设置为55~65 ℃,并根据不同温度对应的相对荧光单位(RFU)大小,确定最佳的退火和延伸温度。
1.6 灵敏度评价
取过夜培养的目标菌株,经过PMA预处理后,采用水煮法提取基因组DNA,并使用10倍梯度稀释法获取浓度101~108CFU·mL-1的基因组DNA。通过对目标菌基因组DNA进行mqPCR,并根据扩增结果以Ct值为纵坐标,细菌浓度为横坐标建立标准曲线,确定PMA-mqPCR在纯培养液中的检测灵敏度。
通过对阿胶制品进行加标检测,进一步探究PMA-mqPCR方法检测实际样品中沙门氏菌和金黄色葡萄球菌的可行性。准备25 g阿胶制品加入225 mL 1×PBS缓冲液中制成样品悬液,并且使用培养法确定样品悬液不存在沙门氏菌和金黄色葡萄球菌。制备的加标样品悬液分别接种沙门氏菌和金黄色葡萄球菌,使其终浓度为107CFU·mL-1,然后进行PMA预处理,并使用水煮法提取基因组DNA。通过10倍梯度稀释获取不同浓度的基因组DNA,并进行mqPCR扩增,确定PMA-mqPCR在加标样中的检测灵敏度。
1.7 特异性评价
选取4株目标菌、6株非目标菌进行纯化培养,获取菌悬液,利用水煮法提取基因组DNA,然后对基因组DNA进行qPCR扩增,确定方法的特异性。
1.8 活菌检测
准 备500 μL浓 度 为107CFU·mL-1沙 门 氏 菌 和金黄色葡萄球菌活菌悬液,分别加入500 μL细菌浓度为100CFU·mL-1、102CFU·mL-1、104CFU·mL-1、108CFU·mL-1的死菌悬液,制备死活菌混合液,然后进行PMA预处理、基因组DNA提取,最后通过mqPCR扩增,比较各组Ct值评价活菌检测性能。
2 结果与分析
2.1 PMA浓度的优化
PMA浓度是影响活菌检测的重要条件,合适的浓度能够最大程度抑制死菌DNA扩增,因此本研究探究了PMA浓度对死菌的抑制效果,优化结果见图1。根据图1a结果,当PMA浓度从0 μg·mL-1增加到30 μg·mL-1时,死菌处理组的Ct值逐渐升高,30 μg·mL-1增加到40 μg·mL-1的Ct值趋于稳定,图1b金黄色葡萄球菌PMA处理浓度的优化结果与图1a结果相似,综合考虑抑制死菌DNA最佳扩增效果,选取PMA浓度为30 μg·mL-1为最优浓度。

图1 PMA浓度的优化结果图
2.2 退火温度的优化
反应体系的退火温度是影响qPCR扩增效果的关键因素,合适的退火温度能够极大地提高扩增效率和检测灵敏度,为此本研究优化了反应体系的退火温度,结果如图2所示。图2a是invA基因(沙门氏菌)退火温度优化的结果,当退火温度从55.0 ℃到57.0 ℃时,相对荧光单位逐渐增加,退火温度从57.0 ℃到65.0 ℃时,相对荧光单位逐渐降低,图2b是nuc基因(金黄色葡萄球菌)退火温度优化结果,综合考虑invA和nuc基因扩增的退火温度优化结果,最终选取57.0 ℃为mqPCR的最佳退火温度。
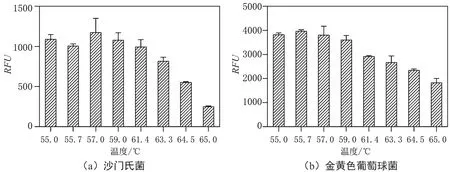
图2 退火温度的优化结果图
2.3 mqPCR体系的建立
mqPCR体系是多重检测的基础,为实现沙门氏菌和金黄色葡萄球菌同时检测提供了可能,体系建立结果如图3所示。通过优化引物和探针浓度、退火温度等反应条件,确认多重检测体系为25 μL,包含:12.5 μL Premix Ex Taq™,0.75 μLinvA-F(10 μmol·L-1)、0.75 μLinvA-R(10 μmol·L-1),0.5 μLinvA-P(10 μmol·L-1),0.5 μLinvA-F(10 μmol·L-1)、0.5 μLinvA-R(10 μmol·L-1),0.5 μLinvA-P(10 μmol·L-1),DNA模版各2 μL,超纯水5 μL。反应程序为:95 ℃ 5 min预变性,95 ℃ 15 s变性,57 ℃ 30 s退火和延伸,40个循环。
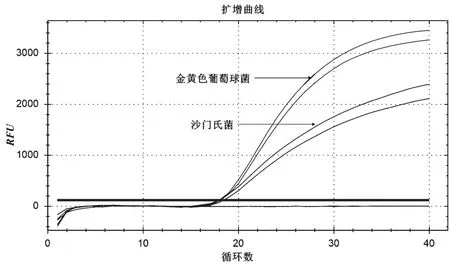
图3 多重体系的建立图
2.4 检测性能
为评价PMA-mqPCR同时检测沙门氏菌和金黄色葡萄球菌的检测性能,本研究对纯菌液中的目标菌株进行了检测,以确定方法的检测灵敏度。纯菌液检测限结果见图4a,其中沙门氏菌的检测限为102CFU·mL-1,且在102~108CFU·mL-1具有良好的线性相关性(R2=0.997 5),标准曲线为y=-3.09x+42.83;金黄色葡萄球菌的检测限为101CFU·mL-1,且在101~108CFU·mL-1具 有 良 好 的 线 性 相 关 性(R2=0.997 2),标准曲线为y=-3.076x+39.38。
为评价PMA-mqPCR检测实际样品的能力,本研究对阿胶制品进行加标检测,以确定该方法的实际应用效果。人工加标检测结果见图4b,其中沙门氏菌的检测限为103CFU·mL-1,且在103~107CFU·mL-1具有良好的线性相关性(R2=0.998 6),标准曲线为y=-2.977x+42.86;金黄色葡萄球菌的检测限为103CFU·mL-1,且 在103~107CFU·mL-1具 有良好的线性相关性,(R2=0.998 8),标准曲线为y=-3.468x+48.43。
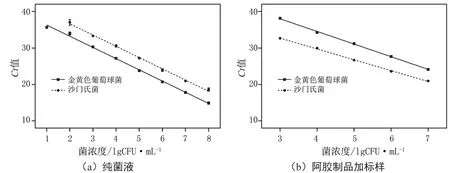
图4 检测限评价结果图
2.5 特异性评价
为评价PMA-mqPCR检测不同细菌的选择性,本研究选取了4株目标菌株,6株非目标菌进行特异性验证。特异性结果如表1所示,其中invA基因只能扩增沙门氏菌基因组DNA,非目标菌无阳性结果,nuc基因只能扩增金黄色葡萄球菌基因组DNA,非目标菌无阳性结果。结果表明,本研究建立的PMA-mqPCR具有良好的特异性,能够准确地同时检测沙门氏菌和金黄色葡萄球菌。
2.6 活菌检测能力
为探究PMA用于活菌检测的效果,本研究分别在107CFU·mL-1活菌液中加入等体积的100CFU·mL-1、104CFU·mL-1、106CFU·mL-1和108CFU·mL-1死菌液。活菌检测结果如图5所示,各组Ct值基本持平,其中沙门氏菌活菌回收率为95.70%(104CFU·mL-1)、96.53%(106CFU·mL-1)、105.62%(108CFU·mL-1),金黄色葡萄球菌的回收率分别为100.60%(104CFU·mL-1)、97.63%(106CFU·mL-1)、96.74%(108CFU·mL-1),综合考虑各组Ct值以及回收率,表明本研究建立的PMA-mqPCR具有较好的活菌检测效果。
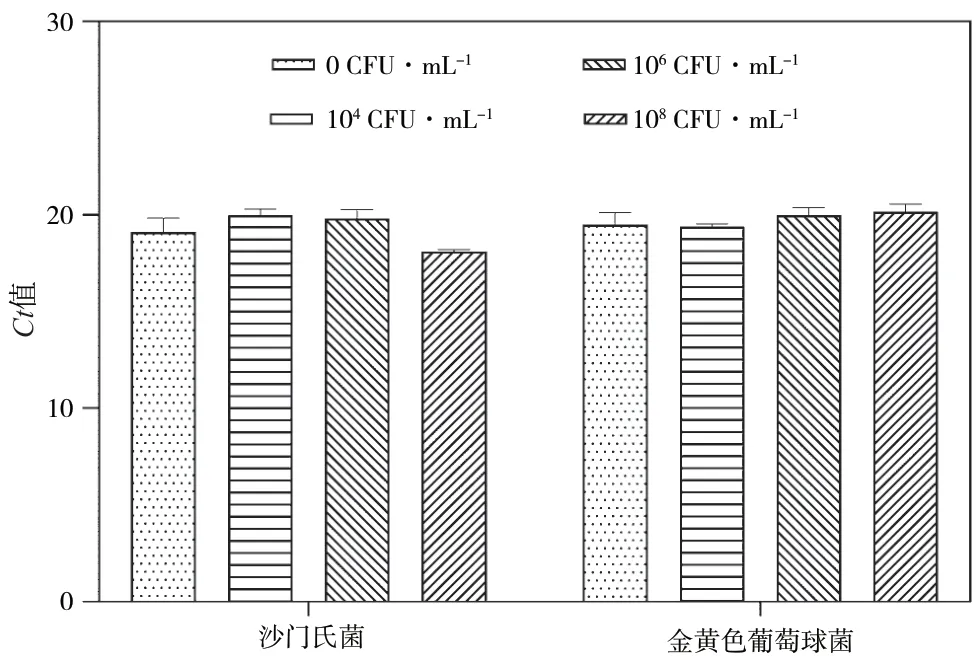
图5 活菌检测效果图
3 结论和讨论
本研究根据沙门氏菌和金黄色葡萄球菌的特异性基因设计引物和探针,结合PMA预处理,建立多重荧光PCR活菌检测体系,在最优条件下,PMA-mqPCR用于纯菌液中沙门氏菌的检测限为102CFU·mL-1,金黄色葡萄球菌的检测限为101CFU·mL-1,阿胶制品加标样的检测限均为103CFU·mL-1。通过PMA预处理,结合多重荧光检测体系,能够实现同时对多种致病菌活菌检测,而且活菌回收率高。
目前致病菌活菌检测技术应用最广泛、最简单的是传统培养法,通过一系列的增菌、选择性培养、生化鉴定实现活菌检测,但这种方法不光费时费力,而且对一些处于非可培养状态的细菌无法鉴定[13]。本研究根据死活菌细胞膜的完整度不同,利用核酸交联染料PMA无法进入细胞膜完整的活细菌,死菌细胞膜不完整使得PMA能够跨过细胞膜与细菌基因组DNA发生不可逆结合[14],通过提取细菌基因组DNA用于qPCR扩增,死菌基因组DNA无法成功变性使其不能延伸,而活菌DNA不受影响,实现活菌检测。
荧光定量PCR用于致病菌检测,靶基因的选择及引物和探针设计直接关系到检测体系的特异性和灵敏度,选择合适的靶基因和设计适用于多重检测引物和探针至关重要。本研究分别选取沙门氏菌invA基因和金黄色葡萄球菌nuc基因为靶基因,其中invA基因编码沙门氏菌III分泌系统InvA蛋白[15]、nuc基因编码金黄色葡萄球菌的耐热核酸酶[16],并且有研究报道invA[17]和nuc[18]分别是沙门氏菌和金黄色葡萄球菌的特异性基因。本研究通过Beacon designer软件设计引物和探针,结果显示引物和探针的Tm值均符合多重荧光定量PCR设计标准,并且多重检测体系的建立也进一步证明引物和探针设计的合理性,为实现沙门氏菌和金黄色葡萄球菌的同时检测奠定基础。

