乳矿物盐的安全性与功能性评价
◎ 曹 亮,黄 莉
(东北农业大学,黑龙江 哈尔滨 150028)
乳矿物盐又称乳钙、乳清矿物质浓缩物、乳清钙,其以乳清为原料,经过纯化、超滤和干燥等工艺制成[1]。乳矿物盐含有磷酸钙、蛋白质、乳糖及锌、钠、钾、镁等丰富的营养成分,较利于人体吸收利用,作为一种新钙源被广泛应用[2]。
乳矿物盐因其独特的生理功能,其相关产品的开发应用前景必然广阔。因此,本文以大鼠和小鼠为研究对象,分别进行为期90 d和30 d的灌胃实验,分析乳矿物盐对大鼠食物利用率与大鼠胃、肠、脾、肝脏等组织病理学的影响。同时,分析乳矿物盐对小鼠免疫功能的影响,为其全面利用和开发乳矿物盐提供科学指导和理论依据,为开发功能保健食品提供借鉴。
1 材料与方法
1.1 材料与试剂
乳矿物盐由阿尔拉食品原料贸易(北京)有限公司(原丹麦阿拉食品原料有限公司北京代表处)提供,0525BG乳钙,乳白色粉状;体重65~80 g清洁级SD大鼠80只,雌雄各半,由军事医学科学院实验动物中心提供,许可证号:SCXK(军)2012-0003;体重16~20 g清洁级昆明种小鼠200只,雌雄各半,由军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2002-0001;饲料由军事医学科学院实验动物中心公司提供,许可证号:清洁级,SCXK-(军)2002-018。
注射用墨汁、刀豆蛋白A(ConA)、噻唑蓝(MTT)、2,4二硝基氟苯(DNFB)、丙酮、麻油、绵羊红细胞(SRBC)、生理盐水、鸡红细胞、、甲醇、Giemsa染色、YAC-1细 胞、Hanks液(pH=7.2~7.4)、RPM11640完全培养液、乳酸锂、碘硝基氯化四氮唑(INT)、吩嗪二甲酯硫酸盐(PMS)、烟酰胺腺嘌呤二核苷酸(NAD)、Tris-HCL缓冲液(pH=8.2)、1% NP40、台酚兰、1 mol·L-1盐酸和酸性异丙醇等。
1.2 仪器与设备
SHANDON EXCELSIOR全自动密封脱水机;电热鼓风干燥箱;Olympus IX71倒置显微镜;8 mm直径打孔器;微量血凝试验板;2-16K通用离心机;RT-6100酶标仪;96孔培养板;Co-150 CO2培养箱;UV-1800紫外可见分光光度计;电子天平;显微镜。
1.3 受试样品及配制
乳矿物盐的成人日推荐量为2.4 g,即0.04 g·kg-1BW(成人体重以60 kg计)。安全性评价实验组按日推荐量的25倍、50倍、100倍配制受试样品浓度分别 为1.0 g·mL-1、2.0 g·mL-1和4.0 g·mL-1的 低、中、高剂量剂量组;功能性评价实验组按照乳矿物盐受试物成人日推荐量的5、10和30倍,设3个剂量组为0.2 g·mL-1、0.4 g·mL-1、1.2 g·mL-1;以去离子水作为对照组,临用前称取矿物质盐加去离子水至1.0 mL,混匀。
1.4 动物分组与给药
1.4.1 安全性评价实验组
参照《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》,按性别随机分成4组、每组10只。试验设3个剂量组为1.0 g·kg-1BW、2.0 g·kg-1BW、4.0 g·kg-1BW,去离子水为空白对照。试验期间单笼喂养,自由进食饮水,室温为20~23 ℃,湿度为45%RH~52%RH,每天定点灌胃(上午8:00),连续灌胃90 d后,记录饲料撒漏量,每周记录一次体重和2次食物摄入量。喂养90 d后对肝、肾、脾、胃肠、睾丸和卵巢做病例学检查。
1.4.2 功能性评价实验组
200只小鼠随机分成5大组,再分成4小组,每小组10只小鼠,设3个剂量组为0.2 g·kg-1BW、0.4 g·kg-1BW、1.2g·kg-1BW,分别高、中、低剂量组,单笼喂养,室温为20~23 ℃,湿度为45%RH~52%RH,每天定点灌胃(上午8:00),连续灌胃90 d后,分别进行试验。
1.5 安全性评价实验组实验方法
对选取的安全性实验组的大鼠连续灌胃90 d,进行食物利用率、病理组织学检查。食物利用率公式如下:

1.6 功能性评价实验组实验方法
1.6.1 小鼠体重的测定标记每只小鼠,对小鼠定点测定体重,记录小鼠的初始体重和终期体重。
1.6.2 免疫器官系数
参照张勇[3]的实验方法。小鼠适应性喂养3 d,随机分成对照组、高剂量组、中剂量组和低剂量组,每组10只。按每日1mL·kg-1BW连续灌胃,连续30 d,末次给药6 h后,脱颈椎处死小鼠,称量小鼠体重,取腹腔液后,无菌分离肝脏和脾脏,称重。免疫器官系数计算如下:
免疫器官系数(g/g)=免疫器官重量/体重
1.6.3 碳廓清实验
末次给药6 h后,注射印度墨水并记时2 min、10 min,分别取内眦静脉丛血20 μL,并立即加入2 mL 0.1% Na2CO3溶液中,以Na2CO3溶液为空白对照,在600 nm处测定OD值,将小鼠处死后,取出肝脏、脾脏后称重,计算吞噬指数a:

1.6.4 抗体生成细胞检测
颈椎脱臼处死小鼠,取脾脏,经磨碎、过滤、离心,洗涤后悬浮于8 mL Hanks液中。取25 μL脾细胞悬液、50 μL 10% SRBC、0.5 mL 0.5%的琼脂糖Hanks液混合培养基迅速混匀,倾倒于6 cm已刷琼脂薄层的平皿上,于CO2培养箱中温育1.5 h,然后加入用SA缓冲液稀释的补体(1∶8),温育3 h后,计数溶血空斑数[4]。
1.6.5 血清溶血素的测定
将小鼠摘除眼球采血,2 000 r·min-1离心10 min进行血清的分离,用生理盐水稀释不同倍数并置于微量血凝板内,每孔100 μL,加入同体积的0.5%(v/v)的SRBC悬液,混匀,37 ℃温箱孵育3 h,观察血球凝集程度[5]。
1.6.6 ConA诱导的小鼠淋巴细胞转化实验
参照史顶聪等[6]的方法,并做适当修改,将上述细胞悬液经离心,调整浓度为3×106个/mL。分两孔加入24孔培养板中,每孔1 mL,一孔加75 μL ConA液,另一孔为对照,培养72 h。培养68 h时,每孔吸取0.7 mL上清液,并加入同体积不含小牛血清的RPMI 1640培养液与50 μL的MTT,继续培养。培养结束后,分装于96孔培养板,3个平行孔,于570 nm处测定OD值。
1.6.7 迟发型变态反应(DTH)检测
末次给药6 h后,对小鼠腹部皮肤约3 cm×3 cm进行脱毛处理,用50 μL的DNFB溶液涂抹均匀致敏;5 d后,再以10 μL的上述溶液均匀涂抹小鼠右耳。24 h后,颈椎脱臼处死小鼠,剪下左右耳,用打孔器取下直径8 mm的耳片称重,按下列公式计算左右耳肿胀度差[7]:
左右耳肿胀度差=右耳重量-左耳重量
1.6.8 小鼠腹腔巨噬鸡红细胞实验(半体内法)
腹腔注射1 mL 20%鸡红细胞悬液。30 min后,颈椎脱臼处死动物,固定在鼠板上剪开腹壁皮肤,经腹腔注入2 mL生理盐水,转动鼠板1 min。吸出1 mL腹腔洗液,滴于2片载玻片上,移置37 ℃温育30 min。生理盐水漂洗、晾干、固定、染色、蒸馏水漂洗晾干。在油镜下阅片计数,计算吞噬率和吞噬指数。
1.6.9 小鼠NK细胞活性测定(乳酸脱氢LDH测定法)
参照Cao等的方法[8],试验前24 h将靶细胞传代培养,Hanks液洗3次,RPMI1640培养液调整细胞浓度为4×105个/mL。经离心、稀释、染色,调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(效靶比为50∶1),于37 ℃、5% CO2培养箱中培养4 h,然后将培养板离心(1 500 r·min-1)5 min,每孔吸取上清液100 μL置于96孔培养板中,并加入同体积的LDH基质液,反应3 min,每孔加入30 μL 1 moL·L-1的HCL,于490 nm处测定OD值。
1.7 数据处理
所有试验的平行试验次数至少3次。实验数据以SPSS软件进行单因素方差分析。经方差齐性检验,方差齐的实验数据采用LSD法进行统计分析,方差不齐的实验数据采用Tamnane法进行统计分析。当概率值≤0.05时,判定为统计学显著。
2 结果与分析
2.1 乳矿物盐的安全性分析
2.1.1 对大鼠食物利用率的影响
表1 为乳矿物盐对大鼠食物利用率的影响,由表1可知,随着灌胃时间的增加,各剂量组的食物利用率整体呈降低趋势,雄性大鼠的食物利用率普遍高于雌性大鼠的食物利用率。雄性大鼠的食物总利用率在34%左右,而雌性大鼠的食物总利用率在24%左右,与同性别同时期的对照组比较,大鼠的食物利用率无显著差异,说明乳矿物盐对大鼠的食物利用率无影响。

表1 乳矿物盐对大鼠食物利用率的影响表(单位:%)
2.1.2 乳矿物盐对大鼠病理组织学的影响
经观察各剂量组大鼠未发现明显病变,且生化指标未见异常,因此仅针对对照组及高剂量进行组织病理学检查。表2为大鼠胃、肠、脾、卵巢和睾丸病理检测结果,表3为大鼠肝脏与肾脏病理检测结果,由表2、表3可知,正常肝小叶结构存在,肝细胞无明显肿胀及颗粒变性,个别肝细胞浆内出现少许细小的脂肪空泡,呈轻度脂肪变,脂肪变干细胞呈散在小灶分布,范围小。干细胞无坏死改变,少数肝小叶、肝汇管区见淋巴细胞等炎细胞浸润,无纤维组织增生,胆管未见异常;胃和十二指肠黏膜完整,无明显出血、坏死、糜烂、溃疡及炎细胞浸润,无明显腺体增生萎缩改变;肾皮髓质结构清楚,肾小管无明显肿胀及空泡变性,个别肾间质中有灶性炎细胞浸润,个别肾髓质部可见小囊肿;脾白髓、红髓结构清楚,白髓、红髓无明显扩张或萎缩现象;睾丸曲细精管正常,可见各级生精细胞及成熟精子;卵巢发育正常,可见各级卵泡和成熟黄体。综合可知,以上病理学改变仅个别动物中发生,各组标本病理变化无明显差异,因此,乳矿物盐对各脏器未引起病理学改变。
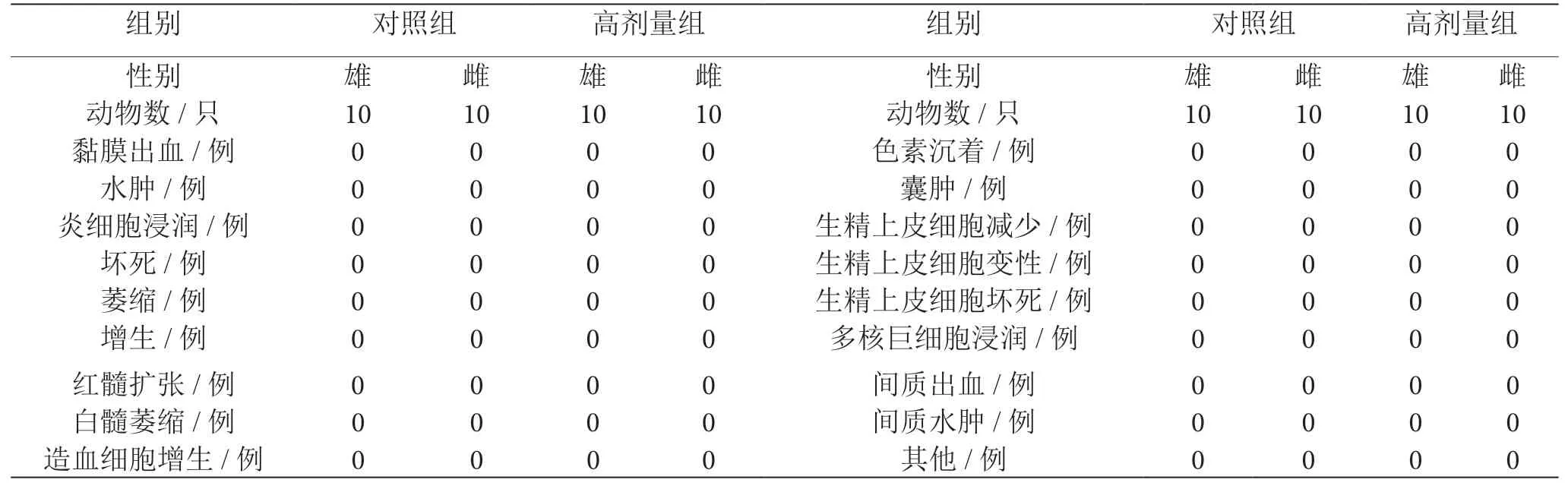
表2 大鼠胃、肠、脾、卵巢和睾丸病理检测的结果表

表3 大鼠肝脏与肾脏病理检测结果表(单位:例)
2.2 乳矿物盐的功能性分析
2.2.1 对小鼠体重的影响
图1 为乳矿物盐对小鼠体重的影响,由图1可知,与对照组比较,高、中、低剂量组小鼠的体重均无显著差异(P>0.05),说明了乳矿物盐对小鼠体重无影响。
图1 乳矿物盐对小鼠体重的影响图
2.2.2 对小鼠免疫器官系数的影响
正常情况下,健康小鼠的各脏器与体重的比值相对恒定。当动物染毒后,会引起受损脏器重量发生改变,从而引起脏体比的变化。表4为各剂量组胸腺指数、脾指数的测定结果,由表4可知,与对照组比较,高、中、低各剂量组均无显著差异(P>0.05)。从统计学方法分析说明了乳矿物盐对小鼠的免疫器官指数无影响,未能促进免疫器官的增长。

表4 胸腺指数、脾指数的测定表
2.2.3 细胞免疫功能测定
表5 为ConA诱导的小鼠淋巴细胞转化试验与迟发型变态反应实验结果,由表5可知,与对照组比较,低剂量组小鼠淋巴细胞转化OD值差异不显著(P>0.05),而中剂量组和高剂量组小鼠淋巴细胞转化OD差值明显高于对照组,差异显著(P<0.05)。中剂量组与高剂量组小鼠左右耳肿胀度明显高于对照组,差异显著(P<0.05),而低剂量组与对照组相比,差异不显著(P>0.05)。说明乳矿物盐具有增强细胞免疫的功能。

表5 细胞免疫功能测定表
2.2.4 体液免疫功能测定
表6 为血清溶血素与抗体生成细胞检测实验结果,由表6可知,各剂量组小鼠抗体积数与对照组比较,差异均不显著(P>0.05)。与对照组比较,高剂量组的溶血空斑数具有显著的差异(P<0.05),中、低剂量组与对照组比较,差异不显著(P>0.05)。

表6 体液免疫功能测定表
2.2.5 单核-巨噬细胞功能测定
表7 为小鼠的碳廓清试验与巨噬细胞吞噬试验结果,由表7可知,高、中、低各剂量组小鼠碳廓清吞噬指数a与对照组比较,差异均不显著(P>0.05)。高、中、低各剂量组小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率、转换值及吞噬指数与对照组比较,差异不显著(P>0.05)。

表7 单核-巨噬细胞功能测定表
2.2.6 NK细胞活性测定
表8 为NK细胞活性测定结果,由表8可知,低剂量组、中剂量组与高剂量组小鼠NK细胞活性明显高于对照组,差异显著(P<0.05)。NK细胞活性测定结果为阳性,提示乳矿物盐可以增强机体免疫功能。

表8 NK细胞活性测定表
3 结论
乳矿物盐营养成分丰富,是公认的优质有机钙源,易于人体吸收,有利于身体健康。本研究经90 d实验发现,与对照组比较,各剂量组对大鼠的食物利用率均无统计学意义(P>0.05)。同时,乳矿物盐高剂量组对大鼠的胃、肠、脾、卵巢、睾丸、肝脏以及肾脏等器官均未引起病理学反应,说明乳矿物盐对大鼠身体无不良影响,食用安全性较高;经功能性实验发现,乳矿物盐对小鼠的体重、免疫器官系数与体液免疫功能均无显著影响,但对小鼠的细胞免疫功能和NK细胞活性等指标影响显著。根据《保健食品检验与评价技术规范》(2003年版)的规定,说明乳矿物盐具有提高人体免疫功能的作用,为其在食品、保健食品中的开发应用提供理论依据。

