沙棘无性系苗期对基质复水的响应
刘丽颖,胡建忠,殷丽强
(1. 沈阳农业大学林学院,辽宁 沈阳 1108663;2. 水利部沙棘开发管理中心,北京 100038;3. 山合林(北京)水土保持技术有限公司,北京 100038)
陆生植物在生长季节处于不断守望之中,降雨后随着土壤逐渐干旱,植物开始守望下一次降雨,本质上在土壤干旱—湿润交替之中生长,一些植物也因此形成了一定的抗旱性[1-2]。盆栽干旱胁迫试验是探讨植物抗旱性的一种重要手段,因此有关研究偏向于适宜盆栽的作物和牧草等草本植物[3-4],而林木因其特征只适合于苗期开展研究[5-6]。中国沙棘Hippophae rhamnoidessubsp.sinensis、蒙古沙棘H.rhamnoidessubsp.mongolica、中亚沙棘H.rhamnoidessubsp.turkestanica是我国自然分布和人工栽培的一些生态经济型树种,其中尤以中国沙棘种植范围遍及三北大部分地区,有关干旱胁迫方面业已开展了一些研究[7-9],为掌握其抗旱性能奠定了良好的基础。国内目前栽培的蒙古沙棘多为引自俄罗斯等国的大果沙棘,以果大、果柄长和刺少为其主要特征,经济效益突出,不足之处是其抗旱性较差;而中国沙棘恰恰相反,抗旱性较强,但经济产量较低。因此两个亚种间的杂交就于20世纪90年代开始了,并诞生了一些蒙中杂交沙棘无性系[10]。因此,选择一些蒙中杂交沙棘无性系,开展干旱胁迫试验,研究基质复水效果,对于确定其适宜种植范围、开展沙棘工业原料林[11]的合理配置以及经营管理都十分重要。正是基于上述考虑,本文开展了对蒙中杂交沙棘无性系在苗期干旱胁迫后基质复水的研究。
1 材料与方法
试验地选在沈阳农业大学校内试验场。
试验所用3个沙棘无性系为杂雌优2号、杂雌优10号和杂雌优54号,均为蒙古沙棘做母本、中国沙棘做父本杂交选育而来的雌性无性系品种。
试验采用盆栽试验方法。当年早春采集沙棘硬枝插条,平均长20 cm,平均基径5.8 mm。3月下旬,插条生根粉浸泡4 h,扦插在花盆中。花盆深33 cm,容积约8 L;扦插基质为培养土与石英砂体积比1:1的混合物。每个无性系扦插30盆,每盆2株。扦插花盆随机摆放到温室大棚中,喷壶定量浇水保持花盆基质相对湿度80%培养,至8月16日开展试验。
试验设计4个处理,每个处理6盆。1)对照:正常水分,基质相对湿度80%;2)中度胁迫:保持中度干旱,基质相对湿度50%;3)重度胁迫:保持重度干旱,基质相对湿度30%;4)复水:重度干旱胁迫后复水,先保持基质相对湿度30%至30 d,9月15日喷壶浇水恢复基质相对湿度达到对照水平,即80%。试验开始前7 d,拟定胁迫处理的花盆停止浇水,自然降低基质相对湿度至设计所需水平。试验期间每日9:00—10:00采用称重法保持基质的设计含水量,即每天称量1次基质水分自然消耗量,然后浇水补充至设定标准,将基质含水量控制在设定范围内,同时准确记录加水量。
9月20日,用LI-6400光合仪(美国,Li-Cor公司)测定叶片光合速率、蒸腾速率、气孔导度、胞间CO2浓度和气孔限制值等光合指标,每个处理测定3个样株,样叶为梢顶向下第5~8片叶,测定时间为9:00—11:00。9月21日,采样测定叶片酶活性,每个处理采集3个样株,样叶为梢顶向下第5~12片叶。超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、过氧化物酶(POD)4类抗氧化酶的活性,采用Chakraborty等[12]和李合生等[13]的方法测定。9月25日,采样称量法测定叶片质量,扫描仪测定叶片面积,每个处理测定3个样株各50个叶片,样叶为梢顶向下第5~14片叶。9月28日,用钢卷尺、游标卡尺分别测定苗高、地径,每个处理测定10~12个样株。同日,采样称重法测定单株生物量,每个处理测定4个样株。
所有数据均用SPSS 20.0进行统计分析。计算3个重复测定值平均数用于结果分析。
2 结果与分析
参试3个杂雌沙棘无性系受干旱胁迫和及时复水后,其不同表现主要通过对其树高、地径、生物量的测定(表1)来直接反映,而其机理则根据对叶性状及其光合特性响应、抗氧化酶活性等来进行分析。
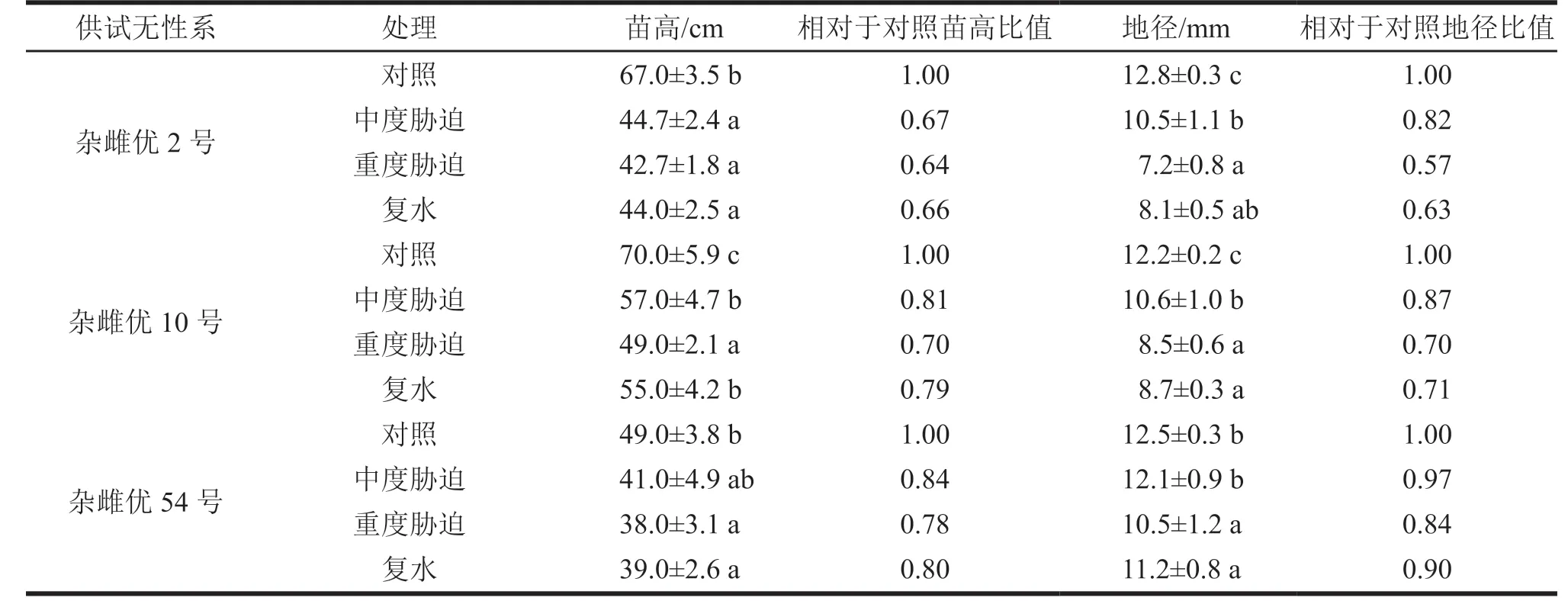
表1 生长指标统计
2.1 高径生长的响应
2.1.1 树高生长对复水的响应
杂雌优2号在中度、重度干旱胁迫和复水处理下的苗高分别为44.7 cm、42.7 cm、44.0 cm,与对照树高67.0 cm相比均有明显降低(p≤0.05),而中度、重度干旱胁迫和复水处理之间差异不显著(p≤0.05)。表明重度干旱胁迫致使杂雌优2号苗高显著降低,仅占对照苗高的63.7%;而经过重度干旱胁迫再复水处理后,苗高从重度胁迫的42.7 cm提高到44.0 cm,虽略有提高,但并没有发生显著改变。
杂雌优10号在中度和重度干旱胁迫处理下的苗高分别为57.0 cm、49.0 cm,仅相当于对照70.0 cm的81.4%、70.0%,苗高随着干旱胁迫的加剧而显著降低(p≤0.05)。复水处理后,杂雌优10号的苗高达55 cm,明显高于重度干旱胁迫处理下的49 cm(p≤0.05),接近中度干旱胁迫处理水平的57 cm。
杂雌优54号的苗高在重度干旱胁迫后降低至38.0 cm,降低22%;复水处理后,杂雌优54号的苗高从38 cm增加到39 cm,并未发生显著变化(p≤0.05)。
2.1.2 地径生长对复水的响应
杂雌优2号在中度和重度干旱胁迫处理的地径分别为7.2 mm和10.5 mm,相当于对照的82%和57%,其地径随着干旱胁迫的加剧而显著降低(p≤0.05);复水处理后,杂雌优2号的地径达8.1 mm,明显高于重度干旱胁迫的7.2 mm(p≤0.05),但仍低于中度干旱胁迫处理10.5 mm。
杂雌优10号的地径在中度、重度干旱胁迫下分别降低至10.6 mm和8.5 mm,相当于对照的87%和70%;复水处理后地径增至8.7 mm,但并未发生显著改变(p≤0.05)。
杂雌优54号的地径在中度干旱胁迫下达12.1 mm,比对照(12.5 mm)略有降低,但差异并不显著(p≤0.05);而在重度干旱胁迫下,地径降低至10.5 mm,相当于对照的84%。经过复水处理后,杂雌优54号的地径虽提高至11.2 mm,相当于对照12.1mm的90%,但与重度干旱胁迫处理(10.5 mm)之间的差异并不显著(p≤0.05)。
2.2 生物量对复水的响应
表2列出了供试3个沙棘无性系在4种处理下的5个干物质占比测定值。杂雌优2号的枝占比、叶占比、根占比和株干物质总量,在干旱胁迫和复水处理后均发生了显著改变,主干占比在各处理之间没有发生显著改变(p≤0.05)。枝占比随着干旱胁迫的加剧,由对照的27.4%逐渐升高至中度胁迫时的31.7%,再到重度干旱胁迫时的33.9%,复水处理后降低至31.6%。叶占比在干旱胁迫后,先由对照的14.0%降低至中度胁迫时的13.7%,再到重度胁迫时的12.8%,而在复水处理后升高至14.4%(诸对比中的最高值)。根占比随着干旱胁迫的加剧,先由对照的9.9%增加到中度胁迫时11.0%,后下降至重度胁迫时的7.5%,经过复水处理后又升高至8.9%,其值介于对照和中度胁迫处理之间。株干物质总量随着干旱胁迫的加剧,由对照的32.5 g下降至中度胁迫时的22.5 g,后再显著下降至重度胁迫时的18.0 g,复水后升高至20.2 g,比重度胁迫处理增加了2.2 g,相当于增长了12%。
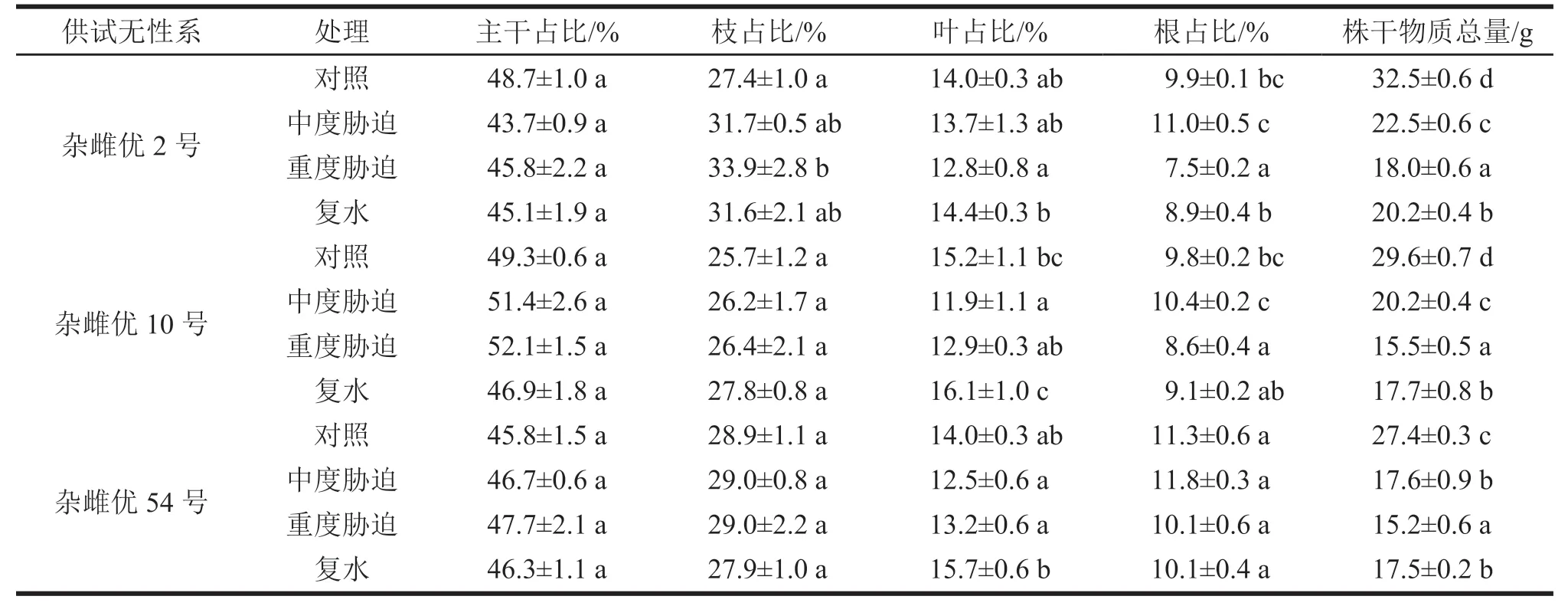
表2 干物质量不同处理变化
杂雌优10号的叶占比、根占比和株干物质总量,在干旱胁迫和复水处理后多发生了显著改变,主干占比和枝占比在各处理之间没有发生显著改变(p≤0.05)。叶占比在干旱胁迫后,由对照的15.2%降低至中度胁迫时的11.9%,再增加至重度胁迫时的12.9%,复水处理后继续增高至16.1%。根占比随着干旱胁迫的加剧,先由对照的9.8%增高至中度胁迫时的10.4%,又降低至重度胁迫时的8.6%,经过复水处理后又增长至9.1%。株干物质总量随着干旱胁迫的加剧,由对照的29.6%下降至中度胁迫时的20.2%,而继续降低至重度胁迫时的15.5%,而在复水处理后略微提升至17.7 g,相当于增长了14%。
杂雌优54号的叶占比和株干物质总量在干旱胁迫和复水处理后发生了显著改变,主干占比、枝占比和根占比在各处理之间没有发生显著改变(p≤0.05)。叶占比在干旱胁迫后,由对照的14.0%下降至中度胁迫时的12.5%,再略升高至重度胁迫时的13.2%,复水后长至15.7%。株干物质总量随干旱胁迫的加剧,由对照的27.4 g先下降至中度胁迫时的17.6 g,再继续下降至重度胁迫时的15.2 g,经过复水处理后显著增高至17.5 g,比重度干旱胁迫时增长了15%。
2.3 复水促进沙棘生长的原因分析
2.3.1 复水后沙棘叶性状的响应
杂雌优2号复水后叶干重达28.3 mg,较重度干旱胁迫条件下(24.7 mg)增加3.6 mg,相当于增长了14.6%,但也只占中度干旱胁迫条件下叶干重(32.0 mg)的88.4%。杂雌优10号复水后叶干重达23.3 mg,较重度干旱胁迫条件下(19.3 mg)增加4.0 mg,相当于增长了20.7%,但占中度干旱胁迫条件下叶干重(29.3 mg)的79.5%。杂雌优54号复水后叶干重达18.0 mg,较重度干旱胁迫条件下(16.7 mg)增加1.3 mg,相当于增长了7.2%,但占中度干旱胁迫条件下叶干重(19.3 mg)的93.3%(表3)。说明叶干重在复水后,较重度干旱胁迫条件下数值有所提升,但比中度干旱胁迫条件下的数值还是有所不及。

表3 叶性状不同处理变化
杂雌优2号复水后叶面积达3.2 cm2,与重度干旱胁迫处理下的3.0 cm2差异不显著,但显著低于中度干旱胁迫处理下的3.9 cm2(p≤0.05),占中度干旱条件下叶面积的82.1%。杂雌优10号复水后叶面积达3.0 cm2,较重度干旱胁迫下的2.5 cm2增加0.5 cm2,相当于增长了20.0%,但仍显著低于中度干旱胁迫处理下的3.9 cm2(p≤0.05),占中度干旱条件下叶面积的76.9%。杂雌优54号复水后叶面积达到了中度干旱胁迫处理水平的2.2 cm2。同样说明叶面积在复水后,不同无性系沙棘叶表现出不一样的变化。
2.3.2 复水后沙棘光合特性的响应
表4列出了供试3个沙棘无性系在4种处理下的5个叶片光合特性测定值。参试3个沙棘无性系光合速率平均值,复水后为19.14 μmol/(m2·s),高于在重度干旱胁迫条件下的6.27 μmol/(m2·s),也高于在中度干旱胁迫条件下的12.53 μmol/(m2·s),较为接近正常水分条件下的光合速率数值22.12 μmol/(m2·s)。对每一个杂雌沙棘无性系来说,复水后光合速率不仅显著高于重度干旱胁迫处理,而且还显著高于中度干旱胁迫条件下的光合速率值(p≤0.05)。

表4 叶片光合特性不同处理变化
参试3个沙棘无性系蒸腾速率平均值,复水后为3.65 mmol/(m2·s),高于在重度干旱胁迫条件下的1.11 mmol/(m2·s),也高于在中度干旱胁迫条件下的2.39 mmol/(m2·s),占正常水分条件下的蒸腾速率数值5.22 mmol/(m2·s)的69.9%。与光合速率一样,复水后蒸腾速率不仅显著高于重度干旱胁迫处理,而且还显著高于中度干旱胁迫条件下的蒸腾速率值(p≤0.05)。
参试3个沙棘无性系气孔导度平均值,复水后为0.19 mol/(m2·s),高于在重度干旱胁迫条件下的0.05 mol/(m2·s),也高于在中度干旱胁迫条件下的0.12 mol/(m2·s),占正常水分条件下的气孔导度数值0.26 mol/(m2·s)的73.1%,其中杂雌优2号甚至与对照处理差异不显著(p≤0.05)。可见,与前2个指标一样,复水后气孔导度不仅显著高于重度干旱胁迫处理,而且还显著高于中度干旱胁迫条件下的气孔导度值(p≤0.05)。
参试3个沙棘无性系胞间CO2浓度平均值,复水后为217.22 μmol/mol,接近重度干旱胁迫条件下的211.15 μmol/mol,高于中度干旱胁迫条件下的186.75 μmol/mol,较为接近正常水分条件下胞间CO2浓度平均值230.66 μmol/mol(占94.2%)。复水后杂雌优2号胞间CO2浓度与中度、重度干旱胁迫处理之间差异不显著(p≤0.05);杂雌优10号胞间CO2浓度达到最高值,显著高于对照和干旱胁迫处理(p≤0.05);杂雌优54号与重度胁迫处理之间差异不显著,但是显著高于中度干旱胁迫处理(p≤0.05)。
参试3个沙棘无性系气孔限制值平均值,复水后为0.45,低于在重度干旱胁迫条件下的0.53,也低于在中度干旱胁迫条件下为0.53,较为接近正常水分条件下的气孔限制值0.44。由于气孔限制值为逆性指标,与前3个正向指标不同,复水后气孔限制值既显著低于重度干旱胁迫处理,而且还显著低于中度干旱胁迫条件下的气孔限制值(p≤0.05)。
2.3.3 叶片抗氧化酶活性对复水的响应
在重度干旱胁迫又进行复水处理后,3个杂雌沙棘的4种抗氧化酶活性均显著低于重度干旱胁迫处理(p≤0.05);并且杂雌优2号和杂雌优10号的4种抗氧化酶活性同时均显著低于中度干旱胁迫处理,而杂雌优54号与中度干旱胁迫处理之间差异不显著(p≤0.05)。3个杂雌沙棘在受到干旱胁迫时,抗氧化酶(SOD、APX、CAT、POD)活性均会显著升高(p≤0.05),表明3个杂雌沙棘均具有一定抵抗干旱胁迫的能力。参见图1~图4,各对比间的关系看得更加明显。
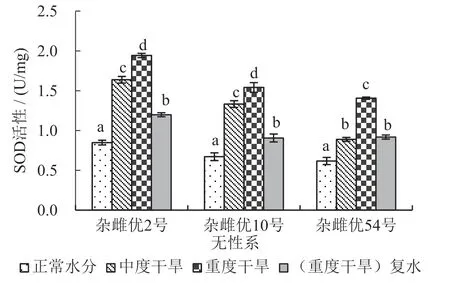
图1 不同处理SOD活性变化
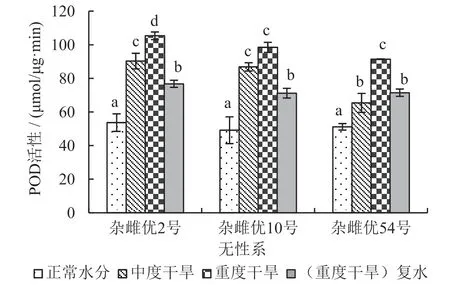
图2 不同处理POD活性变化
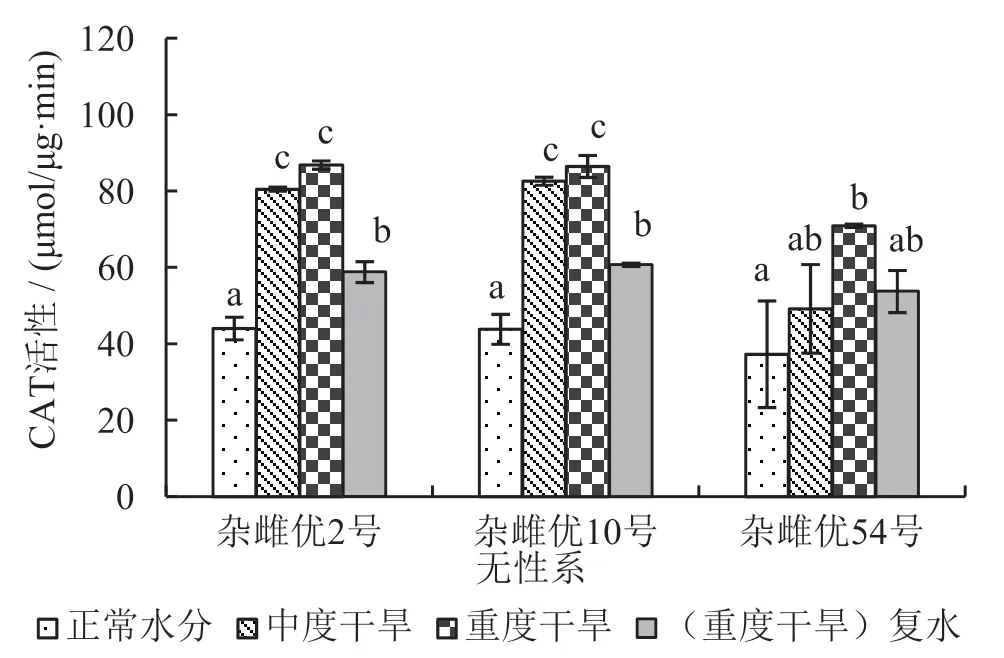
图3 不同处理CAT活性变化
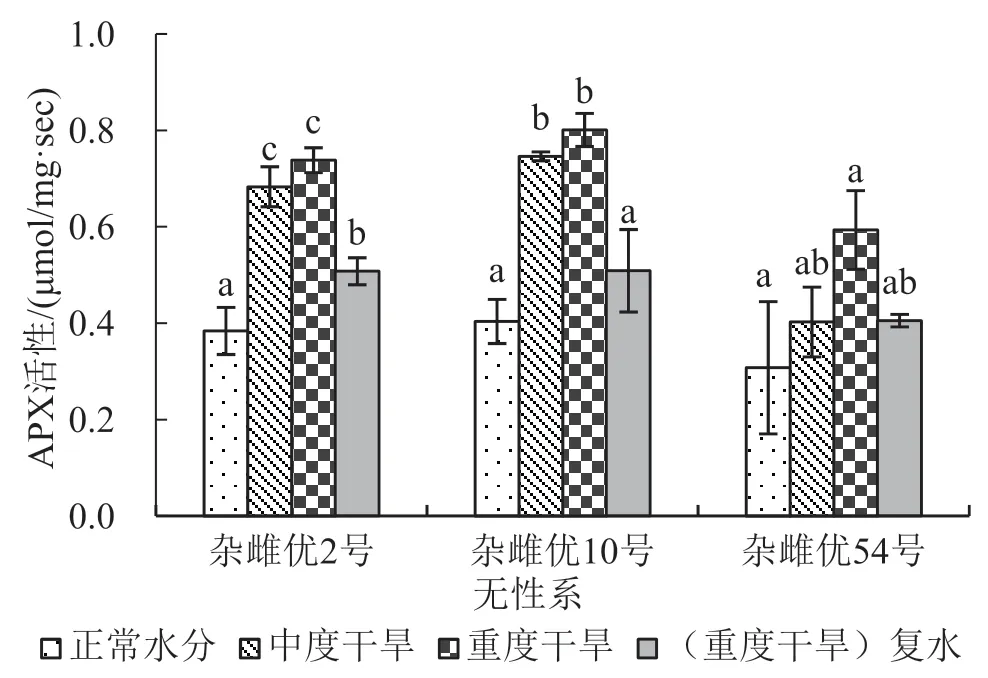
图4 不同处理APX活性变化
3 结论与讨论
植物对干旱的适应能力不仅表现在干旱胁迫过程当中,在胁迫复水后植物的生长、形态、生理等指标能否基本恢复,也是对植物逆境适应的重要体现[14],同时也是评价植物耐旱的重要方面。本研究发现,在基质相对湿度30%的重度干旱胁迫30 d后复水14 d,3个杂雌沙棘无性系的苗高和地径具有不同的响应。杂雌优2号和杂雌优54号复水后的苗高与重度干旱胁迫处理相比并未发生显著改变,而杂雌优10号复水后的苗高较重度干旱胁迫处理增高12.2%,且恢复至中度干旱胁迫处理水平;杂雌优2号复水后的地径较重度干旱胁迫处理增加12.5%,但仍低于中度干旱胁迫处理,而杂雌优10号和杂雌优54号复水后的地径与重度干旱胁迫处理相比并未发生显著改变。表明杂雌优2号径生长对复水的响应较敏感,杂雌优10号高生长对复水的响应较敏感,而杂雌优54号高生长和径生长对复水的响应均不敏感。
生物量分配策略是植物对环境响应的重要表现形式,植物通过调节自身地上和地下生物量来适应环境变化[15]。本研究发现,复水后约两周的时间,3个沙棘无性系的生物量较重度干旱胁迫处理增长了12.2%~15.1%。同时,不同无性系之间表现出不一样的生物量分配策略。复水处理后,杂雌优2号主要通过降低枝占比,同时提高叶占比和根占比以增大总生物量;杂雌优10号主要通过提高叶占比和根占比以增大总生物量;杂雌优54号主要通过提高叶占比以增大总生物量。光合特性分析结果对此给予了说明,杂雌优2号和杂雌优10号在复水后主要将光合产物用于补偿地上和地下部分生长,而杂雌优54号则将光合产物主要用于补偿地上部分生长。
复水的作用,首先会反映在行光合作用的器官—叶上面[16]。与光合作用相关的光合速率、蒸腾速率、气孔导度、胞间CO2浓度以及气孔限制值等指标,在复水后均得以改善[17]。复水后3个沙棘杂雌无性系均缓解了重度水分胁迫,并且迅速恢复到中等干旱胁迫状态,出现了向正常水分条件下有关光合、酶等指标特征值发展的趋势。复水后土壤水分条件得到改善,必然会促进沙棘叶的形态和叶片酶系统作用的充分发挥[18-19],从而在生长量上充分体现出来。本试验在复水后,杂雌优2号和杂雌优10号叶干重较重度干旱胁迫分别增加了14.6%和20.7%,杂雌优10号叶面积较重度干旱胁迫增长20.0%,而杂雌优54号叶干重和叶面积则均恢复到中度干旱胁迫水平。3个沙棘无性系的抗氧化酶活性较重度干旱胁迫处理均显著下降,并且向正常水分条件下的数值逼近。分析原因,复水后杂雌沙棘无性系拥有了正常的水分条件,解除了干旱胁迫的压力,抗氧化酶活性自然也就随之降低,并逐步接近正常水分条件下数值[20-21]。
本试验复水处理后的生长时间不长,只有约2周时间,但亦然使处于重度干旱胁迫条件下的生长值,接近中等干旱胁迫条件下的生长值。同时,3个杂雌沙棘无性系复水后与正常水分条件下相比,树高占66%~80%,地径占63%~90%,虽有一定差距,但复水能让沙棘得以生存并快速生长。充分说明了参试杂雌沙棘无性系有一定的抗旱性能,在自然情况下同样如遇1个月持续干旱情况,再遇降水或灌水,沙棘即可恢复生长,从而为生产实践中遭遇大旱情况采取灌水等措施提供了科学依据。
1985年底以来,我国在三北地区开展了有组织的沙棘资源建设和开发利用工作。35年来的实践和研究均表明,沙棘可耐一度程度的大气干旱,但对土壤水分有一定要求,低于一定阈值会生长不良甚至死亡。所以总体来看,沙棘是一种中生植物,它既非旱生,更不是沙生植物,不能人为故意拔高其抗旱性和适应性而无序发展。沙棘工业原料林的种植也一样需要依据适地适树原则,科学配置与维护,特别是依据其对干旱胁迫的响应策略,适时复水,才能维持其正常生长发育性能,实现其特有的生态经济价值,助推三北地区经济社会的高质量发展。

