脱氢表雄酮联合高脂饮食诱导建立小鼠多囊卵巢综合征模型的研究
彭洋洋,张怡,谢青贞
(武汉大学人民医院生殖医学中心,湖北省辅助生殖与胚胎发育医学临床研究中心,武汉 430060)
多囊卵巢综合征(PCOS)是育龄期妇女常见的生殖内分泌疾病之一,育龄期妇女中发病率约为8%~13%,以月经稀发/闭经、高雄激素血症和多囊卵巢为基本特征,且大多数患者常伴发肥胖、胰岛素抵抗、糖脂代谢紊乱等代谢异常,成为2型糖尿病、心脑血管疾病和子宫内膜癌发病的高危因素[1]。近年来,多项临床研究发现,PCOS患者罹患非酒精性脂肪肝(NAFLD)的风险高于健康对照组,且与肥胖、胰岛素抵抗、高雄激素血症及炎症反应等相关[2-3]。
PCOS作为一种难治性、异质性疾病,病因及发病机制复杂,且难以获取临床标本进行研究,因此建立一种理想的PCOS动物模型在相关病理生理机制研究及临床治疗指导中具有深远的意义。自1935年首次描述PCOS以来,已应用了许多方法构造PCOS啮齿动物模型,包括使用类固醇激素进行产前、青春期前及青春期后造模,应用雌激素、芳香化酶抑制剂、胰岛素(INS)联合人绒毛促性腺激素(HCG)及基因敲除/转基因小鼠等方式进行造模[4-5]。然而,目前尚缺乏PCOS小鼠动物模型构建的统一方法及标准;此外,关于PCOS小鼠动物模型中糖脂代谢、肝功能及肝脏结构变化也鲜有报道。本研究拟采用脱氢表雄酮(DHEA)联合高脂饲料诱导雌性 C57BL/6 小鼠建立 PCOS模型,并与传统的DHEA单一雄激素造模法进行比较,分析其生殖、代谢特征及肝脏组织病理变化,旨在寻找一种简便有效、更加符合人体PCOS病理特征的动物模型,为PCOS病因及发病机制研究提供更多研究模型。
材料与方法
一、实验动物
选取21日龄SPF级C57BL/6J小鼠30只(湖南斯莱克景达实验动物),体重为10~15 g,SPF级屏障环境饲养,饲养湿度为50%~70%,温度为(22±2)℃,光照和黑暗时间为12 h/12 h,自由饮水和摄食。实验动物许可证:WDRM动(福)第20200902号,所有动物实验操作过程符合美国国立卫生研究院(NIH)规定的实验动物福利和道德规定,且本研究实验方案已通过武汉大学人民医院动物实验伦理委员会审议批准。
二、主要试剂和仪器
DHEA(上海阿拉丁)、芝麻油(上海麦克林)、高脂饲料(北京华阜康)、精蛋白生物合成人胰岛素注射液(预混30R,诺和诺德),睾酮(T)、LH、FSH、胰岛素(INS)等ELISA检测试剂盒均购自中国武汉伊莱瑞特生物;血糖仪(590,江苏鱼跃)、组织脱水机(Donatello,DIAPATH,意大利)、石蜡包埋机(JB-P5,武汉俊杰电子)、石蜡切片机(RM2016,上海徕卡)、酶标仪(Flexstation3,MD,美国)、全自动生化分析仪(ADVLA 2400,西门子,日本)。
三、研究方法
1.造模与分组:小鼠适应性喂养3 d后,将30只小鼠按体重排序,采用随机数字表法,随机分为3组:对照组、DHEA组、DHEA+高脂饮食(DHEA+HFD)组,每组各10只。对照组:每日颈背部皮下注射芝麻油0.2 ml并给予普通饲料;DHEA组[6]:将DHEA按 60 mg·kg-1·d-1溶于0.2 ml芝麻油,每天颈背部皮下注射,并给予普通饲料,共21 d;DHEA+HFD组:在 DHEA注射给药基础上,每天给予60%高脂饲料喂养。
2.小鼠体重及动情周期监测:实验期间每3 d上午测量小鼠体重,监测小鼠体重增长情况。于实验第10天开始,每天上午固定时间行阴道拭子涂片,用0.9%生理盐水浸湿的无菌棉签,沿小鼠阴道壁涂抹并沿同一方向涂抹到载玻片上,持续10 d,于光学显微镜下观察阴道上皮细胞形态,并根据阴道涂片细胞变化特点划分为动情前期、动情期、动情后期和动情间期,监测各组小鼠动情周期变化。
3.腹腔内注射葡萄糖耐量实验和胰岛素耐量实验:治疗第19天禁食不禁饮12 h后进行腹腔内注射葡萄糖耐量试验(IPGTT),根据体重腹腔注射葡萄糖溶液(2 g/kg),分别于0、15、30、60、90和120 min采集尾静脉血,并用血糖仪测量血糖。治疗第20天禁食不禁饮6 h后进行胰岛素耐量试验(ITT),根据体重腹腔注射稀释后胰岛素溶液(0.75 U/kg),于上述相同时间点采集尾静脉血测量血糖。计算IPGTT及ITT葡萄糖反应曲线下总面积(AUC)。
4.小鼠血清检测:实验第21天全部小鼠禁食6 h后,采用乙醚吸入性麻醉,用尖头镊子摘取眼球,并采用EP管收集血液,4℃静置过夜,第2天4℃、3 000 rpm离心15 min后,取上清,-80℃冻存备用。部分血清进行ELISA检测:严格按照FSH、LH、T、FINS各试剂盒说明书操作,用酶标仪于450 nm波长下测定其OD值,并计算 LH/FSH 比值;部分血清使用全自动生化仪进行检测:(1)空腹血糖(FPG);(2)血脂四项:总胆固醇(TCHO)、甘油三脂(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL);(3)肝功能:谷丙转氨酶(ALT)、谷草转氨酶(AST)。计算稳态模型评估胰岛素抵抗指数(HOMA-IR)=FPG(mmol/L)×FINS(mU/L)/22.5。
5.小鼠卵巢组织学观察:采用颈椎脱臼法处死小鼠,解剖小鼠双侧卵巢,去除其表面的脂肪组织及覆盖包膜,以4%多聚甲醛固定24 h,常规脱水石蜡包埋,4 μm最大切面切片后进行苏木精伊红(HE)染色,脱水,透明中性树胶封片,显微镜下观察各组小鼠卵巢组织学变化。
6.小鼠肝脏组织学观察:选取小鼠肝右侧最厚一叶,同一部位切取大致相同体积肝组织1块,4%多聚甲醛固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,4 μm最大切面切片,HE染色后显微镜下观察各组小鼠肝脏组织学变化。取肝组织石蜡切片,行油红O染色,显微镜下观察肝组织脂质沉积情况,脂滴呈鲜红色,细胞核呈蓝色,红色面积越大代表脂肪沉积越严重。
四、统计学分析

结 果
一、小鼠体重及动情周期比较
造模前3组间平均体重比较无显著性差异(P>0.05),造模后的第12、15、18、21天,DHEA+HFD组和DHEA组小鼠的平均体重增加,均显著高于对照组(P<0.01),且DHEA+HFD组平均体重较DHEA组显著增加(P<0.01)(图1)。

同时段3组组间比较,**P<0.01
实验第10天开始行阴道涂片,观察小鼠动情周期变化。结果显示,对照组的阴道涂片可见规律的排卵周期,说明其动情周期规则;DHEA+HFD组及DHEA组均多见大片不规则形状的鳞状上皮细胞,提示动情周期紊乱、无规律排卵(图2)。
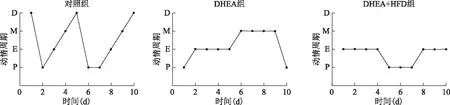
P:动情前期;E:动情期;M:动情后期;D:动情间期
二、小鼠卵巢HE病理改变
小鼠卵巢HE染色后显微镜下观察,DHEA+HFD组和DHEA组均观察到卵巢表面呈多囊样改变,黄体数量少于对照组,卵泡颗粒细胞层数减少。对照组卵巢内可见各级不同发育阶段的卵泡,偶见极少量囊性卵泡,且成熟卵泡结构完整,存在放射冠、卵丘及卵细胞,卵巢颗粒细胞层致密且排列整齐,多为 8~9层(图3)。

图3 小鼠卵巢组织结构比较(HE染色)
三、小鼠血清生殖激素及糖代谢检测结果
DHEA+HFD组FSH水平显著高于对照组(P<0.05),DHEA组FSH水平高于对照组,但差异无统计学意义(P>0.05)。DHEA+HFD组及DHEA组小鼠血清T、LH水平均显著高于对照组(P<0.01)。DHEA组LH/FSH值显著高于对照组(P<0.01),DHEA+HFD组LH/FSH值高于对照组,但差异无统计学意义(P<0.05)。DHEA组及DHEA+HFD组FPG及FINS水平均显著高于对照组(P<0.05),DHEA+HFD组HOMA-IR显著高于DHEA组和对照组(P<0.01)(表1)。
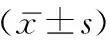
表1 小鼠组间血清生殖激素及糖代谢情况比较
四、小鼠血脂水平和肝功能比较
3组小鼠间TG水平无显著性差异(P>0.05);DHEA组TCHO、HDL水平较对照组显著增加(P<0.05),DHEA+HFD组TCHO、HDL(P<0.01)及LDL(P<0.05)水平较DHEA组及对照组均显著增加(表2)。DHEA+HFD组及DHEA组血清ALT水平均高于对照组,但差异无统计学意义(P>0.05);DHEA组血清AST水平显著高于对照组(P<0.05),DHEA+HFD组AST水平显著高于DHEA组和对照组(P<0.01)(表2)。

表2 小鼠组间血脂水平及肝功能比较
五、小鼠肝脏病理比较
肝脏HE染色结果显示,3组间结构没有明显差异;进一步通过油红O染色评估肝脏中的脂质含量,显微镜下观察发现DHEA+HFD组小鼠的肝脏脂质蓄积量较对照组和DHEA组增加(图4)。
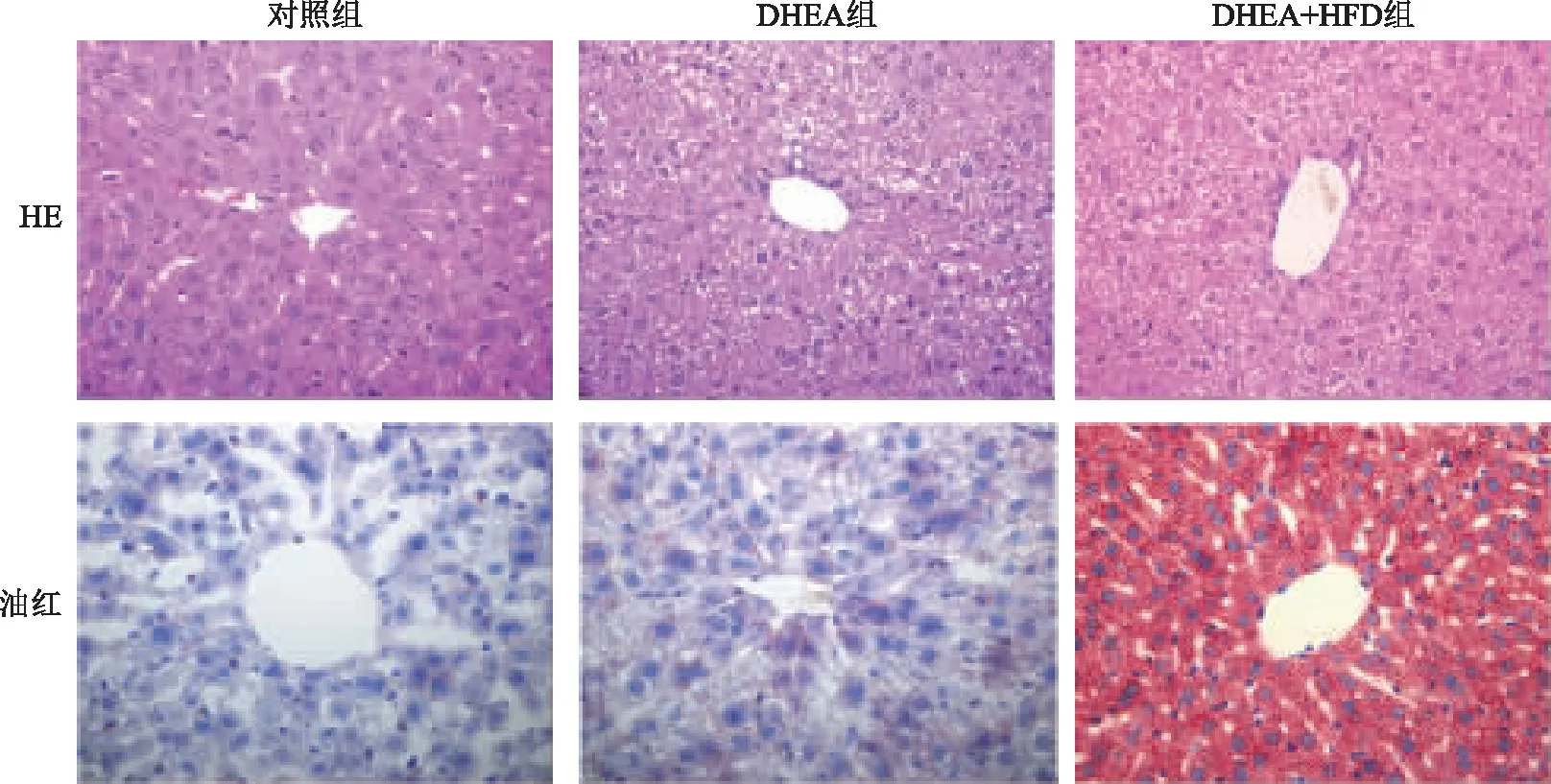
图4 小鼠肝脏组织结构比较(HE及油红O染色 ×400)
六、小鼠糖耐量及胰岛素抵抗情况比较
IPGTT实验结果显示:DHEA组及DHEA+HFD组在葡萄糖注射给药后15、30 min血清葡萄糖水平较对照组显著增加(P<0.01)(图5A);DHEA+HFD组AUC显著高于DHEA组及对照组(P<0.01),DHEA组AUC较对照组升高,但差异无统计学意义(P>0.05)(图5B)。此外,ITT实验显示胰岛素注射15、30、60及90 min后,DHEA+HFD组及DHEA组小鼠血清葡萄糖水平均显著高于对照组(P<0.01)(图5C),且两组小鼠AUC均显著高于对照组(P<0.01)(图5D)。
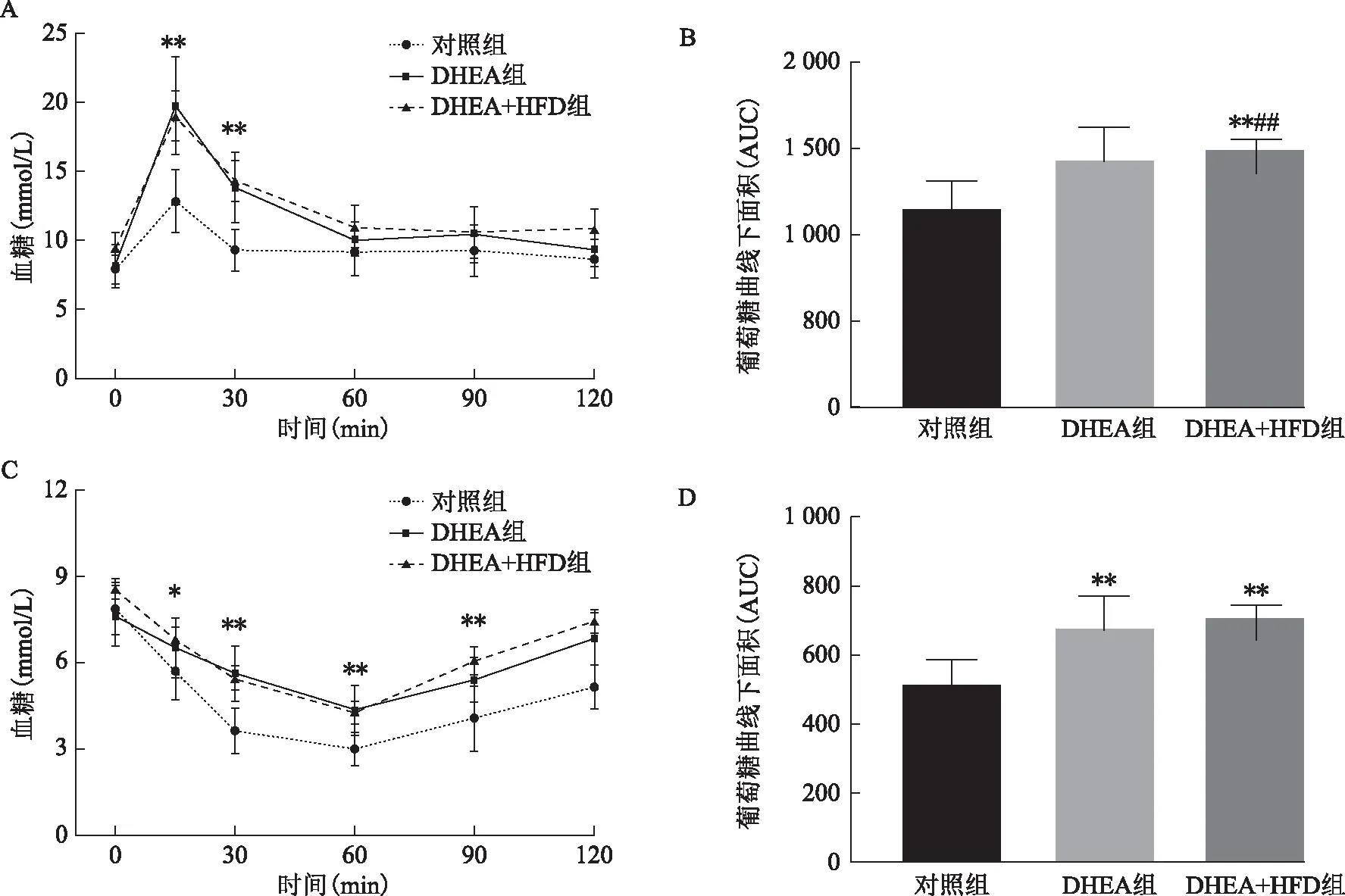
A:小鼠IPGTT曲线;B:小鼠IPGTT葡萄糖曲线下面积(AUC)比较;C:小鼠ITT曲线;D:小鼠ITT葡萄糖曲线下面积(AUC)比较。与对照组比较,*P<0.05,**P<0.01;与DHEA组比较,#P<0.05,##P<0.01
讨 论
PCOS作为一种以生殖障碍和代谢紊乱为特征的疾病,国内外研究者多采用PCOS动物模型深入研究其病因、病理生理及药物治疗机制,其中以啮齿动物雄激素造模法最常见。Ryan等[7]研究发现,长期暴露于雄激素环境中,小鼠可表现出典型的PCOS特点,包括卵巢多囊样改变、排卵障碍、内分泌紊乱及肥胖等,且氟他胺抗雄激素治疗可逆转其病理改变。李天鹤等[8]研究发现,DHEA及双氢睾酮(DHT)连续造模21 d均可成功建立PCOS大鼠模型,且DHEA组大鼠糖脂代谢紊乱程度更甚。
DHEA是主要在肾上腺皮质合成的雄激素,也是卵泡膜细胞中孕烯醇酮经Δ4途径合成雄烯二酮的中间产物。外源性提高DHEA水平可升高血清睾酮水平,从而引起卵泡发育障碍及排卵障碍[9]。DHEA最初用于诱导PCOS大鼠模型,近十几年来也用于诱导PCOS小鼠模型,且被广泛用于各种基因敲除、转基因和组织特异性基因敲除小鼠中,以探究PCOS发病机制中特定基因的功能[10]。Lai 等[11]及王玉阁等[12]采用DHEA联合60%高脂饮食构建PCOS小鼠模型,分别造模20 d及30 d,均成功诱导出了PCOS的生殖及代谢表型。但Caldwell等[13]研究发现,用 DHEA 连续造模90 d并不能成功诱导出PCOS小鼠相关表型,说明DHEA建模时程对模型成功与否至关重要。
近年来,研究发现PCOS患者的NAFLD发病率增加。Cui等[14]开展的动物实验也发现,DHT诱导的PCOS动物模型出现胰岛素抵抗(IR)、肝脏脂质蓄积、肝脏不同程度炎症反应,提示雄激素与肝脏病变具有相关性。但采用DHEA诱导PCOS动物模型并观察肝脏组织病理学改变的研究甚少,同时考虑到高脂饮食(HFD)对生殖和代谢疾病的可能影响[15],因此我们采用DHEA联合HFD进行造模,并与单纯应用DHEA造模进行比较。本研究采用21 d颈背部皮下注射DHEA或联合HFD构建PCOS小鼠模型,结果显示DHEA组小鼠体重较对照组增加,并可进一步引起小鼠动情周期紊乱、卵巢多囊样改变、高雄激素血症(HA)、LH/FSH比值升高等异常改变,说明DHEA成功诱导小鼠出现类PCOS样表现,提示高雄激素水平在 PCOS 发生发展中发挥重要作用,但DHEA在肥胖中的确切作用机制尚不清楚。此外,DHEA联合HFD同样促进小鼠出现类PCOS表现,且生殖表型更严重,且与对照组及DHEA组相比小鼠血清胆固醇水平显著升高,肝功能受损程度加重并观察到明显的肝脂肪变性,提示DHEA联合HFD增加肝脏脂肪变性风险,HFD在其中发挥重要作用。DHEA联合HFD是构建PCOS合并NAFLD动物模型的理想方法,为进一步研究两者间病理生理机制联系提供基础。
为了研究处理因素对小鼠葡萄糖耐量及胰岛素抵抗的影响,进行了IPGTT及ITT试验。结果表明,DHEA组及DHEA联合HFD小鼠均表现出糖耐量异常和胰岛素抵抗,提示DHEA促进糖代谢紊乱且HFD进一步加重糖代谢紊乱。既往研究发现,IR发生在大约50%~80% 的PCOS患者中,且肥胖可进一步加重PCOS的IR[16]。动物实验表明,青春期前过度暴露于雄激素的雌性啮齿类动物皮下和内脏脂肪组织中脂肪细胞体积增大,且脂肪因子表达水平降低,可能与IR的发生有关[17-18]。但HA在PCOS中诱导IR的具体机制尚不清楚,未来需进一步探究两者间的联系和相互作用,为PCOS诊治提供新的临床靶点。
综上,本研究采用DHEA及DHEA联合HFD 2种造模方法诱导C57BL/6J雌性小鼠建立PCOS动物模型,均成功构建出小鼠PCOS模型,表现出PCOS的生殖与代谢特征,且DHEA联合HFD法较单纯DHEA法卵巢病理学变化、内分泌紊乱、糖脂代谢异常及肝脏脂质蓄积更加显著。因此,DHEA联合HFD造模可作为研究青少年PCOS代谢紊乱发病机制的一种手段,特别是用于研究PCOS患者伴肝脂肪变性的潜在机制。

