SNP单体型分析的不同策略应用于COL1A1成骨不全症家系PGT-M的临床研究
王洁,朱丽华,陈林君,林飞,刁振宇,徐志鹏,王珊珊,张宁媛
(南京大学医学院附属鼓楼医院生殖医学中心,南京 210000)
成骨不全症(Osteogenesis imperfecta,OI)是一种罕见的系统性结缔组织疾病,其特征是骨密度较低、骨质脆弱、复发性骨折和进行性骨畸形,也可表现为关节松弛、蓝巩膜和耳聋等[1-2]。OI具有遗传异质性,遗传方式包括常染色体显性遗传、常染色体隐性遗传或伴X染色体遗传[3]。OI的发病率约为1/10 000,其中约90%的发病属于由编码Ⅰ型胶原蛋白的COL1A1/COL1A2基因的杂合突变导致胶原形成障碍的常染色体显性遗传病[4-6]。
目前OI还没有特别有效的治疗方法,因此针对携带致病突变的家系开展胚胎植入前单基因病遗传学检测(Preimplantation genetic testing for monogenic/single gene defects,PGT-M)是最好的应对策略。另外,PGT-M能够筛选出基因型正常的胚胎,可以避免等到产检发现致病突变而终止妊娠给母体带来的身心创伤。在PGT-M中,应用基于二代测序(Next generation sequencing,NGS)的单体型分析,既可以将致病基因所在的染色体与其同源染色体区分开,又可以避免由直接检测中等位基因脱扣(Allele dropout,ADO)或重组导致的误诊,对常染色体显性遗传病的PGT-M具有重要的临床意义[7-9]。对突变位点进行一代测序再联合基于NGS的单核苷酸多态性(Single nucleotide polymorphism,SNP)单体型分析技术能提高胚胎期检测结果的准确性,显著降低误诊率[10-11]。并且,在PGT-M的SNP单体型分析中,先证者、溯源的家系样本、无法溯源家系的患者或新发突变患者的配子或胚胎的遗传信息均可以用于连锁分析[12-13]。因此,不同SNP单体型分析策略能适用于更多类型的患者。
本研究通过NGS检测3个携带了COL1A1致病突变的家系,分别采用先证者、家系样本和单精子的遗传信息构建SNP单体型,联合对突变位点的直接测序,对家系囊胚行PGT-M,探讨其在阻断OI遗传缺陷纵向传递的有效性。
资料与方法
一、研究对象
选取2016年1月至2020年12月于本生殖医学中心就诊并接受遗传咨询和辅助生殖助孕的患者。纳入标准:(1)夫妻双方中至少一方携带COL1A1基因致病突变,经诊断为OI的患者;(2)女方双侧卵巢形态正常,宫腔形态正常;(3)女方卵巢储备功能正常。排除标准:(1)遗传方式为常染色体隐性遗传或伴X染色体遗传的OI患者;(2)夫妻双方患有其他单基因遗传病;(3)女方存在泌尿生殖器畸形;(4)女方存在内分泌或代谢异常(垂体,肾上腺、胰腺、肝脏或肾脏)。共有3对夫妻自愿申请采用PGT-M技术指导生育,夫妻双方外周血基因组DNA(gDNA)经传统的一代测序检测发现其中一方携带导致OI的COL1A1基因致病突变。南京大学医学院附属鼓楼医院伦理委员会批准本研究方案的实施(批件编号2012002),患者均已签署知情同意书。
家系Ⅰ:女方怀孕至7个月时,因胎儿骨骼系统发育异常行引产术,对流产胎儿皮肤样品进行基因检测和染色体微阵列分析(Chromosomal microarray analysis,CMA),CMA未见异常,胎儿COL1A1 Exon31:c.2089C>T,p.Arg697*杂合无义突变。女方被证实携带同样突变,且双耳先天性听小骨硬化,蓝色巩膜。患者接受遗传咨询后,于2020年5月来本中心接受辅助生殖助孕。本家系依据引产胎儿即先证者和夫妻双方的遗传信息构建SNP单体型。
家系Ⅱ:男方具有OI家族史,COL1A1 Exon21:c.1438del,p.Leu480Cysfs*61杂合移码突变,一直避孕中。夫妻双方接受遗传咨询后,于2020年6月来本中心接受辅助生殖助孕。本家系依据男方父母以及夫妻双方的遗传信息构建SNP单体型。
家系Ⅲ:夫妻双方结婚3年后,于2015年自然受孕,孕至6个月时,因胎儿畸形行引产。男方小时候经常骨折,体格检查显示其具有OI的典型特征,包括脊柱侧凸和身材矮小。遗传学检测结果显示男方为COL1A1 Exon33:c.2299G>A,p.Gly767Ser杂合错义突变,女方基因型正常,于2016年8月在本中心接受辅助生殖助孕。男方父母COL1A1基因未检测到致病突变,且引产胎儿的样本未保留,因此本家系分离男方的单精子,筛选突变精子和野生型精子,结合夫妻双方的遗传信息构建SNP单体型。
二、研究方法
1.体外受精、胚胎培养和囊胚活检:成熟卵母细胞行卵胞浆内单精子注射(ICSI),注射后16~18 h进行原核观察。胚胎采用序贯培养液进行培养(G1/G2,Vitrolife,瑞典),培养温度为37℃,气体浓度为5%O2、6%CO2和89%N2。ICSI注射后第3天,用激光在卵裂期胚胎的透明带打10 μm孔径,再将胚胎置换到G2培养液中进行囊胚培养。由两位高年资胚胎学家依据Gardner囊胚评级标准[14-15]对D5和D6囊胚进行评估,用内径为20 μm活检针从囊胚滋养层中吸取大约5~10个细胞后,使用激光辅助切割,得到的细胞用PBS洗涤3次后,转移至0.2 ml PCR管,-80℃冰箱储存。
2.全基因组扩增和基于二代测序的SNP单体型分析:活检得到的滋养层细胞用REPLI-g单细胞扩增试剂盒(Qiagen,德国)进行多重置换扩增(Multiple displacement amplification,MDA)以得到全基因组DNA扩增产物,采用DNA高通量测序技术,鉴别三组家系的COL1A1基因(NM_000088.3 chr17:48261457-48279003)临近区域特异性SNP位点。在基因上下游1 M内各筛选50个高频有效的SNP位点,1 M外各筛选10个有效SNP位点,建立单体型,再结合家系基因型结果,解析与基因型连锁的单体型遗传关系。胚胎同时进行基于NGS的SNP单体型分析和针对突变位点的一代测序检测,实现对胚胎基因型的诊断。家系Ⅰ单体型分析时,选择120个SNP位点和致病突变位点(COL1A1 Exon31:c.2089C>T)对患者夫妻双方及其因骨骼发育异常行引产的胎儿gDNA 进行二代测序检测,从中筛选10个有效SNPs构建了单体型。家系Ⅱ选择120个SNP位点和致病突变位点(COL1A1 Exon21:c.1438del)对夫妻双方以及男方父母的gDNA进行高通量测序,从中筛选10个有效SNPs构建了单体型。家系Ⅲ分离单精子,一代测序检测单精子是否携带COL1A1 Exon33:c.2299G>A突变,筛选出突变精子和野生精子;单体型分析时,选择93个SNP位点和致病突变位点对突变精子、野生精子的WGA产物以及夫妻双方外周血gDNA进行高通量测序,从中筛选10个有效SNPs构建了单体型。
3.冻融胚胎移植与随访:根据PGT-M的结果,将基因型正常且染色体拷贝数正常的囊胚移入患者子宫。移植后14 d,检测女方血清中HCG水平。移植后6周,经B超检测孕囊和胎心判断临床妊娠。孕18~21周时,羊水穿刺进行胎儿基因型诊断,进一步确定为非突变基因型。
结 果
一、胚胎培养结果
家系Ⅰ共获卵16枚,其中MⅡ卵母细胞11枚行ICSI注射。授精后16~18 h观察,2PN受精卵8枚。授精后第3天,8细胞胚胎3枚,7细胞胚胎1枚,12细胞胚胎2枚,2细胞发育停滞胚胎1枚,1细胞发育停滞胚胎1枚,共6枚胚胎行囊胚培养。授精后第5天3枚胚胎发育为可活检囊胚(编号为1-B6、1-B8、1-B9),第6天有1枚胚胎发育为可活检囊胚(编号为1-B11),共4枚囊胚行滋养层细胞活检。每个移植周期仅移植一枚基因型正常的整倍体囊胚(表1)。
家系Ⅱ获卵18枚,其中MⅡ卵母细胞 12枚行ICSI注射。授精后16~18 h观察,2PN受精卵8枚,1PN受精卵1枚。授精后第3天,8细胞胚胎1枚,12细胞胚胎1枚,7细胞胚胎1枚,6细胞胚胎2枚,4细胞胚胎2枚,3细胞发育停滞胚胎1枚,1细胞发育停滞胚胎1枚,共7枚胚胎行囊胚培养。授精后第5天2枚胚胎发育为可活检囊胚(编号为2-B1和2-B10),第6天1枚胚胎发育为可活检囊胚(编号为2-B3),共3枚囊胚行滋养层细胞活检。每个移植周期仅移植一枚基因型正常的整倍体囊胚(表1)。
家系Ⅲ获卵18枚,其中成熟卵母细胞12枚行ICSI注射。授精后16~18 h观察,2PN受精卵9枚,1PN受精卵1枚。授精后第3天,8细胞胚胎7枚,9细胞胚胎2枚,7细胞胚胎1枚,共10枚胚胎行囊胚培养。授精后第5天2枚胚胎发育为可活检囊胚(编号为3-B3和3-B12),第6天1枚胚胎发育为可活检囊胚(编号为3-B11),共3枚囊胚行滋养层细胞活检。每个移植周期仅移植一枚基因型正常的整倍体囊胚(表1)。

表1 各家系促排移植情况(n)
二、OI遗传学诊断结果
3个家系共活检了10枚囊胚的滋养层细胞,均通过MDA扩增方法进行全基因组扩增和高通量测序,并依据高通量测序结果构建了SNP单体型。
家系Ⅰ单体型分析结果显示,囊胚1-B6、1-B9和1-B11遗传了母系携带突变基因的染色体为感染OI胚胎,囊胚1-B8遗传母系未有突变位点的染色体为基因型正常囊胚(图1A)。家系Ⅱ的单体型分析结果显示,囊胚2-B1为感染OI囊胚,2-B3和2-B10则为基因型正常囊胚(图1B)。家系Ⅲ的单体型分析结果显示,囊胚3-B3和3-B12来源于父系的单体型与野生型精子一致,则为基因型正常囊胚;囊胚3-B11来源于父系的单体型与突变精子的单体型一致,为感染OI囊胚(图1C)。10枚囊胚一代测序检测的结果与单体型分析结果相吻合。
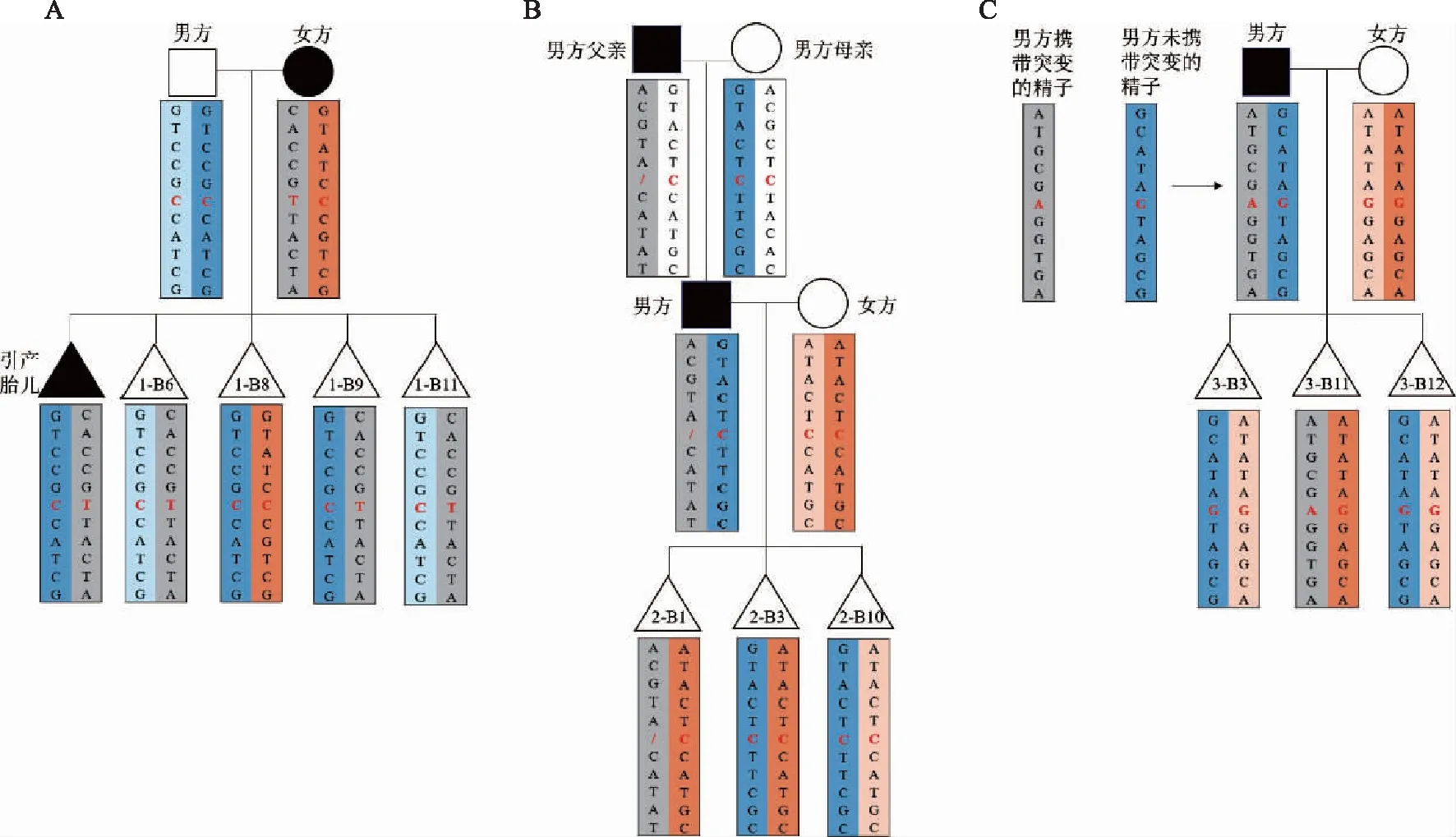
A:家系Ⅰ;B:家系Ⅱ;C:家系Ⅲ;红色标注碱基为突变位点,灰色链代表致病染色体,黑色标识代表OI患者
三、临床随访结果
家系Ⅰ移植囊胚1-B8后14 d,检测女方血清β-HCG值为1 494 U/L,移植后42 d,B超检查见到有心跳的孕囊。患者拒绝行羊膜腔穿刺,但在妊娠期间所有B超检查均显示胎儿无骨骼或其他脏器异常。在妊娠37周时,剖腹产一名3 500 g健康男婴,无出生缺陷。
家系Ⅱ活检3枚囊胚,检测结果显示囊胚2-B3和2-B10基因型正常,但2-B10染色体拷贝数异常,11号染色体为三倍体。患者移植囊胚2-B3后14 d,检测女方血清β-HCG值为0.35 U/L,未妊娠。
家系Ⅲ移植囊胚3-B12后14 d,检测女方血清β-HCG值为1 304 U/L,移植后42 d,B超检查见到有心跳的孕囊。患者在孕19周时行羊膜腔穿刺术,培养的羊水细胞提取gDNA未检测到COL1A1 Exon33:c.2299G>A致病突变。在妊娠40周,患者剖腹产一名体重为4 250 g健康女婴,无出生缺陷。
讨 论
OI又被称为脆性骨病,是一种罕见的遗传性结缔组织、骨骼系统疾病,其临床表现类型多样,会严重影响患者的生存和生活质量,目前尚无有效的治疗方法[16]。因此,建立PGT-M及产前诊断OI的技术平台,预防OI发生和阻断OI的遗传缺陷的垂直传递,具有十分重要的意义。本研究中的三例OI均由COL1A1基因的杂合突变导致。COL1A1基因位于17号染色体长臂17q21.3,编码I型胶原蛋白α1链,该蛋白存在于大多数结缔组织中,在骨骼、巩膜、真皮和肌腱中含量丰富,当结构、含量异常或翻译后修饰及折叠错误等会导致OI[17]。
由于COL1A1突变导致的OI为常染色体显性遗传病,而在PGT-M诊断中,对于基因显性遗传病的检测,直接检测法中出现的ADO会导致携带杂合致病基因的胚胎被用于移植,而PGT-M的误诊会给患者生理和心理造成巨大创伤。因此,本研究将一代测序检测致病位点联合基于NGS的SNP单体型分析技术,应用于显性遗传病的PGT-M检测,有效避免了ADO引起的误诊,从而在OI家系中阻断了致病基因的垂直传递。《高通量基因测序植入前胚胎遗传学诊断和筛查技术规范(试行)》规定:对基因型疾病的PGT检测,需要再进行靶基因上下游紧密连锁的SNP位点或短串联重复序列(STR)的分析,以通过多种检测手段相互印证结果,从而确保准确性、降低误诊率[18]。本研究的单体型分析没有使用STR作为多态位点,而是采用在基因组中数量更多、分布更广的SNP位点构建单体型。并且,为了避免受到同源重组的影响,本研究是在COL1A1基因上下游2M内筛选有效的SNP位点。
单体型分析为一种间接的检测方法,需要有基因型和遗传关系明确的家系样本,若家系中没有其他亲属致病,患者为新发突变,则可用患者的配子作为连锁分析的依据[12-13],也能够从胚胎中寻找先证者。本研究中家系Ⅰ女方为COL1A1基因新发突变,但未出现易骨折等异常表现,其父母基因型正常,则以引产的骨骼发育异常的胎儿为先证者,依据先证者及患者夫妇的遗传信息,成功构建了SNP单体型。家系Ⅱ具有OI的家族遗传,男方父亲即为OI患者,依据患者夫妻双方及男方父母的遗传信息,构建SNP单体型。家系Ⅲ中的男方为OI患者,其父母基因型正常,家系中无其他OI患者,虽曾孕畸形胎儿,但未做基因型检测,也没有保留引产胎儿的遗传物质,故通过分离该患者的单精子,进行单精子全基因组扩增后,PCR扩增一代测序检测突变位点,区分野生型精子和突变精子,再通过NGS对野生型单精子和突变单精子及患者夫妇COL1A1基因组及临近区域特异性SNP位点进行鉴别,从而构建单体型区分致病基因所在的染色体和正常染色体。对于新发突变的单基因病患者,还可以从活检的胚胎中寻找先证者,先通过一代测序检测基因型,再通过NGS鉴别致病基因及其临近区域的特异性SNP位点构建单体型后,反向印证一代测序的结果。因明确遗传信息的患者家系样本或新发突变患者的配子、胚胎均可通过NGS鉴别致病基因及其邻近区域的高频突变SNP位点用于构建单体型,从而使SNP单体型分析技术具有普遍适用性。
总之,基于NGS的SNP单体型分析结合致病基因的一代测序,来进行OI的胚胎植入前遗传学,可以提高基因诊断的准确性,有效消除误诊率。并且,不同SNP单体型的分析策略能使多种类型的单基因遗传病患者从精准医疗中获益。本研究极大的丰富了PGT-M的临床诊断策略。

