磁性金属有机框架表面分子印迹的制备及富集蔬菜样品中2,4-二氯苯氧乙酸的应用
麻敏瑞,祝新月,刘晓燕,张海霞
(兰州大学 化学化工学院,甘肃 兰州 730000)
2,4-二氯苯氧乙酸简称2,4-D,是一种广泛使用的激素类除草剂和水果蔬菜的采后贮藏保鲜剂,2,4-D水溶性也较差,在自然条件下难以降解,可通过食物链等进入环境和人体,长时间的摄入会对人体造成伤害.但是,由于环境和食品基质中2,4-D的浓度很低,直接使用仪器检测比较困难.因此,有必要发展一种简单高效的从复杂样品中特异性捕获2,4-D的富集方法.
分子印迹技术是一种对目标分子具备特异性识别能力的技术,表面分子印迹聚合物(MIP)的印迹位点在载体表面,具有传质速率快、吸附效率高的特点[1-2].磁性表面分子印迹聚合物结合了MIP的特异性和磁性材料磁分离的优点,广泛用于复杂样品前处理中的分离富集.
金属有机骨架(MOFs)是一种通过金属离子和有机配体自组装产生的拓扑晶体材料,具有比表面积大、孔径可调及机械性能良好等优点[3],在催化[4-5]、分离[6-7]、存储[8]、药物输送[9-10]和传感器[11-12]等方面都具有广泛的应用.其中沸石咪唑酯骨架(ZIFs)具有较好的性能并且易于功能化.特别是ZIF-8具有极好的热稳定性和化学稳定性,其结构很难被环境的变化所破坏[13-14],受到科研工作者的青睐,并产生了很多应用.
本研究采用表面印迹技术,以固相研磨法制备的磁性ZIF-8为基质,通过虚拟模板法和溶胶-凝胶法,在室温下制备磁性表面分子印迹聚合物Fe3O4@ZIF-MIP,用于选择性富集和分离食品样品中的2,4-D.考察了Fe3O4@ZIF-MIP的吸附能力、选择性及重复使用性能,并将建立的分析方法成功应用于蔬菜样品中2,4-D的富集,以期为2,4-D的富集提供一种新材料[15].
1 试验部分
1.1 仪器与试剂
傅里叶变换红外光谱仪(Nicolet is5,美国赛默飞世尔科技公司);X射线衍射(XRD,Rigaku Miniflex-600,日本理学Rigaku);扫描电子显微镜(JSM-5600LV,日本电子光学公司);场发射透射电子显微镜(Tecnai G2 F30,美国FEI公司);全自动比表面积及空隙度测定仪(Tristar 3020,美国Micromeritics公司);热重分析仪(Pyris Diamond,美国Perkin-Elmer公司);振动样品磁力计(VSM,DT307-B-2,美国Lakeshore公司);元素分析仪(VarioEL,德国Hanau Elemental Analyses公司);自搭建接触角仪(兰州大学蒲巧生教授课题组);氮气吹干仪(HP-5016SY,中国上海济成分析仪器有限公司);雷磁pH计(PHS-3C,中国上海精科仪器有限公司).超高效液相色谱仪(DionexUltiMate 3000,美国赛默飞世尔公司),色谱柱为反相C18柱(5 μm,4.6×150 mm,Hedera ODS-2).色谱条件:乙腈/水(磷酸调节其pH值为3,体积比为60∶40),流速为0.8 mL/min,检测波长为283 nm.
2,4-D、2,4-二氯苯酚、3-氨基丙基三乙氧基硅烷(APTES)、四乙氧基硅烷(TEOS)及2-甲基咪唑购于上海萨恩化学技术有限公司,纯度不低于97%.氧化锌(ZnO)购于上海凯信化学试剂公司.Fe3O4(20~50 nm)购于上海阿拉丁生化科技股份有限公司.2-萘氧乙酸(2-NOA)、6-苄基氨基嘌呤(6-BA)购于北京百灵威科技有限公司,纯度不低于98%.吲哚丁酸(IBA)购于上海中秦化学试剂有限公司.磷酸购于天津市大茂化学试剂厂.乙酸、甲酸、盐酸、无水乙醇、无水甲醇均为分析纯,购于天津利安隆博华医药化学有限公司.乙腈为色谱纯,购于北京迪马科技公司.
1.2 材料制备
如图1所示,首先参考课题组之前发表的文章[16],采用固相合成法制备磁性骨架Fe3O4@ZIF-8.

图1 Fe3O4@ZIF-MIP的合成示意图
称取80 mg的2,4-二氯苯酚,溶于乙醇中,加入0.936 mL APTES,超声30 min,使功能单体和模板分子充分作用.将分散在2 mL乙醇中的Fe3O4@ZIF-8颗粒加入预聚物,超声,再加入1.792 mL TEOS交联剂超声5 min,最后加入0.5 mL 1 mol/L的醋酸溶液进行聚合.室温下摇床振荡聚合18 h后,磁分离弃掉上清,使用乙醇洗去未反应的原料,60 ℃烘箱中干燥.干燥后使用9∶1(体积比)的甲醇/乙酸混合溶液洗去模板分子,再用甲醇洗至中性,最后真空干燥.
Fe3O4@ZIF-NIP的制备步骤同上,只是不加模板分子2,4-二氯苯酚.
1.3 解吸和萃取条件的优化
将20 mg Fe3O4@ZIF-MIP材料加入5.0 mL质量浓度为2.0 μg/mL的2,4-D溶液中,摇床中25 ℃下振荡吸附,磁分离弃掉上清之后加入不同的解吸溶剂,超声解吸,收集解吸液,氮气吹干,然后使用200 μL流动相复溶,经有机滤膜过滤后进入高效液相色谱分析.对解吸溶剂、解吸溶剂体积、解吸时间以及萃取时间和萃取溶液的pH进行优化.
1.4 吸附试验
将20 mg Fe3O4@ZIF-MIP材料加入5.0 mL质量浓度为50.0 μg/mL的分析物溶液中,在摇床中25 ℃下振荡10~120 min,磁分离,取上清液进行分析.Fe3O4@ZIF-NIP材料的动态吸附试验在相同条件下进行.
配制10~500 μg/mL的样品溶液,分别称取20 mg的Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP,加入上述溶液中,25 ℃振荡吸附10 min,磁分离,取上清液进行分析.根据吸附前后的浓度变化,由式(1)得到吸附容量(Q,mg/g):
(1)
式中,C0(μg/mL)和Ce(μg/mL)分别表示吸附前、后2,4-D溶液的质量浓度,V(mL)表示2,4-D溶液的体积,m(mg)表示材料的质量.
通常使用印记因子(IF)来说明MIP的特异性吸附,IF根据式(2)计算:
(2)
式中,QMIP(mg/g)为Fe3O4@ZIF-MIP对目标物的吸附量,QNIP(mg/g)为Fe3O4@ZIF-NIP对目标物的吸附量.
1.5 实际样品的应用
将分析物配成质量浓度为1.0 mg/mL的标准储备液,采用超纯水分别稀释至不同的浓度.然后取20 mg的Fe3O4@ZIF-MIP,在最佳条件下按照上述步骤进行分析,得到标准工作曲线,以此来计算实际样品中测得的分析物浓度.
本工作中所用的黄瓜、辣椒、西红柿购置于兰州当地的超市,豆芽购买于当地农贸市场.样品切碎后,匀质,称取1.0 g匀质后的样品于10 mL离心管中,加入6.0 mL乙腈后涡旋5 min,静置30 min,离心.取2.0 mL上清液氮气吹干,使用5.0 mL去离子水溶解,按照上述步骤在最佳条件下萃取并解吸,最后进行进入高效液相色谱分析.
上述所有试验均平行测定3次,结果取其平均值.
2 结果与讨论
2.1 材料的制备与表征
材料的X射线衍射(XRD)图谱如图2(A)所示.由2(A)可见,通过简单研磨合成的磁性ZIF-8材料的特征峰与纯ZIF-8的标准峰基本符合,证明了磁性ZIF-8材料的成功制备.由于Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP材料是在Fe3O4@ZIF表面合成的印迹聚合物,所以基本不存在ZIF-8的特征峰,证明了材料的成功制备.
图2(B)为制备的不同材料的红外光谱图.由图2(B)可见,其中461 cm-1处的特征峰是Fe3O4的Fe-O伸缩振动峰,1 580、1 420 cm-1处的特征峰是咪唑的C=N和C-N的伸缩振动峰.Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP谱图中,1 059、789 cm-1处的特征峰是功能单体APTES和交联剂TEOS水解缩合后的Si-O-Si键振动峰,1 630 cm-1处的特征峰对应的是C-N伸缩振动.可以看出,Fe3O4@ZIF的特征峰461、1 146、1 420、1 580 cm-1均能在Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP中找到,证明了材料的成功制备.

图2 模拟ZIF-8、Fe3O4@ZIF、Fe3O4@ZIF-NIP和Fe3O4@ZIF-MIP的XRD谱图(A),Fe3O4@ZIF、Fe3O4@ZIF-NIP和Fe3O4@ZIF-MIP的IR谱图(B)
图3为材料的扫描电镜(SEM)和透射电镜(TEM)图谱.SEM图显示Fe3O4@ZIF具有规则的菱形十二面体形貌,尺寸大概在110~200 nm左右.为了证实Fe3O4成功嵌入到ZIF-8中,进行了TEM测试,图3(E)显示在ZIF-8框架中存在磁性纳米颗粒,表明固相研磨可以得到所需的磁性ZIF-8材料.以Fe3O4@ZIF为基质合成印迹聚合物后,由图3(B)和(F)观察到Fe3O4@ZIF-MIP形貌为不规则的球状,尺寸在270~300 nm之间.

图3 Fe3O4@ZIF(A)、Fe3O4@ZIF-MIP(B)和Fe3O4@ZIF-NIP(C)的SEM图,Fe3O4(D)、Fe3O4@ZIF(E)和Fe3O4@ZIF-MIP(F)的TEM图
通过氮气吸附试验对Fe3O4@ZIF和Fe3O4@ZIF-MIP的比表面积和孔径进行分析,如表1所列、图4所示,Fe3O4@ZIF孔径为10 nm,材料具有中孔结构,且具有较大的比表面积,为419.13 m2/g,其主要原因是金属有机框架材料ZIF-8具有较大的孔结构和比表面积.合成Fe3O4@ZIF-MIP后,其比表面积变小,为16.74 m2/g,可能是因为印迹聚合物会在Fe3O4@ZIF基质的孔中形成,堵塞了部分孔通道.这也说明在Fe3O4@ZIF-MIP对分析物的吸附过程中,主要是印迹聚合物本身作用,即印迹位点对特定分子的结合.如图4所示,Fe3O4@ZIF的氮气吸附-解吸等温线具有Ⅰ型和Ⅳ型特征,具有回滞环,且没有在相对压力0.1处达到平衡,表明该材料存在微孔和介孔的多级结构.Fe3O4@ZIF-MIP的氮气吸附-解吸等温线符合Ⅱ型特征,表明材料是非多孔的,进一步证明了印迹聚合物的成功制备.

表1 Fe3O4@ZIF和Fe3O4@ZIF-MIP的比表面积和孔结构参数
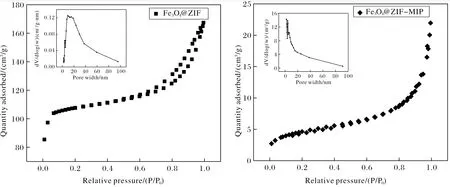
图4 Fe3O4@ZIF和Fe3O4@ZIF-MIP的氮气吸附-解吸等温线
图5为材料的热重图.由图5可见,Fe3O4@ZIF在764 ℃之前,质量损失很大,为58.7%,主要是ZIF骨架的分解.与Fe3O4@ZIF相比,Fe3O4@ZIF-MIP在208 ℃质量损失13.5%,主要是其中的水分和低沸点组分的挥发,在791 ℃质量损失较大,为31.9%,主要是其中的ZIF基质和有机高分子聚合物的分解.此结果证明试验合成的材料Fe3O4@ZIF-MIP具有较好的热稳定性.由图6表面水接触角照片可以观察到,Fe3O4@ZIF与水的接触角为139 °,具有很强的疏水性.由文献[17]可知,Fe3O4与水的接触角为100 °,由此说明Fe3O4@ZIF疏水性的增加正是由于结合了ZIF-8.而Fe3O4@ZIF-MIP与水的接触角为110 °,与Fe3O4@ZIF比较,其疏水性降低,有利于对目标物的吸附.
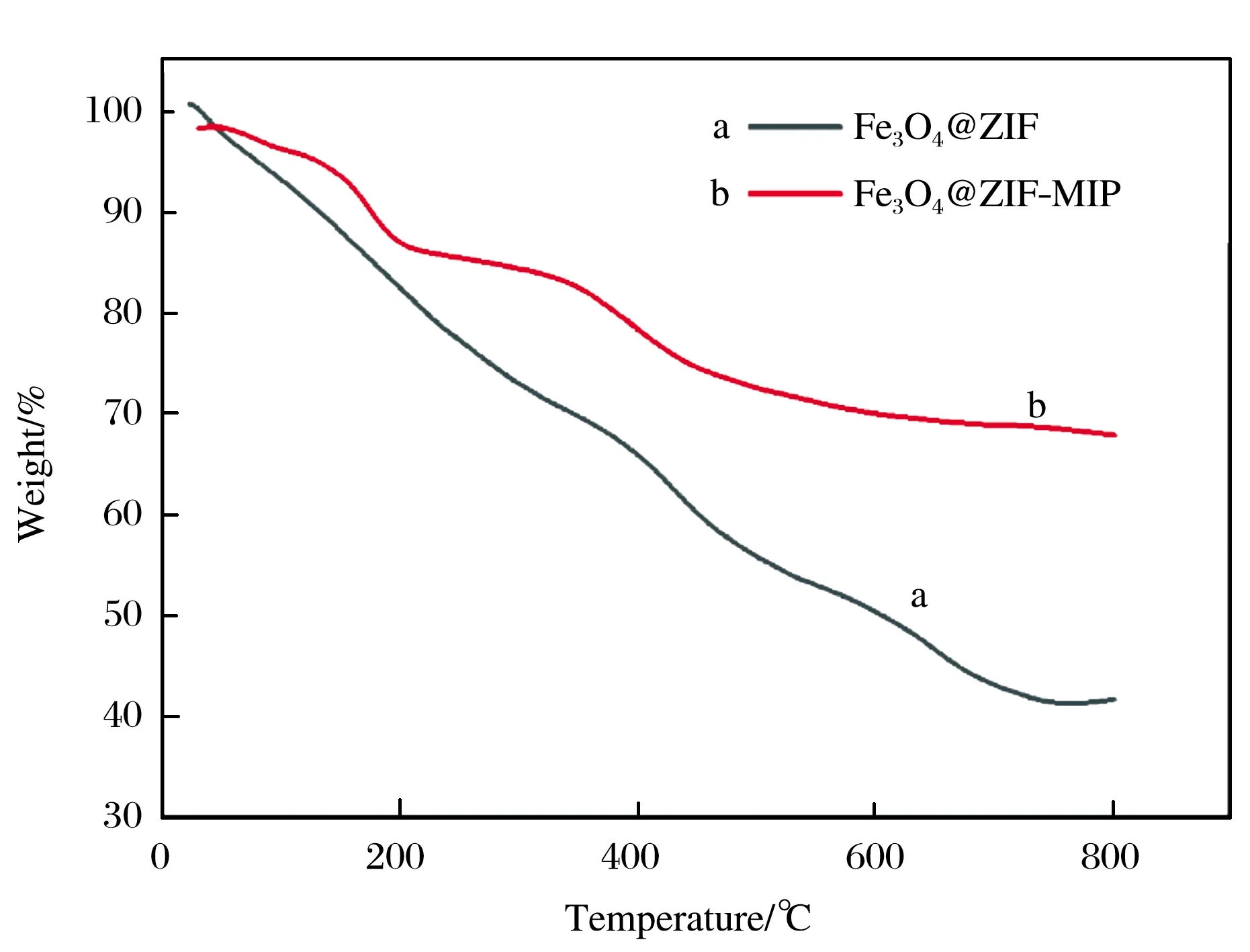
图5 Fe3O4@ZIF和Fe3O4@ZIF-MIP的热重图

图6 Fe3O4@ZIF(A)和Fe3O4@ZIF-MIP(B)的表面水接触角光学照片
由于该试验是磁萃取分离,所以材料良好的磁性对于萃取过程中的分离具有重要作用.对合成的材料进行了磁性强度表征,如图7所示.由图7可见,三条曲线的现状和趋势相似,Fe3O4@ZIF、Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP的磁化强度分别为11、2.3、2.8 emu/g,虽然Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP的磁化强度低,但仍可以通过外加磁场快速的与溶液分离,并且去除磁铁后,轻微摇动即可将其均匀分散在溶液中.
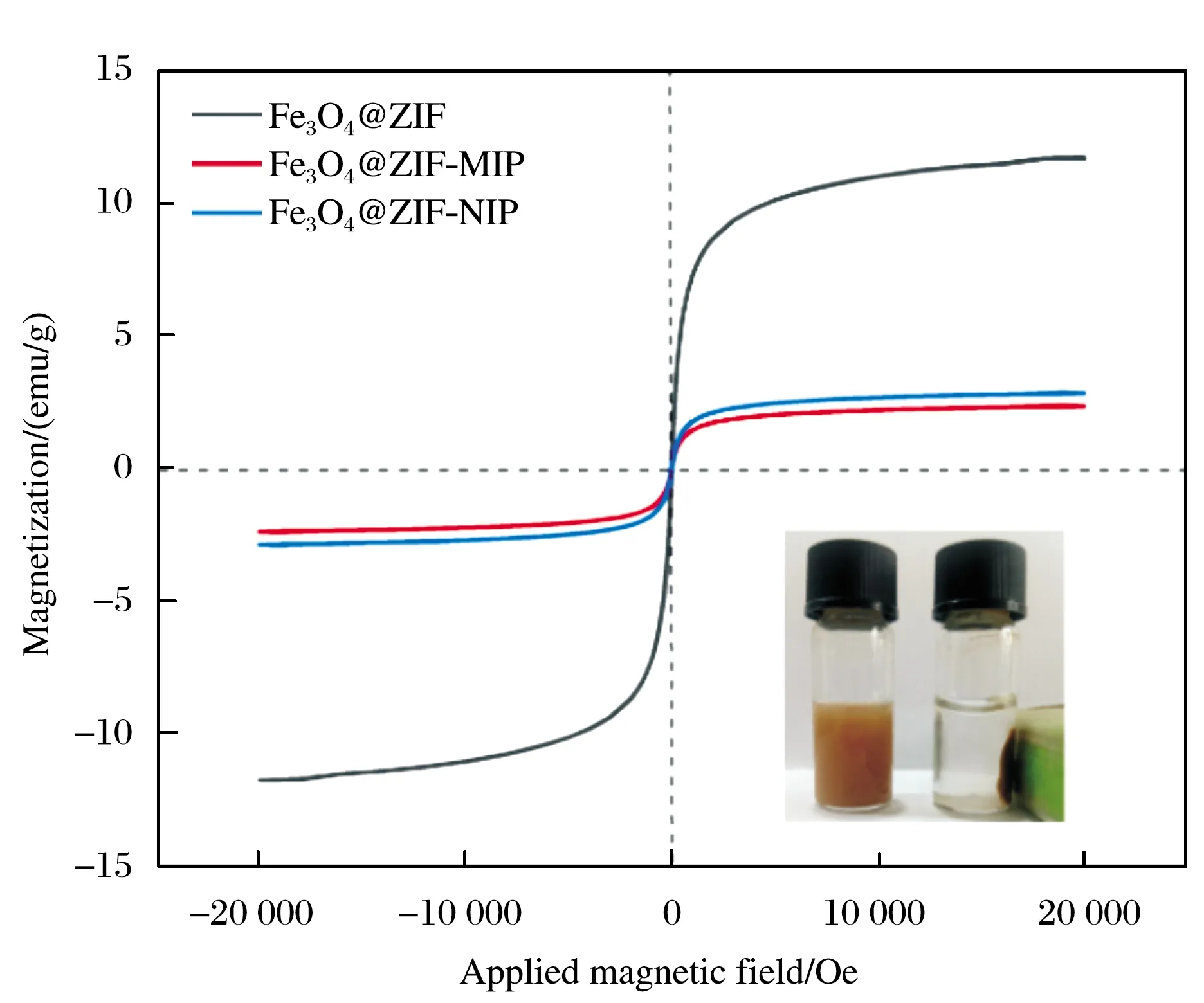
图7 Fe3O4@ZIF、Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP的磁滞回线(插图为使用外加磁场之后的照片)
2.2 解吸条件优化
为了得到最佳的解吸效果,对材料的解析溶剂种类、解吸时间和解析溶剂体积进行了优化,结果如图8所示.分别比较了甲醇-醋酸(体积比为9∶1)、甲醇-甲酸(体积比为9∶1)和乙腈-醋酸(体积比为9∶1)三种解吸溶剂的效果,发现当使用甲醇-甲酸(体积比为9∶1)作为解吸溶剂时,可以获得2,4-D化合物最佳的萃取回收率,因此将其作为解吸溶剂.通过研究不同解吸时间的影响,发现解吸时间为5 min时即可实现令人满意的回收率.在确保高提取效率的前提下,应尽可能缩短解吸时间,因此,后续试验采用5 min的解吸时间.最后,研究了1.0~2.0 mL范围内的解吸溶剂体积的影响,发现2.0 mL的甲醇-甲酸(体积比为9∶1)足以洗脱目标化合物,故将其作为最佳解吸体积.
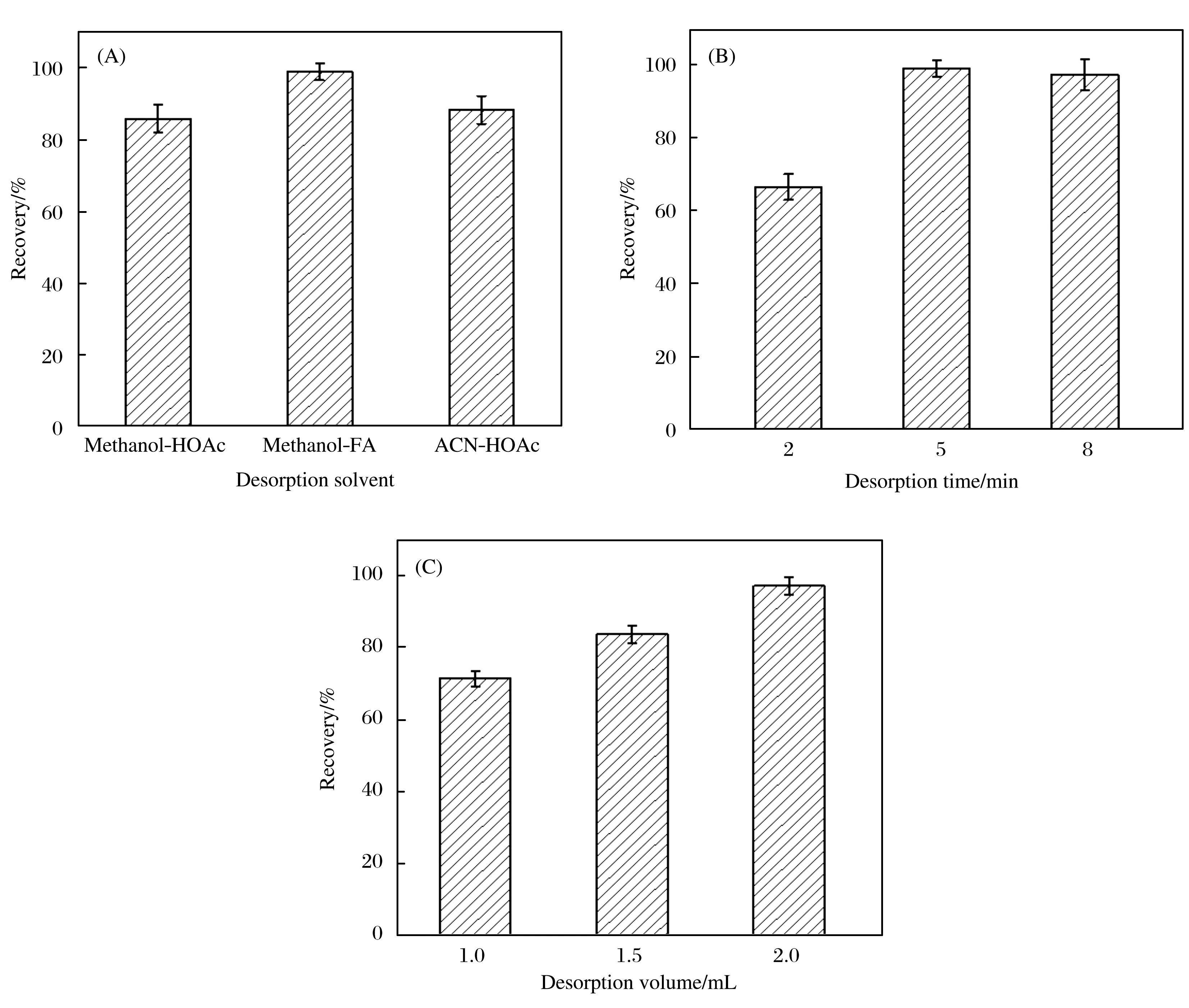
图8 解吸溶剂、解吸时间和解吸体积的优化
2.3 萃取条件优化
为了得到最佳的萃取效果,在最佳解吸条件下进行了萃取条件优化,研究了吸附时间在10~60 min内的萃取效果,结果如图9所示.由图9可见,吸附时间为10 min及更长时,萃取效果基本相同.在保证较高萃取效果的同时又要尽量减少时间成本,所以选择10 min为最佳吸附时间.由于2,4-D的pKa为2.98,可以以分子和离子形式存在于溶液中,试验结果表明,溶液pH值对萃取效果影响较小,所以试验选择在水溶液中进行,不需要调节pH值.
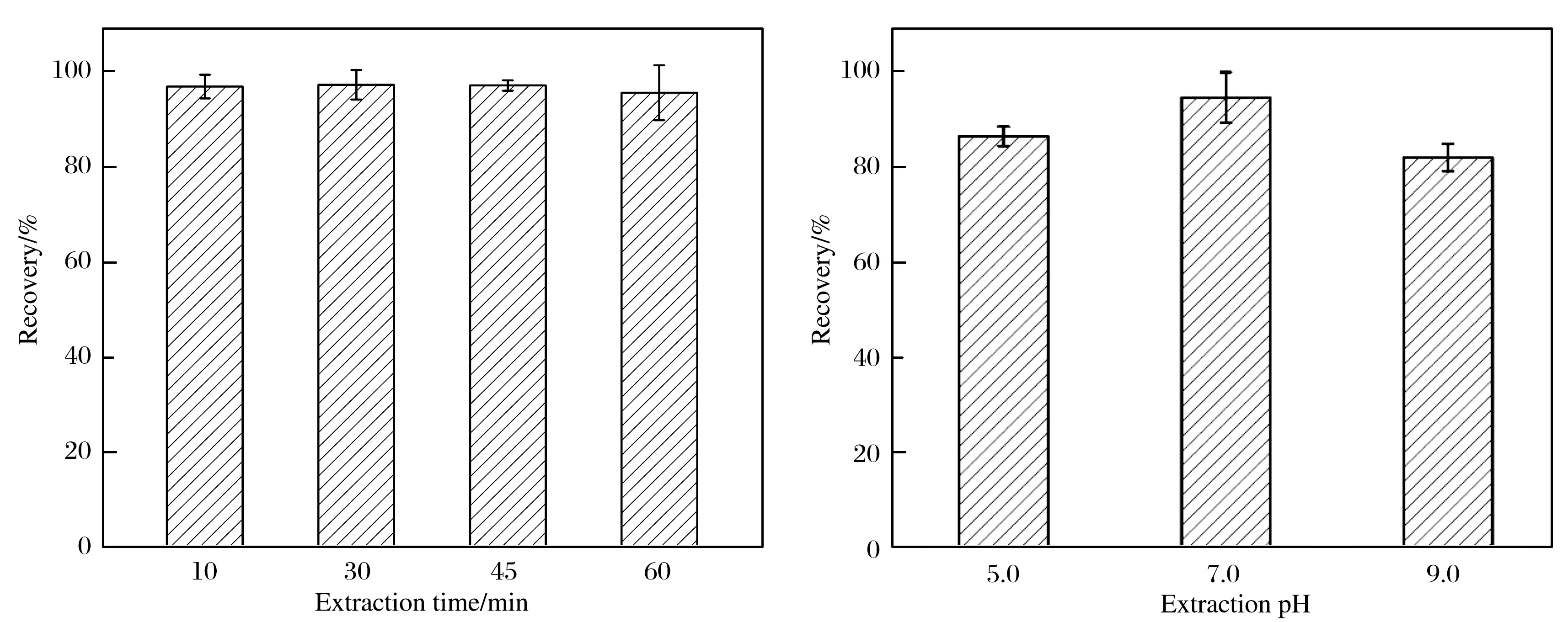
图9 萃取时间和pH优化
2.4 材料的吸附性能
图10(A)是室温下材料对2,4-D的吸附动力学曲线.动力学曲线表明,在最初的10 min内,2,4-D在Fe3O4@ZIF-MIP上的吸附速率很快,在10 min的时候基本达到平衡.这主要是因为Fe3O4@ZIF-MIP表面存在大量的印迹位点,因此目标物2,4-D在初始阶段很容易与这些位点结合.当这些位点饱和之后,2,4-D进一步渗透到印迹层就变得相对困难.2,4-D在Fe3O4@ZIF-NIP上的吸附情况也是如此,但是由于没有印迹位点,所以与目标物的结合能力低.在质量浓度为50 μg/mL时,Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP的吸附容量分别为12.4和3.4 mg/g,印迹因子为3.64.说明合成的印迹材料中相应的印迹位点对分析物具有较快的特异性吸附,且具有较好的吸附选择性.通过准一级速率方程和准二级速率方程分析动力学吸附数据,相关参数如表2所列.

图10 Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP吸附动力学曲线(A)和吸附等温线(B)

表2 Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP对分析物的吸附动力学模型参数
表2中,Qt(mg/g)为t(min)时的吸附容量,Qe(mg/g)为平衡吸附容量,k(g/mg/min)为吸附速率常数.将试验所得的数据带入到上述方程中,得到拟合曲线.由表2可以发现,准二级速率方程计算得出的平衡吸附容量Qe与试验得到的数据非常接近,即2,4-D的吸附动力学与准二级反应速率方程拟合得更好,表明影响吸附速率的主要是化学吸附过程.Fe3O4@ZIF-NIP的吸附速率常数低于Fe3O4@ZIF-MIP,这表明Fe3O4@ZIF-MIP表现出更好的动力学吸附.
图10(B)为材料对2,4-D的吸附等温线.由图10(B)可见,Fe3O4@ZIF-MIP的吸附能力随分析物浓度的增加而增加.分析物的质量浓度为500 μg/mL时,吸附容量为120.31 mg/g.分析物的质量浓度为100 μg/mL时,Fe3O4@ZIF-NIP的吸附容量基本不变.值得注意的是,在相同条件下,Fe3O4@ZIF-MIP对2,4-D的吸附容量,远远大于Fe3O4@ZIF-NIP对2,4-D的吸附容量.这主要是由于Fe3O4@ZIF-MIP具有特定的印迹空腔,而且它的吸附容量高也与材料是以高比表面积的ZIF-8为基质制备的有关.将试验获得的吸附容量与平衡吸附浓度进行吸附等温模型拟合,具体参数如表3所列,相应的公式如式(3)、(4).
Langmuir方程:
(3)
式中,Ce(mg/L)为吸附平衡时溶液中分析物的质量浓度,Qe(mg/g)为吸附达到平衡时的吸附量,Qm(mg/g)为饱和吸附量,KL(L/mg)为与吸附能力有关的Langmuir常数.
Freundlich方程:
(4)
式中,Qe(mg/g)为吸附达到平衡时的吸附量,Ce(mg/L)为吸附平衡时溶液中分析物的质量浓度,KF(L/mg)为与吸附容量和吸附强度有关的Freundlich常数,1/n为与吸附性能有关的Freundlich常数.
Langmuir模型假定它是单层吸附,并且在吸附过程中,吸附材料对整个表面上的目标分子具有相同的亲和力和吸附能.Freundlich模型表明它是多层吸附,发生在异质表面上,并且吸附材料对目标分子的亲和力和吸附能由其比表面性质决定.由表3可以得出,Freundlich模型能更好的描述材料对2,4-D的吸附,说明除了材料表明的印迹位点外,还有Fe3O4@ZIF孔中印迹位点的吸附对目标物的吸附,以及材料与目标物之间的疏水作用力,也说明所制备的材料吸附能力强.
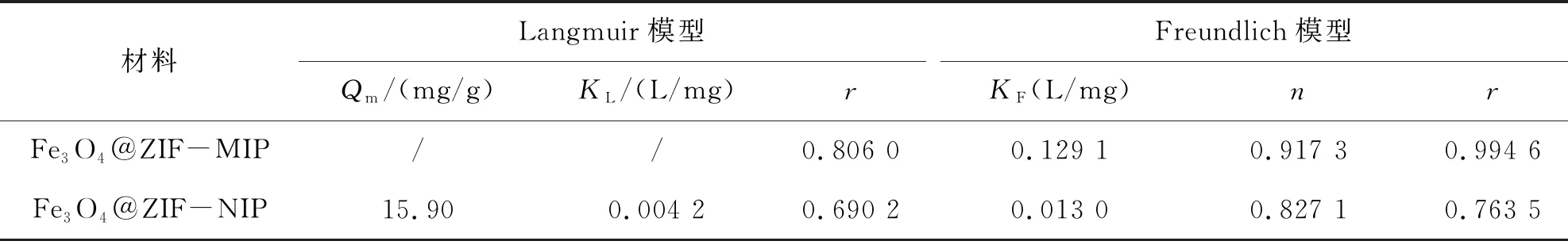
表3 Fe3O4@ZIF-MIP和Fe3O4@ZIF-NIP对分析物的等温吸附模型
2.5 选择性试验
选择与分析物结构相似且在蔬菜中常见的几种植物生长素作为干扰物,配制质量浓度为2.0 μg/mL的混合溶液,在最佳条件下进行了竞争吸附试验,结果如图11所示.由图11可见,Fe3O4@ZIF对目标物2,4-D的吸附能力最弱,对其他几种干扰物的吸附能力也不高,这就排除了Fe3O4@ZIF-MIP中磁性基质对目标物的吸附.Fe3O4@ZIF-MIP对2,4-D的吸附效果最好,对2-萘氧乙酸和吲哚丁酸也有一定的吸附能力,这是由于该材料合成时,为了避免使用过程中发生模板泄露影响定量,采用虚拟模板法,所产生的印迹位点会对结构与傀儡模板分子类似的化合物吲哚丁酸和2-萘氧乙酸具有一定的吸附效果,而Fe3O4@ZIF-NIP材料并没有相应的印迹空穴,所以吸附效果较差.

图11 Fe3O4@ZIF-MIP、Fe3O4@ZIF-NIP和Fe3O4@ZIF对不同化合物的吸附情况(A),Fe3O4@ZIF-MIP的重复使用次数(B)
2.6 材料的重复使用次数
在实际应用中,材料能够重复使用非常重要,将材料在最佳条件下萃取解吸之后,再用甲醇洗涤材料多次,真空干燥后,进行相同的萃取过程.如图11所示,我们所制备的Fe3O4@ZIF-MIP材料在重复使用6次后的萃取回收率仍然在95%以上,证明了材料具有较高的重复使用性.
2.7 实际样品应用
将分析物配制成质量浓度为1.0 mg/mL的标准储备液,使用去离子水分别稀释至不同的浓度,在最佳条件下按照上述步骤进行液相色谱分析,建立工作曲线.Fe3O4@ZIF-MIP对应的线性方程为y=1.310 7x-0.008 8,r为0.998 8,检测限LOD为5.0 ng/mL,定量限LOQ为20.0 ng/mL,检测范围为0.02~1.0 μg/mL.
将本试验建立的分析方法与文献报道的其他方法的测定结果进行了对比,结果如表4所列.由表4可见,本试验所合成的材料吸附时间较低,吸附容量较高,检测限较低,但高于文献[21]中采用的UPLC-MS/MS的检测限.

表4 本文方法与文献报道方法的测定结果的比较
将建立的分析方法应用于黄瓜、青椒、西红柿和豆芽样品中2,4-D的富集检测,图12是上述4种实际样品经Fe3O4@ZIF-MIP富集和加标之后的色谱图.由图12可知,4种实际样品在材料富集之后,只有黄瓜样品被检测出有微量的2,4-D残留,含量远远小于国家食品添加剂使用标准(GB 2760-2014)规定的最大残留量(2.0 μg/g).随后我们将黄瓜样品使用水和食品专用洗涤剂分别清洗,在水洗之后测得黄瓜中2,4-D的质量分数为(0.50±0.012) μg/g,食品洗涤剂清洗之后测得质量分数为(0.30±0.002) μg/g.结果表明,水洗之后分析物残留量已经很低了,但是专用洗涤剂洗的更彻底.
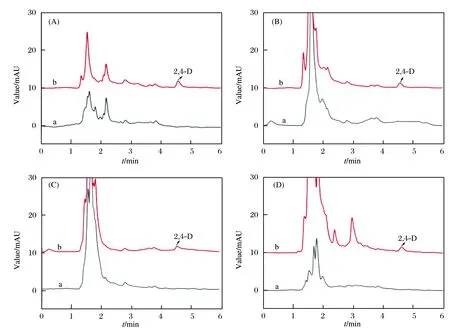
图12 黄瓜(A)、青椒(B)、西红柿(C)和豆芽(D)样品经材料富集后(a)和加标3.0 μg/g(b)时的色谱图
为了验证方法的准确度,对实际样品进行加标回收试验,结果如表5所列.由表5可见,加标回收率在71.8%~104.8%之间,三次平行测定结果的相对标准偏差RSD在6.5%及以下.由于国标(NY/T 1434-2007)使用的是LC/MS检测,而且所用吸附剂较昂贵,所以选择地方标准(DB32/T 932-2006)对实际样品进行检测对比,结果如表6所列.由表6可见,使用标准方法并未检测到样品中的分析物残留,但是样品回收率数据并没有显著性差异,证明了该方法的准确性.说明该方法适用于蔬菜中2,4-D含量的测定.
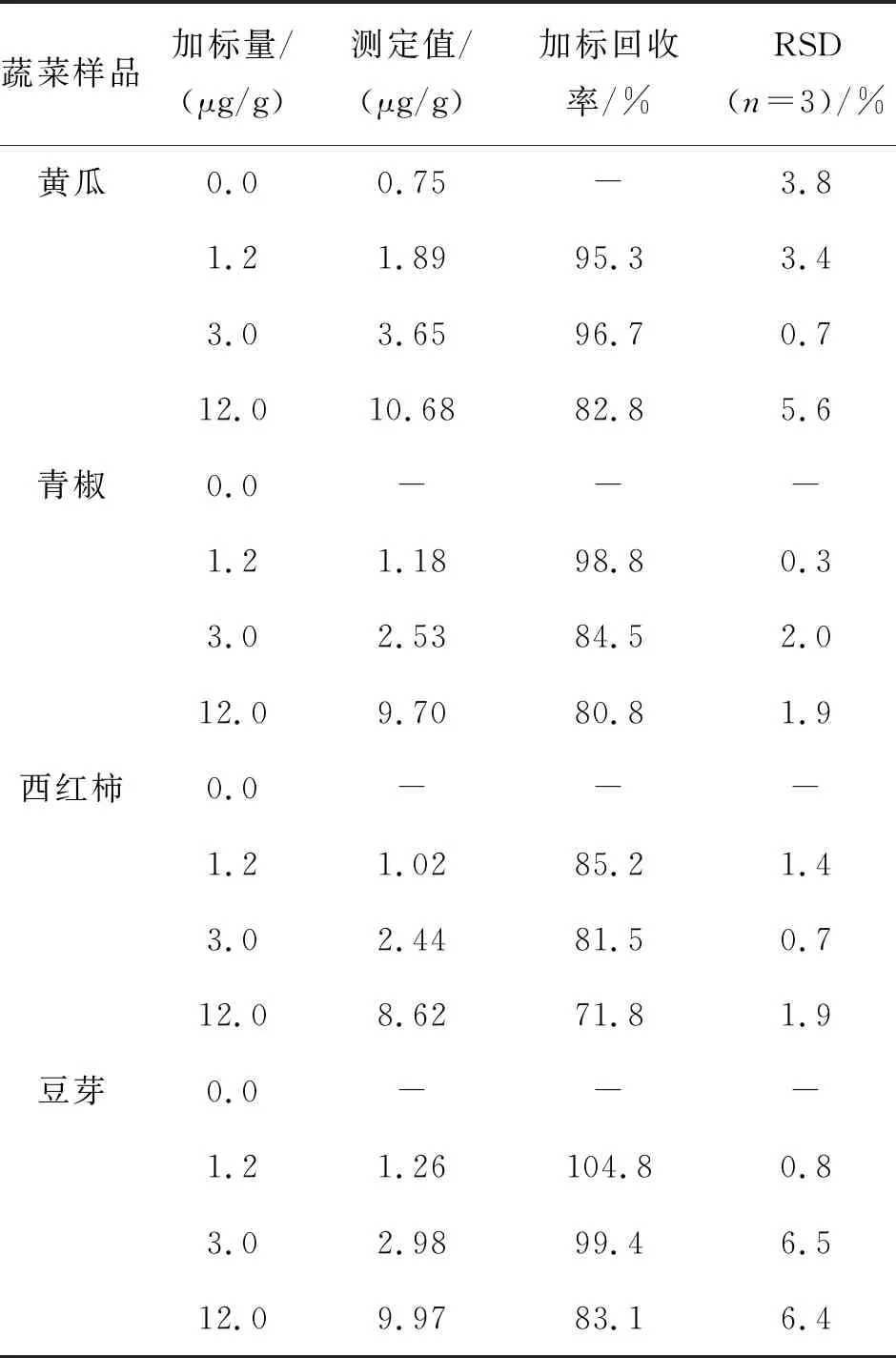
表5 蔬菜样品中的检测和加标回收试验
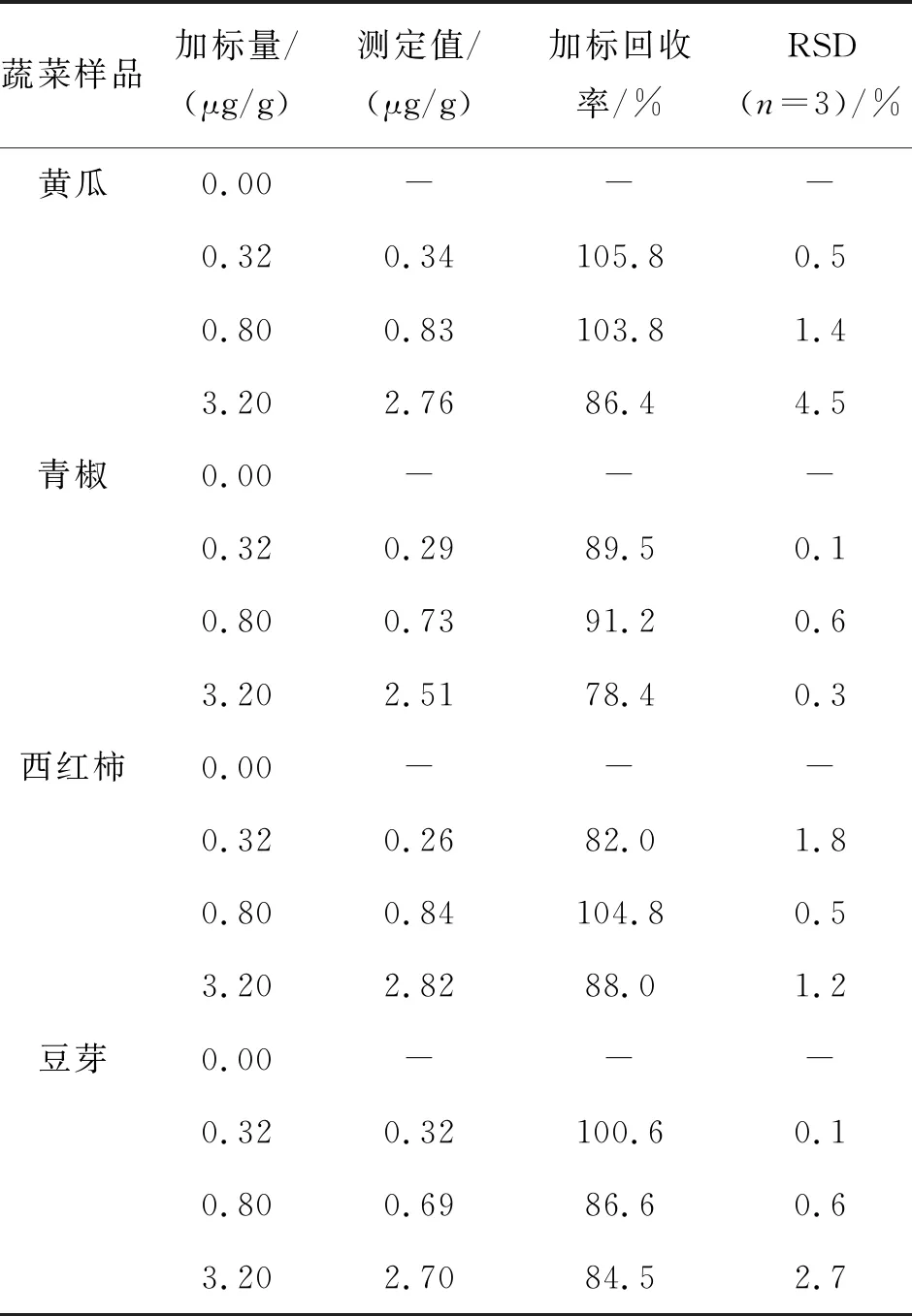
表6 标准方法处理蔬菜样品的加标回收试验
3 结论
本试验通过虚拟模板法和溶胶-凝胶法,在室温下制备虚拟磁性ZIF-8分子印迹聚合物Fe3O4@ZIF-MIP,通过各项表征,证实材料性能良好.试验结果表明,该材料具有较好的吸附性能,在2,4-D的质量浓度为500 μg/mL时,Fe3O4@ZIF-MIP的吸附容量为120.31 mg/g,5 min即可达到吸附平衡,印迹因子约为3.64.该材料结合了ZIF-8骨架性质稳定、比表面积大、有磁性和MIP特异性吸附的优点,利用外加磁场进行分离,避免了离心等复杂操作,所制备的材料可重复使用至少6个吸附-解吸循环,通过优化吸附和解吸条件,结合HPLC检测,将建立的分析方法成功应用于蔬菜样品中低浓度2,4-D的富集和检测.

