实时荧光跨越式滚环等温扩增熔解曲线法检测复合调味料中的沙门氏菌
陈秀玲,杨倩,郭威,张蕴哲,袁耀武,张伟,,*
(1.河北农业大学 食品科技学院,河北 保定 071001;2.河北农业大学 理工学院,河北 沧州 061100;3.河北农业大学 生命科学学院,河北 保定 071001)
复合调味料经加工后可制成液态、半固态或固态产品[1]。随着经济的发展,消费者对易烹饪和耗时少的食品的需求不断增加[2]。复合调味料因便捷、高效的特点,在餐饮企业、食品加工业及家庭厨房中广受欢迎[3]。其主要原料包括咸味料、香辛料和鲜味料等,原料种类繁多可能会导致复合调味料在生产及加工过程中受沙门氏菌污染[4-8]。沙门氏菌易生存,即使在水分活度较低或含盐环境中仍能存活,且随着水分活度降低,热阻能力增加,更使其难以灭活[9-12]。因此,复合调味料中可能存在沙门氏菌污染的风险,对公共健康造成威胁。2018年首次发布关于复合调味料的国家标准(GB 31644-2018),要求沙门氏菌不得检出[13]。
沙门氏菌能导致人及动物患病,是引起食源性疾病的最主要因素之一[14-16]。其感染剂量较低,对于高度易感染人群仅需15~20 CFU/g即可引起感染[17]。人体感染沙门氏菌后可能会出现腹泻、腹痛等症状,严重时甚至会导致死亡[18-19]。因此,开发特异、灵敏、快速的检测新方法,可及时检出沙门氏菌,避免食物中毒。
本研究团队发明的跨越式滚环扩增技术(saltatory rolling circle amplification,SRCA),在BstDNA聚合酶的作用下仅需一对引物即可在恒温条件下实现扩增[20],其反应原理见图1,在BstDNA聚合酶作用下扩增反应会跨越线性DNA两端缺口,随后置换先前的延伸产物。先前的扩增产物像“盒尺一样不断被拉长”,最终产生大量不同长度的双链DNA,该方法已成功用于食源性致病菌的检测[21-23]。
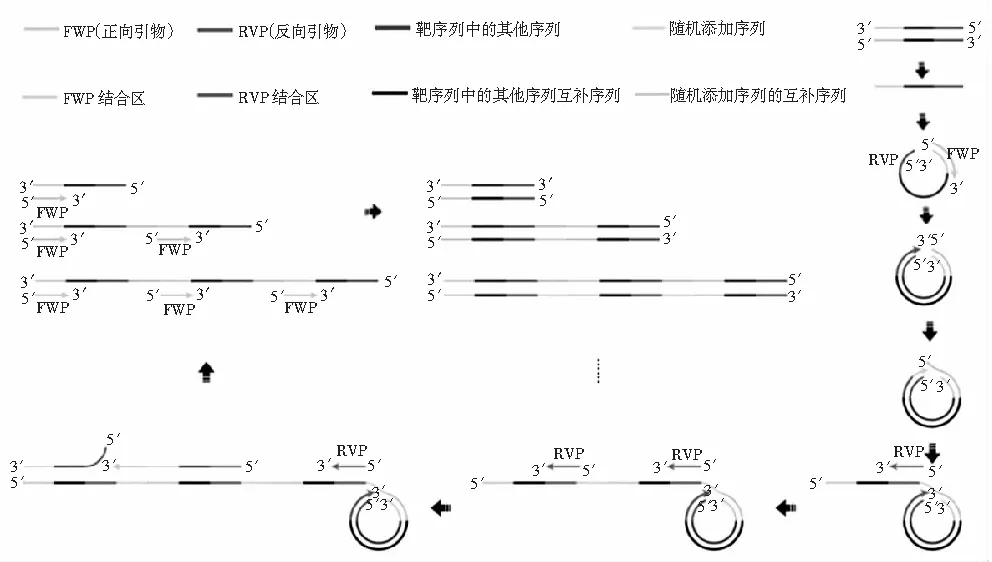
图1 SRCA反应原理图Fig.1 The schematic diagram of SRCA reaction
本研究将SRCA技术与荧光技术相结合,拟建立实时荧光跨越式滚环等温扩增熔解曲线法检测复合调味料中沙门氏菌的方法,为复合调味料的质量安全保驾护航。
1 材料与方法
1.1 材料
1.1.1 复合调味料的选择
沙拉酱:由江苏亚克西食品有限公司生产。
1.1.2 试验菌株
本研究共采用39株菌进行特异性分析,包括14株沙门氏菌和25株非沙门氏菌(见表1),所有菌株均在-80 ℃下保存于10%(W/V)甘油液中。
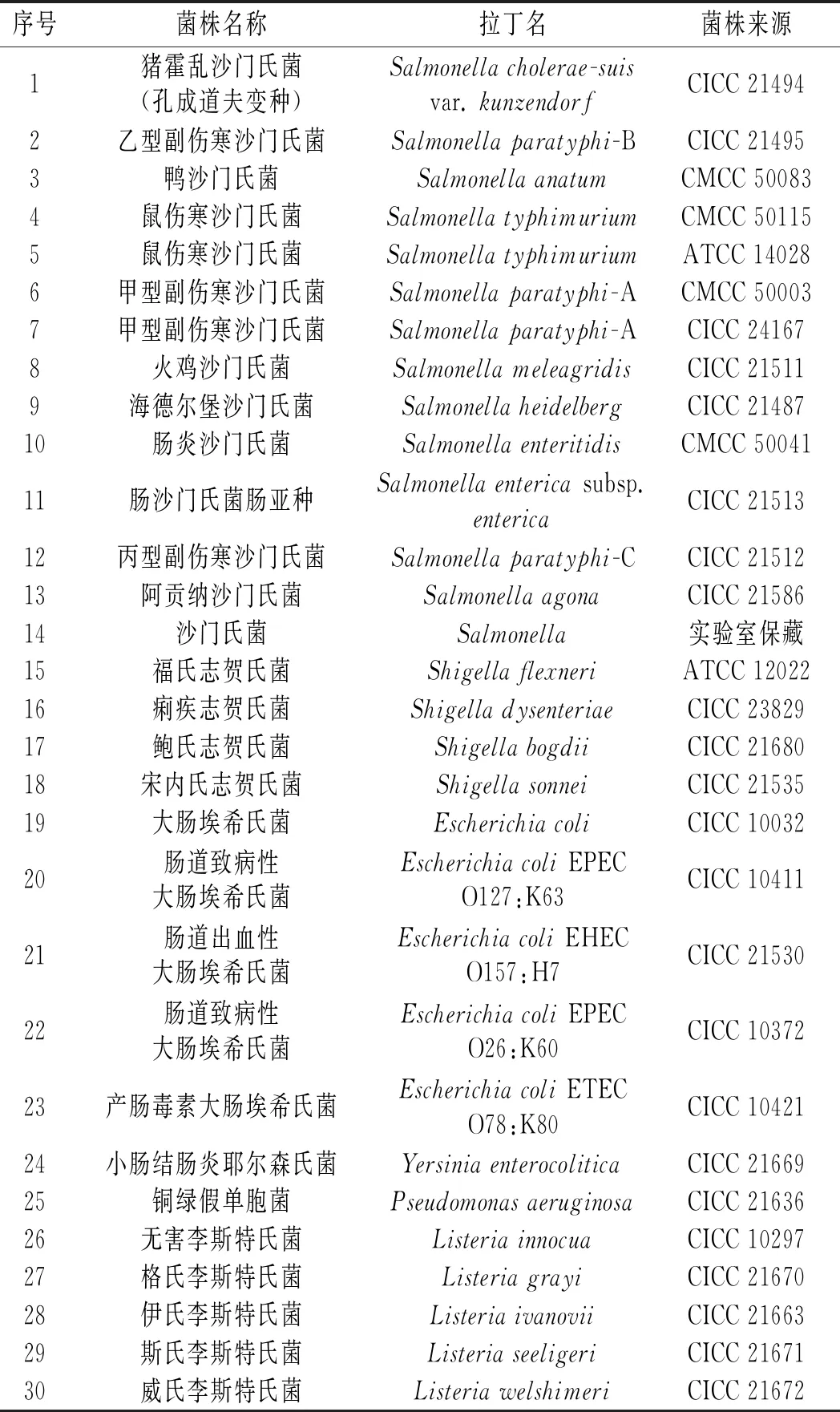
表1 试验菌株Table 1 The strains used in the experiment
1.1.3 主要培养基与试剂
营养肉汤、亚硫酸铋(BS)琼脂培养基和木糖赖氨酸脱氧胆盐(XLD)琼脂培养基:均购于北京陆桥技术有限公司。8000 U/mLBstDNA聚合酶:购于美国NEB有限公司;20×EvaGreen荧光染料:购于Biotium公司;SRCA引物:购于北京华大基因有限公司;2×EasyTaqPCR SuperMix:购于北京索莱宝科技公司。
DNA提取试剂盒TIANamp Bacteria Genomic DNA Kit:购于天根生化科技公司;基因克隆T4载体试剂盒、基因克隆试剂盒pMD18-T Vector Cloning Kit:均购于大连宝生物工程公司;凝胶回收试剂盒EasyPure®Quick Gel Extraction Kit、感受态细胞Trans1-T1 Phage Resistant Chemically Competent Cell:均购于北京全式金生物技术公司;沙门氏菌生化鉴定试剂盒:购于北京陆桥技术公司。
1.1.4 试验仪器与设备
参考郑陆的动物训练模型[6] ,运动组动物均进行一次性力竭离心运动(持续下坡跑),依次进行第I级负荷(0°,8.2m/min)15min(相当于53%VO2max)、第II级负荷(-5°,15m/min)15min(相当于64%VO2max)、第III级负荷(-10°,19.3m/min)(相当于76%VO2max)直至力竭。力竭标准为长时间运动后,大鼠趴伏于跑台上,在驱赶下也不能进行移动。
ABI Step One Plus实时定量PCR仪 美国应用生物系统公司;T-Gradient Thermoblock RF-PCR扩增仪 德国Biomedizinische Analytik公司;DYY-10C电泳仪 北京市六一仪器厂;JY04S-3E凝胶成像系统 北京君意电泳设备公司;无菌均质机 西安比朗生物科技公司;Nanodrop 2000分光光度计 美国Thermo科技公司;电热恒温培养箱 天津市泰斯特仪器公司;三孔电热恒温水槽 上海一恒科学仪器公司。
1.2 方法
1.2.1 菌株培养与DNA提取
将鼠伤寒沙门氏菌从冻存管中接种到营养肉汤中,用活化后传代培养3次的菌株进行选择性分离,从LB琼脂平板上挑取鼠伤寒沙门氏菌接种到营养肉汤液体培养基中,在37 ℃下,以220 r/min培养过夜,用于提取沙门氏菌基因组DNA。其他菌株在其适宜的培养基上活化完成后,挑取单菌落在斜面上划线培养,并保存在4 ℃下,备用。
采用商业试剂盒提取法进行模板DNA的提取,所提DNA模板通过Nanodrop 2000分光光度计对其浓度和纯度进行测定,选择质量好的模板于-20 ℃备用。
1.2.2 引物设计
本研究中选择沙门氏菌高度保守的invA基因设计引物。通过NCBI进行序列比对,选择特异性强、高度保守性的序列,最后确定沙门氏菌序列(GenBank:ALFE01000410.1)。利用DNAMAN和Primer Premier 5.0软件设计引物,由北京华大公司进行引物合成。RF-SRCA引物序列见表2。

表2 试验所用引物Table 2 The primers used in the experiment
1.2.3 RF-SRCA及RF-PCR反应体系
RF-SRCA熔解曲线方法总反应体积为20 μL,包括5 μL dNTPs(终浓度0.625 mmol/L),3 μL MgSO4(终浓度3.00 mmol/L),2.5 μL 2×ThermoPol®Reaction Buffer,1 μL上游引物(终0.50 μmol/L),1 μL下游引物(终0.50 μmol/L),模板DNA为1 μL(阴性不添加),8 UBstDNA聚合酶,0.8 μL 20×EvaGreen染料,4.7 μL无菌去离子水。94 ℃下预变性3 min,冰浴2 min;62 ℃下反应60 min,每1 min收集一次荧光信号;反应完成后从70 ℃以3.0 ℃/s的速度升温至95 ℃,绘制成熔解曲线。
为评价RF-SRCA方法,本研究与RF-PCR的灵敏度和检出限进行比较。RF-PCR反应体系为:2×EasyTaqPCR SuperMix(11 μL),沙门氏菌上下游引物各1 μL,DNA模板1 μL(阴性不添加),EvaGreen染料0.8 μL,加去离子水补至25 μL。RF-PCR的反应程序:94 ℃ 预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共40个循环;72 ℃再延伸5 min终止反应。熔解曲线分析程序:95 ℃加热15 s,降温至70 ℃,然后以0.3 ℃/s的速度升温至95 ℃,生成熔解曲线。
1.2.4 RF-SRCA产物熔解曲线分析
对RF-SRCA扩增产物进行熔解曲线分析,根据熔解曲线的熔解峰形及Tm值对扩增结果进行分析。阳性结果为单一尖锐熔解峰且Tm值在稳定范围,阴性无熔解峰。
1.2.5 RF-SRCA产物测序分析
扩增试验结束后,将反应产物进行琼脂糖凝胶电泳试验。紫外灯下选取典型的梯形条带,按由下至上的顺序切胶回收4条目的片段,随后对RF-SRCA扩增产物进行纯化测序分析。
1.2.6 RF-SRCA引物特异性分析
为评价RF-SRCA引物的特异性,选取14株沙门氏菌,25株非沙门氏菌(见表1),以无菌去离子水作为阴性对照,并通过熔解曲线法进行引物特异性分析。
1.2.7 灵敏度分析
为评估RF-SRCA熔解曲线方法检测沙门氏菌的灵敏度,取1 mL上述培养的新鲜菌液,采用试剂盒法提取全基因组DNA。经Nanodrop 2000分光光度计分析,确定沙门氏菌的浓度为60 ng/μL。用无菌去离子水对模板进行10倍梯度稀释,获得模板浓度范围为60 ng/μL~0.6 fg/μL。对各个梯度的模板进行RF-SRCA反应。扩增完成后通过熔解曲线法确定其灵敏度,同时与RF-PCR方法的灵敏度做比较。
1.2.8 人工污染沙拉酱中沙门氏菌的检出限分析
取25 g 不含沙门氏菌的沙拉酱加入到225 mL无菌生理盐水中均质,取1 mL沙门氏菌纯菌液加入上述9 mL均质液中,吹吸混匀后,用已灭菌的生理盐水对其进行10倍梯度连续稀释。根据平板计数法获得人工污染的沙拉酱中沙门氏菌浓度范围为4.6×10-1~4.6×108CFU/g。每个稀释度取1 mL菌悬液用于基因组DNA提取,通过分析,确定RF-SRCA熔解曲线法方法的检出限,并与RF-PCR方法检出限进行比较。
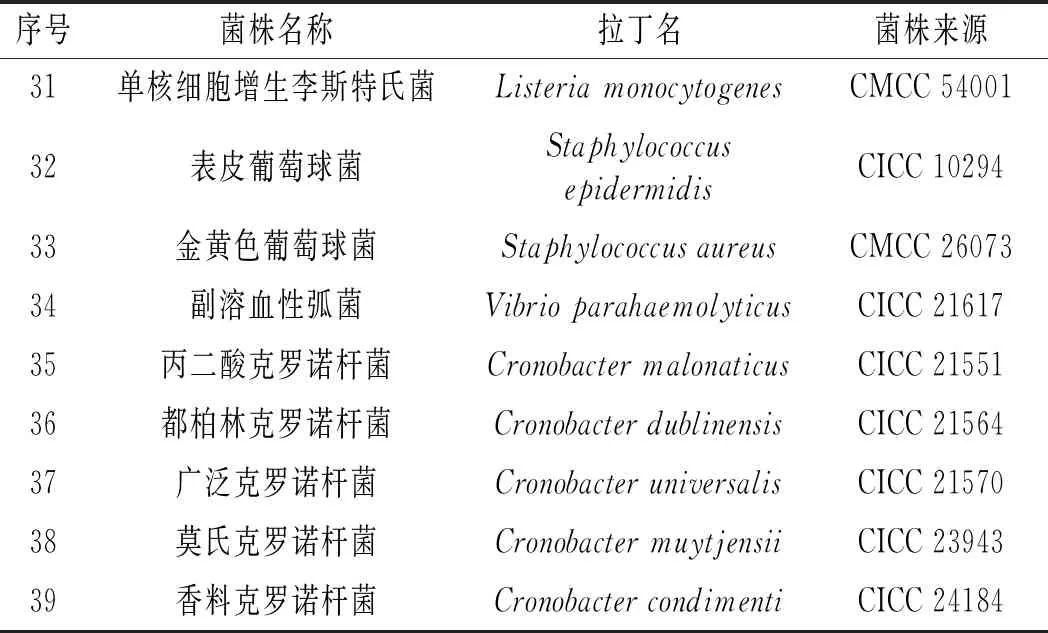
续 表
2 结果分析
2.1 RF-SRCA产物熔解曲线分析
在扩增过程中荧光染料EvaGreen会嵌入双链DNA的沟壑中,产生荧光信号。随着程序温度升高,DNA双链解开导致荧光染料释放,荧光信号随着温度的变化而发生改变。不同扩增产物根据产物长度及GC含量不同,会出现不同特征峰。SRCA产物熔解曲线结果见图2,沙门氏菌的熔解曲线有单一尖锐熔解峰,无杂峰,表明沙门氏菌扩增产物可通过熔解曲线进行分析。
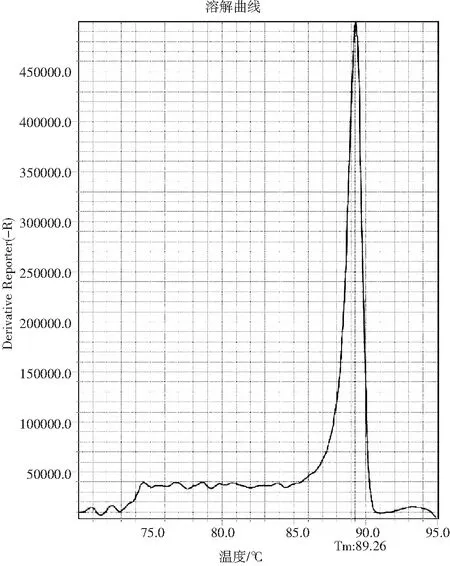
图2 熔解曲线分析Fig.2 The analysis of melting curve
2.2 RF-SRCA产物测序分析
为验证RF-SRCA扩增反应结果,对图3中A扩增产物的电泳条带(1~4)进行测序分析。沙门氏菌扩增产物测序结果见图3中C,通过分析可知,RF-SRCA产物由多条重复序列串联构成,且扩增产物由长度不同的片段组成,与凝胶电泳梯度条带相符。因此,可以验证本研究建立的RF-SRCA体系检测沙门氏菌扩增结果的正确性。

图3 RF-SRCA反应的测序分析Fig.3 The sequencing analysis of RF-SRCA reaction注:图A为RF-SRCA阳性扩增电泳结果,M为100 bp ladder marker,泳道1为沙门氏菌RF-SRCA阳性扩增结果;图B为设计沙门氏菌FWP及RVP的invA基因序列;图C为沙门氏菌的阳性扩增反应产物测序结果,1~4分别对应图A中从下至上的1~4条带;图B,C中横线标记部分为正向引物FWP,波浪线标记部分为反向引物RVP的反向互补序列,灰色部分为FWP互补序列上游的一段序列。
2.3 RF-SRCA引物特异性
本研究选择39株菌株进行特异性分析,扩增曲线结果见图4中A,14株沙门氏菌扩增曲线明显起峰,非沙门氏菌无扩增。熔解曲线见图4中B,14株沙门氏菌在89.20 ℃左右形成单一熔解峰,无引物二聚体和非特异性扩增产生,表明设计的RF-SRCA引物特异性良好。
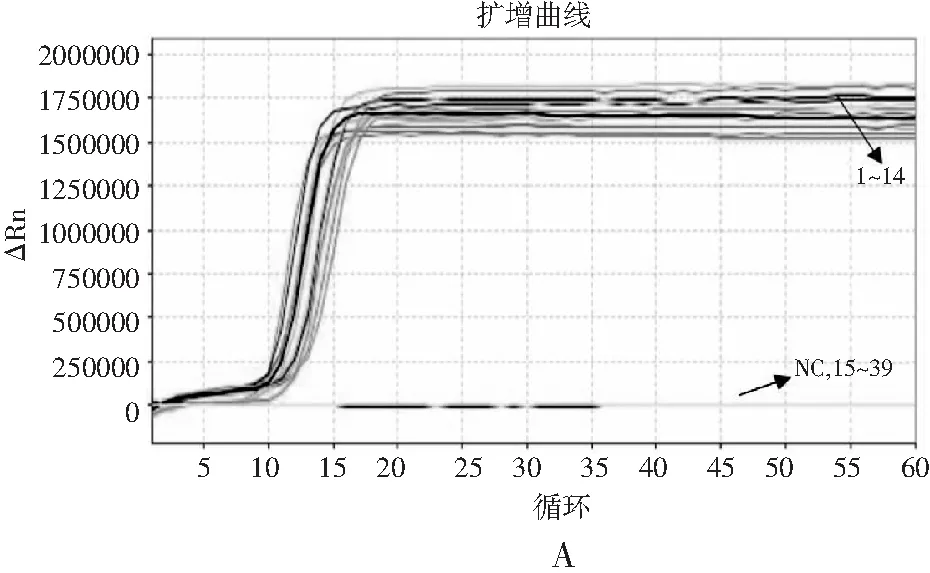
图4 引物特异性分析Fig.4 The specificity analysis of primers注:图A为RF-SRCA特异性分析扩增曲线,NC为阴性对照,1~14为表1中1~14号沙门氏菌,15~39为表1中15~39号非沙门氏菌;图B为RF-SRCA特异性分析熔解曲线。
2.4 灵敏度结果分析
以1.2.7中梯度稀释后的模板进行RF-SRCA反应,扩增完成后对其产物进行熔解曲线分析,结果见图5。模板DNA浓度范围为60 ng/μL~6 fg/μL时,沙门氏菌扩增曲线(见图5中A)起峰时间出现梯度递增,熔解曲线(见图5中B)为荧光强度递增的特异性熔解峰。模板DNA浓度为0.6 fg/μL时,扩增曲线无起峰现象,熔解曲线无明显熔解峰,为阴性结果。因此,RF-SRCA熔解曲线方法检测沙门氏菌的灵敏度为6 fg/μL。以同样的模板进行RF-PCR反应,扩增结果见图6中A和B。当模板DNA浓度范围为60 ng/μL~600 fg/μL时出现起峰时间梯度的扩增曲线,熔解曲线出现梯度特异性熔解峰。当模板浓度为60 fg/μL时无扩增曲线及特征熔解峰产生。因此,RF-PCR方法检测沙门氏菌的灵敏度为600 fg/μL。由此可知,RT-SRCA熔解曲线法检测沙门氏菌的灵敏度比RF-PCR方法灵敏度高100倍。
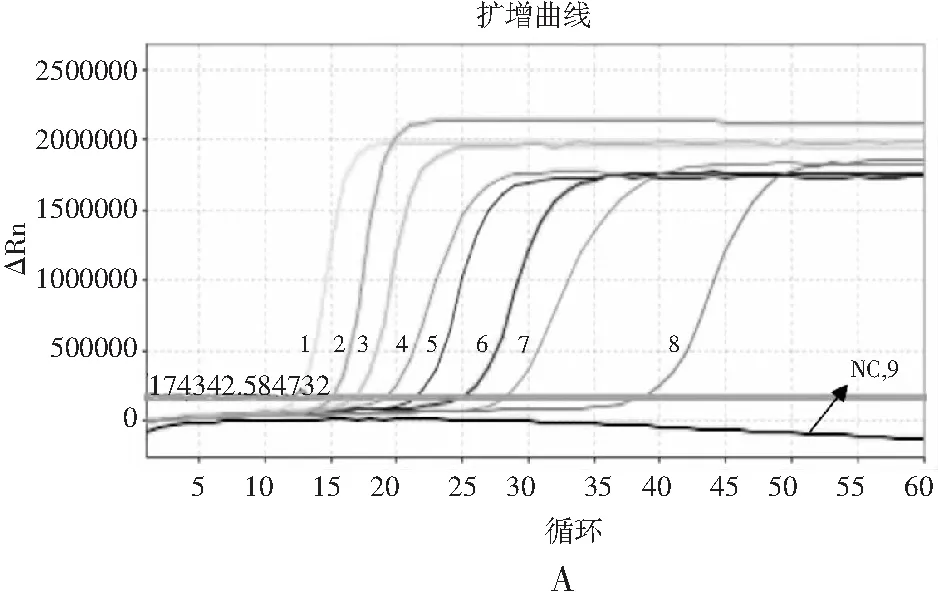
图5 RF-SRCA灵敏度分析Fig.5 The sensitivity analysis of RF-SRCA注:图A为RF-SRCA灵敏度分析扩增曲线,NC为阴性对照,1~9模板浓度为60 ng/μL~0.6 fg/μL;图B为RF-SRCA灵敏度熔解曲线。
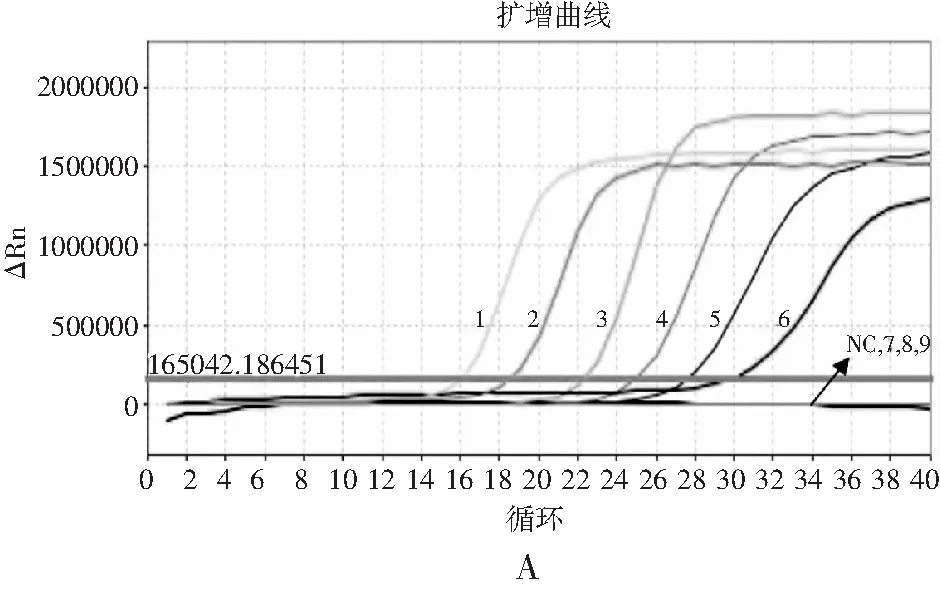
图6 RF-PCR灵敏度分析Fig.6 The sensitivity analysis of RF-PCR注:图A为RF-PCR灵敏度扩增曲线,NC为阴性对照,1~9模板浓度为60 ng/μL~0.6 fg/μL;图B为RF-PCR灵敏度熔解曲线。
2.5 人工污染沙拉酱中沙门氏菌检出限分析
分别用RF-SRCA和RF-PCR方法检测人工污染沙拉酱中的沙门氏菌。RF-SRCA结果见图7中A和B,菌液浓度为4.6×100~4.6×108CFU/g,扩增曲线起峰时间出现梯度递增,熔解曲线出现荧光信号梯度递增的特异性熔解峰,当菌液浓度为4.6×10-1CFU/g时无扩增曲线和熔解峰产生。因此,人工污染沙拉酱中沙门氏菌的检出限为4.6×100CFU/g。PCR方法检测结果见图8中A和B,当人工污染样品中菌液浓度为4.6×102~4.6×108CFU/g,出现阳性扩增,当菌液浓度小于4.6×102CFU/g时未出现阳性扩增。因此,RT-PCR方法检测污染沙拉酱中沙门氏菌的检出限为4.6×102CFU/g。由此可知,RF-SRCA熔解曲线法比RT-PCR方法检出限低100倍。
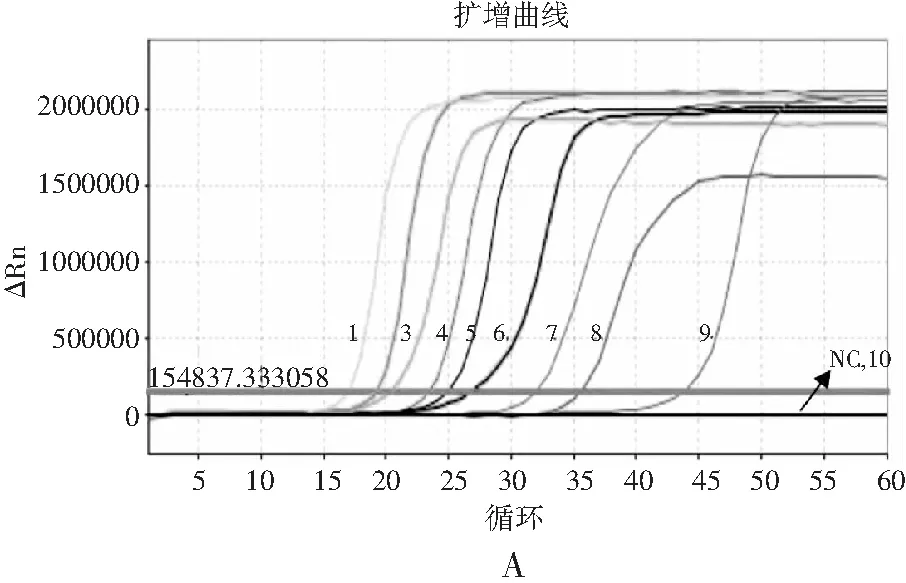
图7 RF-SRCA检出限分析Fig.7 The detection limit analysis of RF-SRCA注:图A为RF-SRCA检出限扩增曲线,NC为阴性对照,1~10菌液浓度为4.6×10-1~4.6×108 CFU/g;图B为RF-SRCA检出限熔解曲线。
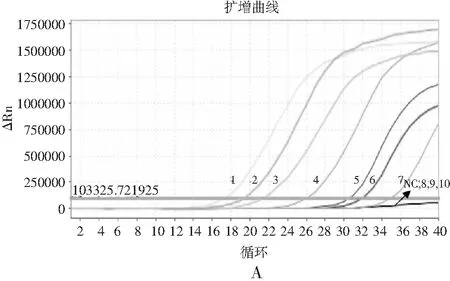
图8 RF-PCR检出限分析Fig.8 The detection limit analysis of RF-PCR注:A为RF-PCR检出限扩增曲线,NC为阴性对照,1~10菌液浓度为4.6×10-1~4.6×108 CFU/g ;B为RF-PCR检出限熔解曲线。
3 结论
本研究建立了RF-SRCA熔解曲线法检测复合调味品中沙门氏菌的方法,扩增完成后对产物进行熔解曲线分析,可排除引物二聚体或非特异产物对检测结果的影响,通过峰形和Tm值验证了扩增结果的准确性。本研究对沙门氏菌的扩增产物进行熔解曲线分析,结果显示熔解峰值稳定在一定范围(Tm值为(89.20±0.08)℃),无二聚体或非特异产物出现。利用RF-SRCA熔解曲线进行特异性检测,14株沙门氏菌为阳性,25株非沙门氏菌为阴性,结果表明引物特异性良好。RF-SRCA熔解曲线法检测沙门氏菌的灵敏度为6 fg/μL,较RF-PCR方法高100倍;人工污染沙拉酱中沙门氏菌的检出限为4.6×100CFU/g,较RF-PCR方法低100倍。综上所述,利用RF-SRCA检测食品中沙门氏菌切实可行,且该方法具有操作简便、灵敏、高效、结果可直接判定等优点,在食品安全检测领域具有良好的应用前景。

