牡蛎酶解产物对超负荷哺乳大鼠泌乳的影响
谌素华,秦小明, ,章超桦, ,曹文红, ,郑惠娜, ,林海生,
(1. 广东海洋大学食品科技学院/国家贝类加工技术研发分中心 (湛江)/广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/水产品深加工广东普通高等学校重点实验室,广东 湛江 524088; 2. 大连工业大学/海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
牡蛎属于软体动物门、双壳纲、珍珠贝目,俗称海蛎子、蚝等,是世界第一大养殖贝类[1]。牡蛎肉鲜味美、营养丰富,富含蛋白质,其氨基酸组成和品质优于人乳和牛乳,有“海底牛奶”之称[2]。牡蛎具有独特的食用、药用价值,是我国首批被列为药食同源的保健食品之一[3]。据《神龙本草经》和《傅青主女科》记载,蛎肉治虚损,疗妇人气血;治产后汗出烦躁,效果显著。研究表明,牡蛎酶解产物 (Oyster enzymatic hydrolysate products,OEHP) 具有增强免疫力[4]、抗肿瘤[5]、抗癌[6]、抗氧化[7]、降血压[8]、降血糖[9]和抗炎[10]等多种生物活性,但有关OEHP对泌乳的作用和机理等尚未见报道。
母乳含有丰富的免疫物质和活性生长因子,能全面满足婴儿生长、发育的需要,母乳喂养是全球公认的最佳喂养方式[11-13]。目前受职业女性增加、剖宫产率增高、母乳喂养知识缺乏、膳食营养不均衡、生活方式改变以及社会环境等因素的影响,产后缺乳症逐年攀升,母乳喂养现状堪忧[14-17]。基于牡蛎的药食两用价值,有必要对其促进泌乳作用进行深入研究。本研究先开展了牡蛎粉对哺乳期超负荷哺乳母鼠泌乳影响的预实验,结果显示牡蛎粉能显著改善哺乳期母鼠泌乳,在此基础上,采用大鼠超负荷哺乳模型探索了OEHP对母鼠泌乳的调节作用,以期为牡蛎资源的开发与利用提供参考依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级健康SD大鼠 (49日龄未配种大鼠),购于北京华阜康生物科技有限公司,动物生产许可号为SCXK [(京) 2019-0008]。其中,雌性60只,雄性30只,雌鼠体质量为180~200 g,雄鼠体质量为 200~250 g。
香港牡蛎 (Crassostrea hongkongensis) 购于湛江霞山东风水产品市场,新鲜开壳清洗干净,匀浆后冷冻干燥超微粉碎过100目筛制得牡蛎粉(Oyster powder, OP) 备用。OEHP的制备采用常格[18]方法,加入动物蛋白水解酶 (1 000 U·g-1),53 ℃酶解4 h后离心取上清液浓缩冷冻干燥,得OEHP备用。
动物蛋白水解酶 (酶活为18×104U·g-1,南宁庞博生物工程有限公司);硼酸、无水碳酸钠、无水乙醇、浓硫酸、浓盐酸、硫酸钾、葡萄糖、正丁醇、五水合硫酸、三氯乙酸、二甲苯 (分析纯,广东光华科技股份有限公司);苏木精伊红染色剂(>200 T)、水合氯醛、乙酸锌、福林酚、牛血清蛋白 (97%纯度)、PRL试剂盒 (广州鼎国生物技术有限责任公司)。
1.2 主要仪器与设备
UX42OH电子天平、HC10002小动物电子秤、ATY1124电子天平 (日本岛津公司);RM2016石蜡切片机、KD-H烘片机、DMI4000B智能型倒置荧光显微镜 (德国Leica公司);Varioskan Flash全自动酶标仪 (美国Thermo公司)。
1.3 方法
1.3.1 一般营养成分测定 水分按照GB 5009.3—2010采用常压干燥法测定;灰分按照GB 5009.4—2010采用高温灼烧法测定;脂肪按照GB 5009.6—2003采用索氏抽提法测定;蛋白质按照GB 5009.5—2010采用凯氏定氮法测定,转换系数为6.25;总糖采用蒽酮比色法测定,测得标准曲线为y=0.005 9x+0.000 6 (R2=0.998 6)。
1.3.2 牡蛎粉和OEHP的灌胃量确定 参考胡培丽等[19]的方法,开展牡蛎粉对哺乳期母鼠泌乳的预实验,灌胃剂量参考1 800 mg·kg-1;结合牡蛎酶解粉蛋白质含量及动物实验实际情况确定本实验的灌胃剂量,按照1∶2∶4选择高、中、低剂量,确定OEHP的灌胃高、中、低剂量为1 250、625、312.5 mg·kg-1。
1.3.3 大鼠同笼交配 雌雄比2∶1,连续同笼7 d,交配后的雌鼠合笼饲养,每笼5只。妊娠20 d后,将雌孕鼠单笼饲养,做好分娩准备,每日观察2次,及时了解大鼠分娩及分娩的胎仔数量,分娩结束后,清点仔鼠数。
1.3.4 超负荷哺乳模型建立 参考胡培丽等[19]和汪琴等[20]的方法,建立大鼠超负荷哺乳模型,取产仔前后相差不超过24 h的40只母鼠作为研究对象,每窝仔鼠调整为14只。在哺乳期前5 d一旦发现仔鼠死亡,记为仔鼠自然死亡,立即补充仔鼠到14只;超过5 d后仔鼠死亡,则不再补充异窝仔鼠。将母鼠按体质量随机分为对照组和OEHP高、中、低剂量组,每组10只。自分娩第二日起,对照组每日以蒸馏水灌胃,给药组分别以不同浓度的OEHP灌胃,每日1次,各组均灌胃21 d,各组动物均正常饮水。哺乳母鼠和仔鼠每天称体质量1次,分别计算期间哺乳母鼠泌乳量和仔鼠平均体增重。每日观察仔鼠死亡情况。
1.3.5 相关指标测定 1) 母鼠泌乳量测定。母鼠产仔后第二日起,每日08:00时将仔鼠与母鼠分离,待仔鼠饥饿4 h后,即12:00时对仔鼠进行哺乳前称量,之后将仔鼠放回鼠窝中哺乳1 h,然后再次分离仔鼠与母鼠,并对哺乳1 h后的仔鼠进行称量,仔鼠哺乳1 h前后的体质量差值即为这一小时的泌乳量。2) 仔鼠平均体增重测定。仔鼠从产后第二日起,每日08:00时将仔鼠与母鼠分离后立即称量每窝仔鼠体质量,持续称量21 d,记录数据,计算21 d仔鼠前后体质量差。3) 乳腺器官指数、脏器指数测定。处死母鼠后剪取第三对乳腺称质量;分别剪取母鼠心脏、胸腺、脾脏、肝脏、肾脏等称质量并计算。乳腺指数=乳腺组织质量/母鼠体质量×100%,脏器指数=脏器组织质量/母鼠体质量×100%。4) 泌乳素 (Prolactin, PRL) 测定。PRL测定方法按试剂盒说明操作,酶标仪检测,以标准物浓度为横坐标,标准物的OD值为纵坐标绘制标准曲线,计算出直线回归方程,再将样品的OD值代入直线回归方程中,计算样品浓度,即为母鼠血清PRL浓度,测得标准曲线为y=0.001 6x-0.032 2(R2=0.998 2)。5) HE染色法观察乳腺组织结构。实验结束时处死母鼠,剪取第三对乳腺,固定后染色镜检进行组织病理学观察。
1.4 数据统计分析
所有实验数据采用SPSS 22.0软件进行统计和分析,利用独立性t检验进行差异显著性分析,结果均以“平均值±标准误”表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 一般营养成分测定
牡蛎粉和OEHP一般营养成分测定结果见表1,两者的蛋白质质量分数最高,其次是总糖,而脂肪质量分数较低。
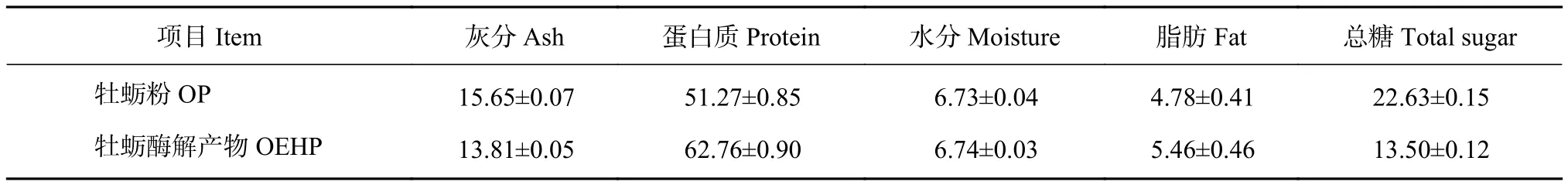
表1 牡蛎及其酶解产物一般营养成分 (干基)Table 1 General nutrition indices and enzymatic hydrolysate products of oyster (dry mass basis) %
2.2 OEHP对超负荷哺乳母鼠泌乳量的影响
对超负荷哺乳大鼠持续灌胃21 d的每天每小时泌乳量和总平均泌乳量进行分析,结果见表2和表3。与对照组比较,OEHP高剂量组母鼠的每天每小时泌乳量有显著性差异 (P<0.05) 的天数是第3、第4、第5、第6、第10、第11、第14、第15和第18天,有极显著差异 (P<0.01) 的天数是第1、第2、第7、第9、第12、第13、第16、第17、第20和第21天;中剂量组母鼠的每小时泌乳量有显著性差异 (P<0.05) 的是第2、第3、第4、第11和第16天,有极显著差异 (P<0.01) 的天数是第9、第12、第13、第14、第18、第20和第21天;仅第8和第19天各剂量组母鼠每小时泌乳量无显著差异;低剂量组母鼠每小时泌乳量有显著性差异 (P<0.05) 的是第3、第16和第18天。与中剂量组相比,高剂量组母鼠每小时泌乳量在第6和第10天有显著性差异 (P<0.05),在第1和第17天有极显著差异 (P<0.01);与低剂量组相比,高剂量组在第5、第6、第7、第12和第16天有显著差异 (P<0.05),在第1、第2、第9、第13、第17和第21天有极显著差异 (P<0.01);与低剂量组相比,中剂量组在第5、第12和第14天有显著性差异 (P<0.05),在第20天有极显著差异 (P<0.01)。本结果表明,OEHP高剂量组可显著增加哺乳期母鼠的泌乳量,中剂量组的影响次之,低剂量组的影响最小且效果不显著,OEHP对超负荷哺乳母鼠泌乳的影响与灌胃剂量呈正相关。
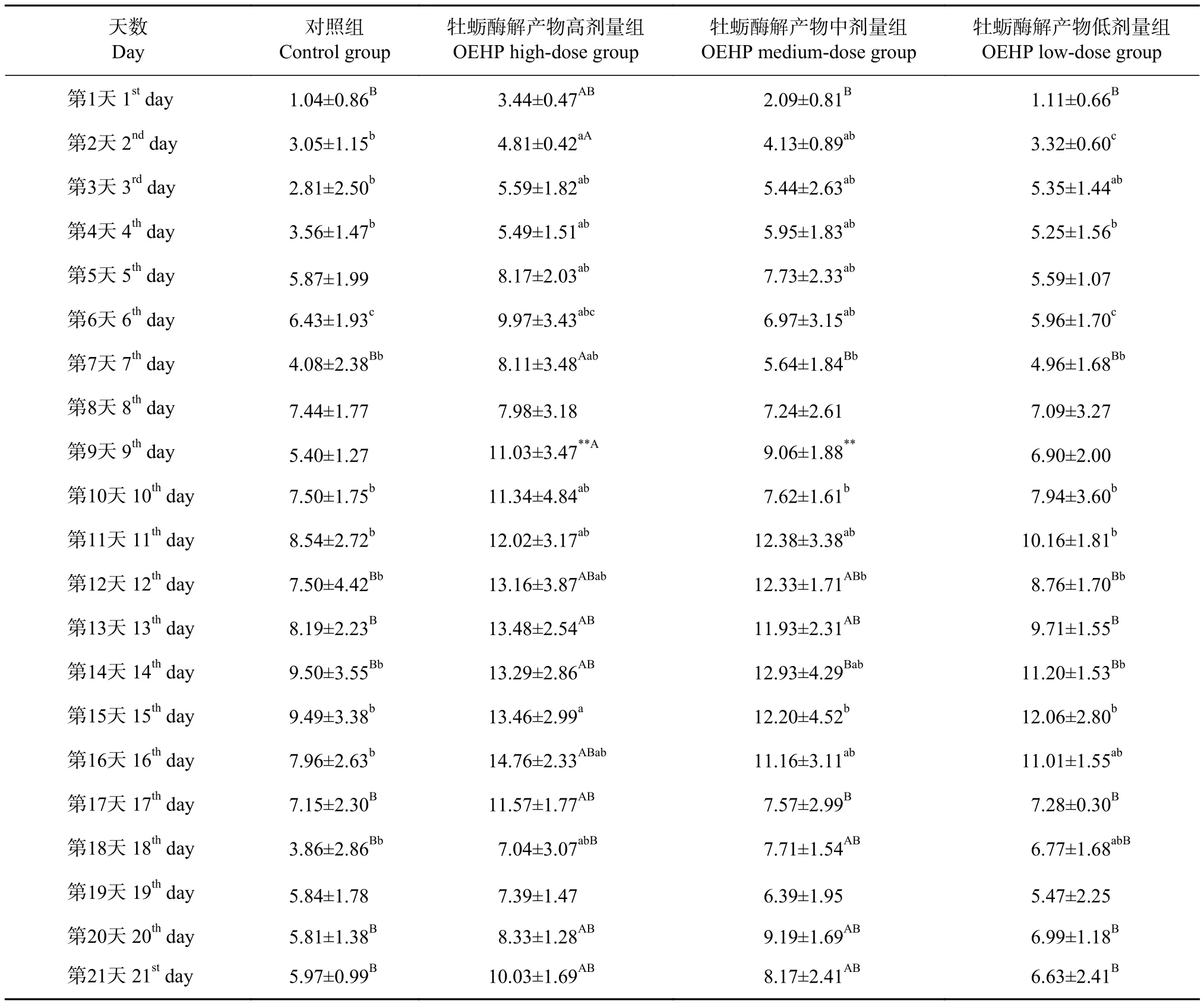
表2 母鼠哺乳21 d每天每小时泌乳量Table 2 Maternal milk production per hour per day for female rats lactated for 21 d g·h-1
对灌胃21 d的各组母鼠总平均泌乳量进行分析,结果见表3。与对照组相比,OEHP高剂量组差异极显著 (P<0.01),泌乳量增加57.85%;中剂量组差异显著 (P<0.05),泌乳量增加38.02%;低剂量组差异不显著,但泌乳量增加17.69%。以上结果表明OEHP使超负荷哺乳母鼠泌乳量显著增加,可有效促进超负荷哺乳母鼠泌乳。
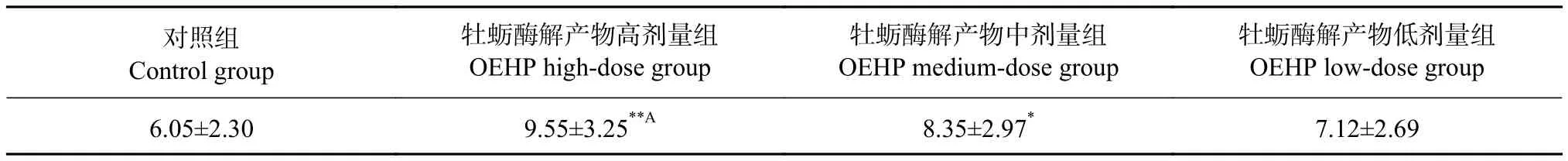
表3 母鼠哺乳21 d每小时泌乳量总平均值Table 3 Total average maternal milk production per hour per day for female rats lactated for 21 d g
2.3 OEHP对哺乳期仔鼠体增重的影响
本实验对哺乳21 d的仔鼠进行观察记录,未发现死亡现象。并对其体增重进行分析 (表4)。母鼠哺乳21 d后,OEHP高、中、低剂量组仔鼠体增重与对照组相比均有增加,分别增长13.62%、12.28%、11.99%,且差异极显著 (P<0.01),高剂量组与中低剂量组相比有显著差异 (P<0.05)。本结果表明OEHP能明显增加超负荷哺乳母鼠的泌乳量,从而使其窝仔鼠的体增重显著增加,这一评价指标也表明OEHP对哺乳期母鼠有促进泌乳作用,可减少仔鼠的死亡。

表4 21 d仔鼠体增重Table 4 Total average body weight gain of newborn rats in 21 d g
2.4 OEHP对超负荷哺乳母鼠乳腺器官指数和脏器指数的影响
对灌胃21 d母鼠的乳腺器官指数和脏器指数进行分析,结果见表5和表6。OEHP高剂量组的乳腺器官指数与对照组差异极显著 (P<0.01),中剂量组与低剂量组差异显著 (P<0.05)。本结果显示各组乳腺器官指数由大到小的顺序为高剂量组>中剂量组>低剂量组>对照组。乳腺器官指数能从侧面反映哺乳期母鼠乳腺的生长、发育与泌乳情况,说明OEHP可以促进超负荷哺乳母鼠乳腺发育。

表5 母鼠乳腺器官指数Table 5 Mammary gland organ indexes of female rats
与对照组相比,灌胃OEHP各剂量组的母鼠心脏指数有显著差异 (P<0.05),其中高剂量组差异极显著 (P<0.01),说明OEHP能促进哺乳期母鼠的心脏发育,使其泵血更有力,从而增强哺乳期母鼠的负荷能力 (表6)。高剂量组母鼠的脾脏指数与对照组相比差异显著 (P<0.05),且肾脏指数差异极显著 (P<0.01)。各组母鼠的脏器指数与对照组相比均有不同程度的增加,说明OEHP能增强超负荷哺乳母鼠的脏器负荷能力,有利于其哺育仔鼠。
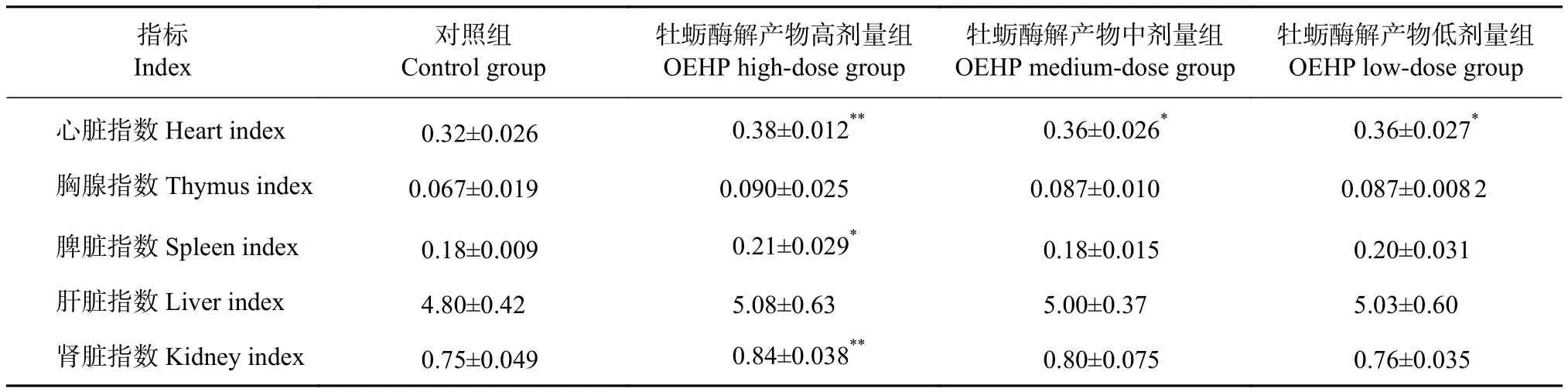
表6 母鼠脏器器官指数Table 6 Organ indexes of female rats
2.5 OEHP对超负荷哺乳母鼠血清PRL浓度的影响
对灌胃21 d的各组哺乳母鼠的血清PRL进行分析,结果见表7。与对照组相比,高剂量组PRL质量浓度增加了41.67%,有极显著性差异(P<0.01);中剂量组增加26.39%,有显著性差异(P<0.05);低剂量组增加11.11%;OEHP高剂量组的PRL质量浓度比低剂量组高27.50%,有显著差异 (P<0.05)。由此可以得出OEHP高、中剂量组促进超负荷哺乳期母鼠泌乳的效果显著,且存在一定的剂量依赖性。
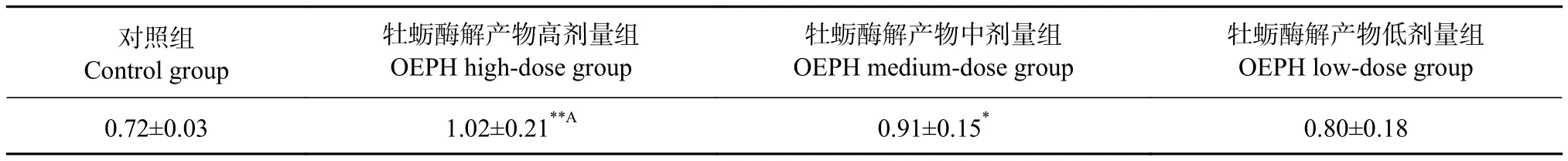
表7 母鼠血清催乳素质量浓度Table 7 Serum PRL mass concentrations of female rats ng·mL-1
2.6 OEHP对超负荷哺乳母鼠乳腺组织结构的影响
对灌胃21 d各组母鼠的乳腺组织结构进行观察,结果见图1。与对照组相比,OEHP各剂量组的母鼠乳腺组织腺泡较多,且集中,泡腔充盈,导管数量多,导管腔较粗,腺泡有明显扩大增生,OEHP高剂量组的效果最明显,说明OEHP能促进超负荷哺乳母鼠乳腺发育,改善其乳腺结构,提高哺乳母鼠泌乳量,促进泌乳。

图1 各组乳腺组织结构Figure 1 Tissue structure of mammary gland in each group
3 讨论
大鼠泌乳调节方式同人类相似,在血浆PRL的调节下启动和维持泌乳。在动物实验中,虽然不易观察正常哺乳的催乳作用,但能观察到乳汁分泌不足情况[21],所以在进行泌乳实验时首先要建立乳汁不足的动物模型。常用的大鼠缺乳模型有2种:1) 用化学药物处理大鼠,使母鼠缺乳,建立病理模型;2) 通过调整每只母鼠所哺育的仔鼠数量,使母鼠在哺乳一定数量的仔鼠时不能满足仔鼠的哺乳需求,为超负荷大鼠模型。产后缺乳是指产后哺乳期内产妇乳汁甚少或无乳可下,不够喂养婴儿,乳房检查松软无痛,乳汁点滴而出[22]。为了能更好地贴合临床实际,本研究采用正常大鼠超负荷哺乳模型来研究OEHP对母鼠泌乳的影响。
关于牡蛎促进泌乳的研究报道较少,有种含牡蛎粉的营养品和组合物能促进产妇泌乳和恢复[23-24],其主要通过添加一定量的牡蛎营养品来促进泌乳作用,而有关牡蛎促进泌乳作用及其机制的研究未见报道。本文通过开展牡蛎粉对哺乳期超负荷哺乳母鼠泌乳的预实验,确定牡蛎粉能有效改善超负荷母鼠泌乳,结合牡蛎粉在酶解后富含活性多肽且更容易被吸收利用的特点,对OEHP进行促进泌乳效果研究,为下一步对OEHP中促进泌乳的活性成分的研究奠定基础。
乳腺是泌乳的前提,乳腺由乳腺组织和分布期间的结缔组织构成[25],其发育区别于机体其他组织器官,是哺乳动物出生后可继续生长发育的动态变化的器官。泌乳过程以乳腺发育为基础,发育完善的乳腺在PRL等作用下开始泌乳的发动和维持,而泌乳的每个阶段受不同激素的影响,参与调节的主要激素包括PRL[26]、生长激素 (Growth homorne,GH)[27]、雌性激素[28],在乳腺发育阶段受雌激素和孕激素的影响,泌乳发动阶段主要受PRL和糖皮质激素的影响,乳腺泌乳的维持阶段受PRL和GH的调控[29]。乳汁的分泌过程首先是乳腺组织的分泌细胞从血液中吸取各种营养成分,随后细胞利用这些养分合成乳汁,乳汁合成后分泌到腺泡中,最后经过导管等分泌到体外。腺泡可以理解为暂时储存乳汁的空间[30],所以腺泡腔体大小可反映泌乳能力,腺泡腔体越大,泌乳量越多。乳腺上皮细胞在PRL的作用下,其新陈代谢速度加快,乳蛋白mRNA浓度也相应增加[31]。王一飞等[32]通过研究发现“米酒鸡”食疗方可使产后缺乳母鼠的催乳素受体 (PRLR) 及β酪蛋白阳性表达增强,促进乳腺上皮细胞增殖和乳腺发育。张荣庆等[33]通过研究大豆黄酮对妊娠大鼠乳腺发育和泌乳作用的影响,发现大豆黄酮能够显著促进妊娠期大鼠乳腺的发育,明显提高其泌乳量、血清GH和PRL浓度以及乳腺胞浆雌二醇受体数目。本实验测定了哺乳母鼠血清PRL浓度,结果表明OEHP高、中剂量组能够促进超负荷哺乳母鼠泌乳且效果显著,但缺少对母鼠乳腺组织中PRL水平分析,后续实验可通过增加此项来完善OEHP对超负荷哺乳母鼠泌乳效果及机制的研究。
4 结论
OEHP对超负荷哺乳母鼠泌乳的影响与灌胃剂量呈正相关,高剂量组可显著增加哺乳期母鼠的泌乳量;OEHP高、中、低剂量组仔鼠体增重与对照组相比分别增加13.62%、12.28%、11.99%,且差异极显著 (P<0.01),OEHP高剂量组与中、低剂量组相比,仔鼠体增重有显著差异 (P<0.05);OEHP各剂量组母鼠乳腺指数与对照组相比有显著差异(P<0.05);OEHP高、中剂量组哺乳母鼠血清PRL水平与对照组相比差异显著,且与灌胃剂量呈正相关。OEHP组与对照组的脏器指数相比均有不同程度增加,表明OEHP能够增强哺乳期母鼠的脏器负荷能力,有利于其哺育仔鼠;在显微镜下观察,OEHP组母鼠乳腺腺泡组织比对照组多且集中,泡腔充盈,导管数量多,导管腔较粗,腺泡有明显扩大,表明OEHP能促进超负荷哺乳母鼠乳腺发育,改善其乳腺结构,提高哺乳母鼠泌乳量,促进泌乳。

