DWI 联合DCE 技术在乳腺良恶性病变中的临床应用价值
蒋春峰
(江苏省南通市通州区人民医院放射科,南通 226300)
磁共振成像(magnetic resonance imaging,MRI)没有电离辐射,软组织分辨力高,已成为乳腺病变的临床常用影像检查方法。早期乳腺癌和乳腺良性病变的临床症状均以乳房包块、疼痛为主,术前鉴别诊断病变性质较困难,如能早期发现并治疗,可以明显改善乳腺癌患者的预后[1-2]。磁共振扩散加权成像(diffusion-weighted imaging,DWI)联合乳腺动态增强(dynamic contrast enhanced,DCE)技术能为乳腺病变的早期发现、早期诊断提供可靠的微循环及病变形态影像学依据,两者联合应用显著提高了乳腺病变的检出率及定性准确率。
1 资料与方法
1.1 一般资料 收集2020 年4 月—2021 年1 月在南通市通州区人民医院经过临床随访或术后病理证实的乳腺病变65例患者的磁共振资料,均为女性,年龄20~85 岁,平均(45.6±8.6)岁;绝经45例,非绝经20例;主要临床表现为乳腺胀痛、乳头溢液及乳腺肿块。非绝经患者检查时系月经周期第2 周。良性病变32例,其中纤维腺瘤24例(75.0%),导管内乳头状瘤5例(15.6%),乳腺增生2例(6.3%),积乳囊肿1例(3.1%);恶性病变33例,其中浸润性导管癌29例(87.9%),浸润性小叶癌2例(6.1%),髓样癌2例(6.1%)。
1.2 检查方法 所有患者均在西门子(Siemens skyro)3.0 超导型磁共振扫描仪上完成检查,使用4通道相控阵乳腺专用线圈,取俯卧位头先进,双乳自然下垂,尽量避免挤压。DWI 采用SE-EPI 序列横断位扫描,层厚及层距分别为4 mm 及0.8 mm,重复时间(time of repeitition,TR)/回波时间(time of echo,TE)=4 300ms/84 ms,扩散敏感系数b 值取0、400、800 s/mm2,激励次数4。DCE 采用三维容积抑脂T1 序列横断位扫描,层厚为1 mm,TR/TE=4.5 ms/1.58 ms,分6 个时相采集图像,每个时相90 s,按照0.2 mmol/kg 静脉团注钆特酸葡胺,注射速率2.5 mL/s,以相同速率追加注射20 mL 生理盐水。
1.3 图像处理及分析 将各序列图像导入syngo MRB19 工作站进行处理,以DWI 发现的可疑病灶及早期强化的区域为感兴趣区,范围在2 mm 以上为标准。在表观扩散系数(apparent diffusion coefficient,ADC)图上对感兴趣区进行ADC 值测量,在DCE 图上分析感兴趣区的时间信号曲线(timeintensity curve,TIC),观察TIC 的类型。
由2 名经验丰富的高年资影像诊断医师采用双盲法,对A 组(DWI)、B 组(DCE)以及C 组(DWI 联合DCE)的MRI 图像资料进行分析和判断,比较3 种方法的病变检出率、定性率和定性准确率。
1.4 统计学方法 应用SPSS 17.0 统计软件,病变检出率及定性准确率比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组乳腺病变检出率和定性准确率的比较 结果显示,C 组病变检出率及定性率均明显高于A、B组(均P<0.05);且C 组定性准确率明显高于A、B 组(P<0.05),见表1。
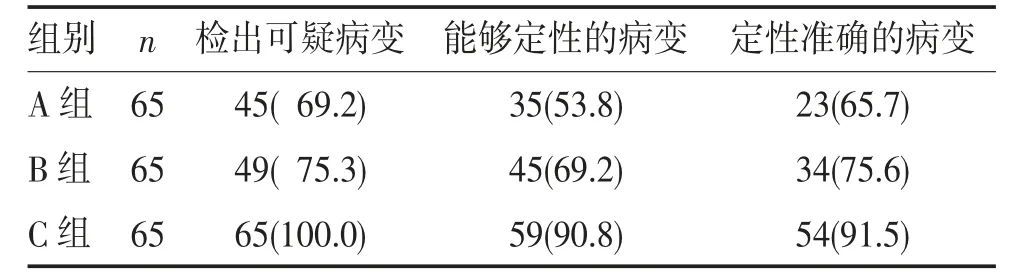
表1 3 组乳腺病变检出率和定性准确率比较(n,%)
2.2 乳腺良恶性病变及正常乳腺ADC 值比较 分别测量良性病变、恶性病变及正常腺体的ADC 值,在b=800 s/mm2时,良性病变ADC 为(1.067~1.723)×10-3mm2/s,平均(1.395±0.328)×10-3mm2/s;恶性病变ADC 为(0.604~1.228)×10-3mm2/s,平均(0.916±0.312)×10-3mm2/s;正常腺体ADC 为(2.062~2.316)×10-3mm2/s,平均(2.189±0.127)×10-3mm2/s,3 者比较差异有统计学意义(P<0.05)。
3 讨论
乳腺癌是女性常见的恶性肿瘤,发病率居女性恶性肿瘤的首位,近几年有增高趋势,已成为威胁女性生命健康的主要原因[3-5]。因此,乳腺病变的早期发现、早期诊断、早期确定治疗方案可以明显改善患者预后。目前乳腺病变的影像学常规检查有超声及钼靶,但其敏感性、特异性较低,尤其对致密型乳腺、微小病灶及非肿块样病灶诊断较困难[6]。随着MRI 技术的发展,乳腺MRI 技术已从单纯解剖形态学发展到MR 功能成像,DWI、DCE 在乳腺病变中的应用也越来越多。
DWI 是一种能评价活体组织水分子弥散程度的无创性MRI 检查方法,在活体组织内,水分子扩散与组织细胞的细胞膜、基底膜等膜结构分布有关,在不同性质病变中细胞密度不同,导致水分子弥散程度不同,进而获得不同ADC 值[7]。它能反映水分子在活体组织中的运动和扩散,在分子水平上提供组织代谢信息,反映活体组织的结构特征,同时可以计算ADC 值进行定量分析。在疾病的早期阶段,人体组织中只发生微观结构的变化和细胞内外水分子的运动状态变化。DWI 能无创地反映水分子的运动状态,对于常规T1WI、T2WI 序列不能显示或鉴别的病变,其检测灵敏度很高。当水分子扩散正常时,图像显示等信号变化;当水分子扩散受限时,DWI 上出现高信号,ADC 图上出现低信号。b 值表示扩散的加权程度,是扩散的敏感系数。本研究中,b 值=800 s/mm2时ADC 值的测量稳定,且可获得较好的信噪比图像。ADC 值是DWI 提供的一个定量指标,能反映病变的微观结构变化,广泛应用于不同部位良恶性肿瘤的鉴别诊断及恶性肿瘤放化疗的效果评价。乳腺恶性病变由于其肿瘤细胞增生异常,间质成分较少,核质比明显增高,含水量减少,因此水分子扩散受限,ADC 值降低,DWI 图像上呈高信号;而良性病变则细胞外间隙较大,相对恶性病变水分子易扩散,致使得到的ADC 值较高[8],DWI 图上呈等信号。因此,可通过测量乳腺病变的ADC 值,分辨乳腺良性病变与恶性病灶组织内部的水分子扩散运动差异进行诊断[9-11],本研究中,b=800 s/mm2时乳腺良性病变与恶性病变ADC 值比较差异有统计学意义(P<0.05)。定性结果与病理检查有较高的一致性。但研究[12]显示DWI 在微血管较丰富的组织中,由微灌注导致的信号衰减会干扰组织本身的ADC 值,因此对血供丰富的恶性肿瘤DWI 诊断准确率下降。
DCE 是一种动态增强技术,可以反映病变的血供特点。恶性肿瘤新生微血管密度大,基底膜不完整,通透性高,病变与血管内对比剂交换速度快,表现为早期强化。良性病变血管反应性增生,血管通透性轻度增高,对比剂交换速度慢,强化晚。因此,恶性病变内对比剂的集聚较良性病变多,速度快,处于高灌注状态,病变通常表现“快进快出”的增强模式,时间信号曲线通常呈流出型;良性病变常表现“连续”增强模式,时间信号曲线常呈流入型。DCE 序列采用各向同性三维容积高分辨率扫描,空间分辨率设置为1 mm×1 mm×1 mm,并辅助了内插算法,使空间分辨率达0.5~0.6 mm,为小病灶的形态特征判断提供良好的空间分辨率,可以进行任意方位的多平面重建,多角度去观察病灶,免除了矢状位和冠状位扫描而通过图像重建获得,也缩短了患者检查时间,实现了同一时间点多平面的显示。同时造影剂的应用使病变在正常乳腺背景下得到充分的显示,更加清晰地显示乳腺病灶与周围正常乳腺组织的界限,乳腺病变的许多重要征象(如形状、边缘、内部强化方式等)通过增强扫描得到较好显示,便于医师进行阅片和判断病灶性质[13-15]。
因此,DWI 联合DCE 技术可以将乳腺不同病变组织的水分子扩散特征与乳腺不同病变组织血供特征和病变形态方面的特点结合起来,提供更多的病变信息,弥补了彼此的局限性,依据病变的ADC 值和时间信号曲线,明显提高了乳腺病变诊断的可靠性。本研究中DWI 联合DCE 技术对乳腺病变的定性率为90.8%,定性准确率为91.5%,均明显高于单独DWI、单独DCE 检查。
总之,DWI 联合DCE 技术可以整合病变的解剖信息、血液循环灌注信息和分子信息,从不同角度反映乳腺病变的形态和功能变化,进一步提高乳腺病变检出率和定性准确率,减少漏诊和误诊,为临床提供更全面、更可靠的影像证据,可广泛应用于临床检查。

