芸豆加工过程中蛋白-多酚复合物功能性质的变化
刘妍兵 陶 阳 苗 雪 刁静静 张东杰,2 陈洪生 王长远
(黑龙江八一农垦大学食品学院1,大庆 163319) (黑龙江八一农垦大学国家杂粮工程技术研究中心2,大庆 163319) (黑龙江八一农垦大学粮食副产物加工与利用教育部工程研究中心3,大庆 163319)
芸豆(PhaseolusvulgarisL)属蝶形花科菜豆,是我国主要杂粮作物之一,据国际粮农组织统计,芸豆是世界上栽培面积第二大的豆类农作物,仅次于黄豆[1]。芸豆含有丰富的淀粉、蛋白质、纤维素、矿物质以及人体所需的必需氨基酸[2],其中淀粉质量分数为40%~60%、蛋白质质量分数20%~30%、粗脂肪质量分数为1%~3%、多酚含量是绿豆种子的4.5倍,B、C族维生素质量分数丰富,也是镁、钾、钠等元素的良好来源[3]。目前,大多数研究集中于芸豆淀粉的制取、速食芸豆以及鲜食芸豆产品等制品的开发,这些都源于芸豆具有较好的营养功效。
蛋白质和多酚是芸豆的重要组成成分,芸豆蛋白具有良好的加工特性及一定的药用价值,是一种新型的植物蛋白资源[4]。芸豆多酚是芸豆的次生代谢产物之一,分子中一般具有苯环、一个或多个邻位酚羟基和对位酚羟基。充足的多酚摄入可以使机体免受自由基的损害,避免细胞氧化损伤[5],与芸豆的抗氧化性、降血脂等功效有关。有研究表明,多酚类物质可以与活泼的金属离子进行络合反应,也可以使蛋白质变性甚至失活,还可以与多糖等物质反应,使其性质发生改变[6],从而弥补单一物质的不足与缺陷[7]。且多酚有可能通过非共价键或共价键结合蛋白质并与蛋白质形成可溶性或不可溶复合物,从而发挥抗氧化、降血脂、抗菌等功效[8]。即蛋白质经多酚修饰后会发生构象的变化从而改变其活性。谢凤英等[9]研究发现,在加热条件下多酚可以通过氢键、疏水相互作用与蛋白质氨基酸侧链形成复合物,致使复合物中多酚的功能性质发生改变,从而获得更好的生物活性。芸豆具有提高人体免疫力、促进新陈代谢等多种功能,这些功能均与其富含的功能成分有关,其中芸豆蛋白、芸豆多酚有很好的营养价值,但这些成分在热处理过程中均会受到不同程度的影响,从而改变其理化特性、结构特性以及功能活性,但目前对于芸豆加工过程中蛋白与多酚功能活性变化规律的研究还不甚清楚。因此,本研究探讨了芸豆蛋白-多酚复合物在热处理过程的功能活性及结构的变化,以期为芸豆的精深加工提供理论参考。
1 材料与方法
1.1 材料与试剂
英国红芸豆、大豆色拉油;2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、凯氏定氮催化剂、十二烷基硫酸钠(SDS)均为分析纯;芦丁标准品为色谱级。
1.2 仪器与设备
FD-1B-80冻干机,A25-digital实验室高剪切乳化机,NP-40L悬臂式电动搅拌器,SKD-2000全自动凯氏定氮仪,BIO-Rad Mini-Protean电泳仪。
1.3 方法
1.3.1 芸豆蛋白的制备
参照马文鹏等[10]的方法。首先将英国红芸豆清洗,于40 ℃烘箱中烘干,采用高速粉碎机粉碎后过80目筛,获得的红芸豆粉末与正己烷1∶3(g/mL)混合后脱脂24 h,脱脂后于通风橱干燥,干燥后的红芸豆粉与去离子水1∶10(g/mL)混合并用2 mol/L的NaOH溶液调pH至9.5,于室温下搅拌2 h后,以4 500 r/min离心条件下离心20 min,弃沉淀,留取上清液,采用2 mol/L的HCl溶液调pH至4.5,室温下搅拌2 h后4 500 r/min离心20 min,弃上清液,留沉淀,以适量去离子水溶解后调pH至7.0,获得芸豆蛋白溶液,冻干备用(蛋白质质量分数86.77%)。
1.3.2 芸豆多酚制备
参照陈纯琦[11]方法。将芸豆粉末过80目筛,称取2 g筛下物样品于超声-微波瓶中,加入体积分数为60%的乙醇溶液(料液比1∶30)进行超声波-微波协同处理,处理条件:功率为500 W,处理时间2.5 min,温度55 ℃,将超声-微波处理后的样品于3 000 r/min离心处理,取上清液抽滤弃去多余残渣,将样品溶液于50 ℃条件下旋蒸,所得溶液冻干处理,获得芸豆多酚,于干燥避光条件下保存。
1.3.3 芸豆蛋白-多酚相互作用
准确称量芸豆蛋白样品2 g与0.1 g多酚(蛋白、多酚按照芸豆籽粒中比例),加入400 mL蒸馏水溶解,分别于室温(25 ℃)、熟制加工温度(70、80、90、100 ℃)条件下水浴搅拌15 min,反应结束后冷却至室温,冻干处理,获得不同温度条件下的蛋白-多酚复合物,冻干备用。
1.3.4 DPPH自由基的测定
按照韦芳媚等[12]的方法稍作修改,准确称取3.5 mg DPPH试剂于10 mL容量瓶中,无水乙醇定容溶解,再取DPPH溶液2 mL于100 mL容量瓶中定容,获得DPPH实验溶液。准确称量蛋白-多酚复合物5.2 mg,无水乙醇定容至100 mL容量瓶中,摇匀获得样品溶液。于10 mL比色管中加入4 mL DPPH实验溶液和4 mL样品溶液,加入无水乙醇定容至刻度线,混合均匀于1 cm3比色皿中,517 nm波长下测定吸光值(A1),再于室温避光条件下保存30 min,测定吸光值记为A2,以DPPH乙醇溶液为空白对照,测定吸光值(A3),重复3次实验,取平均值。由公式计算DPPH自由基清除率。
(1)
式中:A1为加样品后DPPH溶液的吸光度;A2为样品的吸光度;A3为未加样品时DPPH溶液的吸光度。
1.3.5 ABTS自由基测定
参考林恋竹等[13]的方法并稍作修改,将样品配制成浓度为40 μL/mL的溶液,对ABTS自由基的清除能力进行测定。用PBS稀释已配好的ABTS自由基存储液,作为工作液。各处理组分别取100 μL样品加入96孔酶标板,再加入100 μL的ABTS自由基工作液混匀,黑暗中静置50 min,于734 nm处测定吸光度,以ABTS自由基存储液为空白对照,重复3次实验,取平均值。由式(2)计算不同处理组的ABTS自由基清除率。
(2)
式中:A0为不加样品时的吸光度;Ai为加入各处理组样品后的吸光度。
1.3.6 溶解性的测定
参照胡娜等[14]的方法,稍作修改,表示方法为氮溶指数(NSI)。五种温度处理下互作的芸豆蛋白质-多酚样品各取2 g放于100 mL的烧杯中,加入双蒸水混合并充分搅拌,0.05 mol/L的HCl溶液及0.05 mol/L的NaOH溶液将pH调节至7.0,随后于100 mL的容量瓶定容,在室温下条件下磁力搅拌20 min,在10 000 r/min条件下离心20 min,取上层清液5 mL,用凯氏定氮仪测定上层清液中的蛋白质质量分数。3次平行实验取平均值。
(3)
1.3.7 乳化性和乳化稳定性的测定
参照Pearce等[15]的方法,并作出适当修改。五种温度处理下得到的互作的芸豆蛋白-多酚样品分别配制成质量浓度为1 g/L的样品溶液,各取24 mL,用0.1 mol/L的HCl溶液或0.1 mol/L的NaOH溶液分别调pH至3.0、5.0、7.0、9.0,再分别加入大豆色拉油8 mL,用剪切乳化仪10 000 r/min处理后立即在容器底部快速取样100 μL,再用质量分数为0.1%的SDS溶液稀释该溶液至100倍,混合摇匀后于500 nm处测定吸光值,空白试样为SDS标准溶液,放置10 min后于室温条件下再取样品测定乳化稳定性(ESI),3次实验取平均值。
乳化活性(EAI)和乳化稳定性(ESI)按公式计算:
(4)
(5)
式中:C为样品质量浓度/g/mL;Φ为乳化液中油相比例,Φ=0.25;L为比色杯光径;N为稀释倍数;A0为乳化液的吸光值;A10为10 min后的吸光值。
1.3.8 起泡性和泡沫稳定性的测定
参考Wang等[16]方法并稍作修改,分别取40 mL,配制质量浓度为20 g/L的蛋白溶液,用0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液分别调pH至3.0、5.0、7.0、9.0,置于高速搅拌器中,转速为10 000 r/min条件下搅打3 min,测量搅打停止时泡沫及液体总体积为V0以及搅打30 min后的泡沫及液体总体积V1,起泡性和稳定性计算公式为:
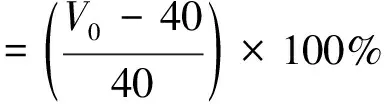
(6)
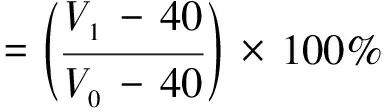
(7)
1.3.9 外光谱的测定
取冻干后的蛋白-多酚复合物粉末于40 ℃真空条件下干燥24 h,准确称取100 mg溴化钾和1 mg样品混合研磨压片,采用傅里叶转换红外光谱仪(FTIR)测定其谱图,测定条件:吸收光谱为400~4 000 cm-1,波数度为0.01 cm-1,分辨率为2 cm-1扫描128次。
1.3.10 电泳的测定
参考张舒等[17]的实验方法并稍作修改。准确称取100 mg冻干的样品粉末溶解于500 μL浓度为0.5 mol/L氯化钠-磷酸缓冲液中,在涡旋缓冲器中振荡2~3 h,随后10 000 r/min离心5 min,弃去上清液,重复离心3次。加入500 μL试样提取液,室温下振荡溶解2 h,15 000 r/min离心5 min,冷藏条件保存上清液。取上清液200 μL沸水浴3 min。样品上样量10 μL,浓缩胶质量分数5%,分离胶质量分数12%。SDS-PAGE具体操作条件,样品在浓缩胶阶段采用80 V电压,分离胶阶段调整至120 V,直至到达分离胶底部停止电泳。浸泡在染色液中染色4 h,随后脱色液脱色。洗脱完成,凝胶成像系统拍照,结果采用labworks 4.5软件分析。
1.4 数据统计与分析
所有数据均为3次重复实验平均值,采用Statistix 8对数据进行分析,平均值之间显著性差异(P<0.05)通过Turkey HSD进行多重比较分析。并采用SigmaPlot 13.0和Excel 6.0作图。
2 结果与分析
2.1 不同处理组样品抗氧化活性的变化
如图1所示25 ℃处理组的DPPH自由基、ABTS自由基清除率最高,此时因处理温度低,多酚和蛋白质结构未发生变化,多酚自身的活性没有发生变化,因此自由基清除率最高。随着处理温度的升高,自由基清除率随之降低,这可能是由于芸豆蛋白质空间结构舒展,结合位点暴露与多酚形成复合物,从而导致抗氧化性降低。李恩慧[18]通过分析牛血清蛋白结合蓝莓花色苷复合物清除自由基的能力发现两者的相互作用对多酚类物质的抗氧化性有抑制作用,与本文研究结果一致。当处理温度为80 ℃或90 ℃时,自由基清除能力相对稳定且处于较高水平,可能是由于芸豆中含有丰富的儿茶素、没食子酸等多酚类物质,这些物质B环和D环上的羟基结构使其具有较强的抗氧化活性。在加工过程中,这些物质受到温度的影响,会发生自氧化反应或者与蛋白质以共价键的形式连接起来,从而使其抗氧化性降低[19,20]。表没食子儿茶素没食子酸酯等物质在高温下会异构为没食子儿茶素没食子酸酯。Wang等[21]的研究也发现儿茶素等多酚类物质在98 ℃的高温下可发生异构化和自动氧化。另外,本研究热处理条件均在70 ℃以上,前期课题组的研究已发现芸豆蛋白的热变性温度为80 ℃,而研究发现没食子酸等物质容易与变性蛋白结合,所以在不同热处理温度下,芸豆蛋白与多酚形成了不同的复合物,因此芸豆蛋白-多酚复合物的抗氧化能力发生不同程度的改变。综上所述,为获得具有较强DPPH自由基、ABTS自由基清除能力的芸豆蛋白-多酚复合物处理温度应选为80 ℃或90 ℃。这与Li等[22]得到的处理温度相接近。
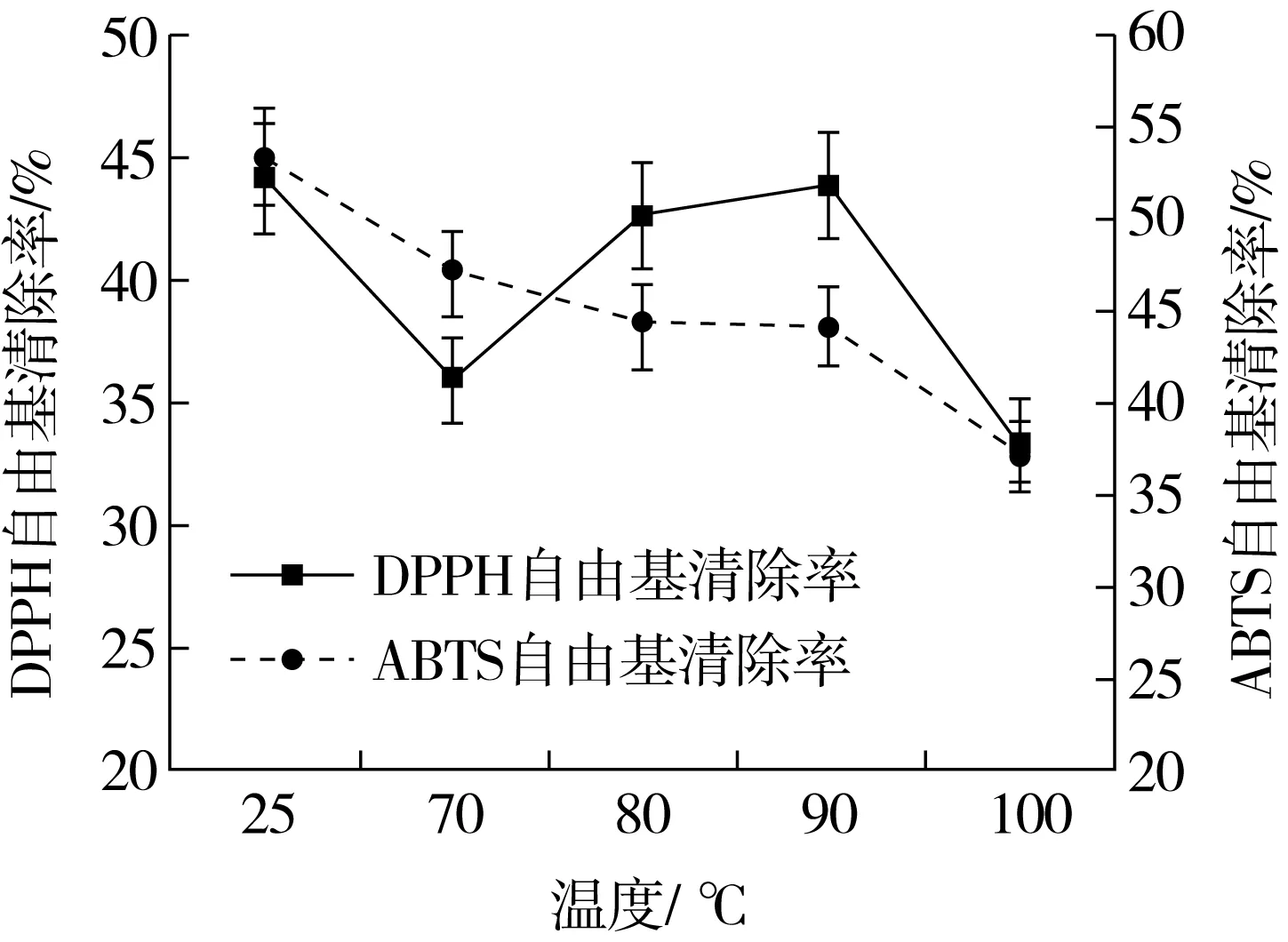
图1 不同处理温度处理对DPPH自由基、 ABTS自由基清除率的影响
2.2 不同处理温度对芸豆蛋白-多酚复合物溶解性的影响
由图2可见,不同处理温度下各个样品组的溶解性不同,与25 ℃处理组相比,高温处理组溶解性显著升高,这是由于温度的升高会促使蛋白结构舒展、疏水基团暴露,更易与水分子相互作用使其具有良好的溶解性[23,24],而温度的持续升高蛋白质空间构象发生改变,分子聚集从而影响样品的溶解性[25]。当蛋白质与多酚类化合物发生反应后可能会引起蛋白质交联,这种相互作用改变了蛋白质分子的净电荷,从而影响了其溶解性。Bourvellec等[26]的研究发现蛋白质与多酚相互作用后会引起其溶解性改变,这与本研究结果一致。综上所述,处理温度为80 ℃时芸豆蛋白-多酚复合物具有较高的溶解性。
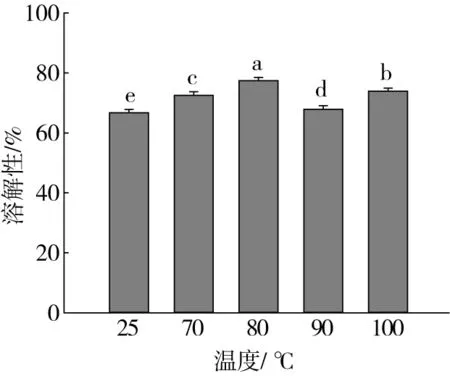
注:不同字母代表在P<0.05水平上具有显著性差异。下同。图2 不同处理温度对芸豆蛋白-多酚复合物溶解性的影响
2.3 不同处理温度、pH对芸豆蛋白-多酚复合物乳化性的影响
由图3可知,随着温度的升高,复合物的乳化性及其稳定性均呈现先增加后减小的趋势。在80 ℃时,复合物的乳化性和乳化稳定性与对照组相比差异显著(P<0.05),这可能是因为在此加热温度下,芸豆蛋白与多酚形成复合物增加了表面疏水性,且复合物具有更好的乳化稳定性,也可能是因为复合物包埋的液滴之间具有更强的斥力。这一研究结果与Wei等[27]的研究结果一致。当温度高于80 ℃时,热运动更加剧烈,蛋白质结构被破坏,甚至蛋白因此严重变性,溶解度和疏水性发生变化,絮凝和聚集加剧,乳化活性及稳定性下降。在pH 7.0和pH 9.0时,各个处理组的乳化性及其稳定性与酸性pH条件下差异显著(P<0.05),这可能是在低pH条件下蛋白质有很多结合位点,蛋白质和多酚的结合程度较大,且多是以非共价结合的形式为主,因此蛋白质的结构变化较大,所以乳化性较低。Wang等[28]将α-乳清蛋白与酚类物质复合,发现pH>7时,多酚容易被氧化形成自由基或者醌类物质,然后再以较稳定的共价形式与蛋白质结合[29]。而Prigent等[30]的研究则证实,高温环境下的酚易被氧化成醌类物质,从而在于蛋白结合过程中产生共价键。综合温度和pH对芸豆蛋白-多酚复合物的乳化性及其稳定性的影响来看,温度对乳化性及其稳定性的影响较大,其中在碱性条件下,80 ℃或90 ℃条件下形成的复合物具有较强的乳化性及其稳定性更好。
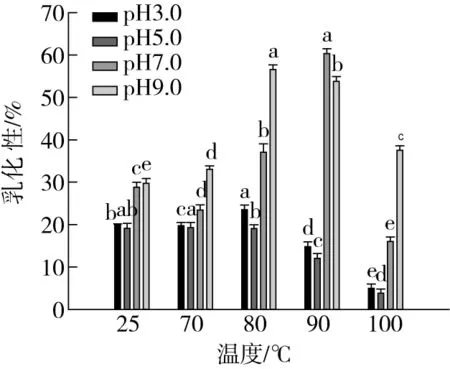

图3 不同处理温度对芸豆蛋白-多酚复合物 乳化性及其稳定性的影响
2.4 不同处理温度、pH对芸豆蛋白-多酚复合物起泡性能的影响
如图4所示,随着处理温度的升高,起泡性能出现先增加后减少的趋势,80 ℃芸豆蛋白-多酚复合物的起泡性及其泡沫稳定性与其他处理组相比较为显著(P<0.05),当温度继续升高,复合物的起泡性能下降。这是由于适当的高温处理使得蛋白质分子舒展,溶解度增加,界面处流变性质得到改善,相互作用增强[31]。另外pH对芸豆蛋白-多酚复合物的起泡性能影响也较为显著,总体来看在同一高温处理条件下,pH对复合物起泡性能影响不很显著,在25 ℃条件下,复合物的起泡性能受pH影响较显著(P<0.05)。另外在pH 3.0,70 ℃时泡沫稳定性远强于同温度下其他pH条件下的结果,这是由于此时pH接近等电点,存在较多的不溶解蛋白质颗粒使得表面黏度较强,间接增强了复合物的泡沫稳定性[32]。所以在温度为80 ℃时,芸豆蛋白-多酚复合物起泡性及其泡沫稳定性较好。
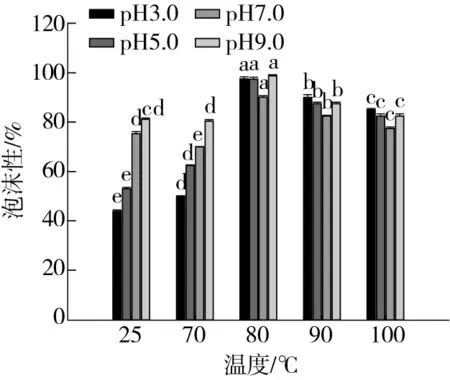
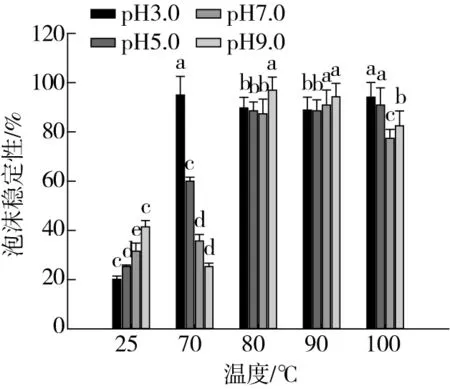
图4 不同处理温度对不同pH的蛋白-多酚体系 起泡性及泡沫稳定性的影响
2.5 不同处理温度对芸豆蛋白-多酚复合物FTIR光谱分析
FTIR光谱分析结果表明25 ℃时芸豆蛋白-多酚复合物表现出的主要峰值为3 417 cm-1(酰胺A带,代表N—H伸缩和氢键),2 927 cm-1(CH2不对称伸缩振动),1 640 cm-1(酰胺Ⅰ带,代表C—O伸缩/氢键和COO-)、1 402 cm-1(代表含苯环的黄酮类、生物碱类物质的主要基团,或者C—H弯曲和C—O伸缩)、1 240 cm-1(酰胺Ⅲ带)[33]。在热处理后,芸豆蛋白-多酚复合物的峰值与对照组相比发生了一定的变化,如形成的复合物在2 927 cm-1的峰值蓝移了约4 nm,说明蛋白质的—NH2参与了反应。另外,经过高温处理后芸豆蛋白-多酚复合物在3 292 cm-1处含有特征峰,且与李会梅[34]研究相比,芸豆蛋白-多酚复合物的峰值发生了7~8 nm的红移,说明酚羟基参与了多酚与蛋白质之间的反应。蛋白质的红外光谱变化多伴随着二级结构的变化,尤其是酰胺I带(1 600~1 700 cm-1)肽主链的变化,其特征吸收峰发生了不同程度的蓝移,表明蛋白质的结构也发生了改变[35],同时高温处理后在1 452、1 543 cm-1处出现了显著的吸收峰,其中1 452 cm-1处峰值代表CH2的变形振动或者复合物中含有黄酮及生物碱类等成分;1 543 cm-1处的吸收峰代表酰胺Ⅱ带,这说明高温处理后复合物中含有多酚类物质,并且蛋白质与多酚之间发生了共价反应。在温度达到80 ℃时,形成的复合物二级结构相对比较稳定,图谱变化趋势不明显。以上结果表明在高温条件下,芸豆蛋白-多酚可能发生了共价反应,因而结构发生了变化。
2.6 不同处理温度对蛋白-多酚复合物的电泳分析
如图5所示,在25 ℃下复合物还具有蛋白原有的亚基,在热处理后,6条亚基发生不同的变化,条带向上发生迁移[36],其中在43、52、66 ku的亚基在热处理后发生明显的聚集,这是由于SDS、β-巯基乙醇的加入破坏了非共价键[37],保留了共价键,使得电泳条带上移。这与Kroll等[38]研究报道蛋白质电泳条带的上移可证明蛋白质与植物多酚形成共价键相吻合。随着处理温度的升高,泳道顶部出现了明显的聚集现象,Cao等[39]、Feng等[40]的研究同样发现,复合物在泳道顶部出现聚集现象,并推测由于酚类物质的加入与蛋白形成共价键,影响了二硫键的形成,认为酚类可以与蛋白亲核基团发生共价结合。而温度达到100 ℃时,此条亚基条带颜色变浅,说明在此温度下蛋白质与多酚并没有发生显著的结合或者形成的复合物比率较低,推测在此温度下蛋白质的分子量发生了显著变化。结合功能性研究也可以发现,此时复合物的抗氧化活性和理化特性也发生了显著的变化,且与其他处理组相比,显著降低。
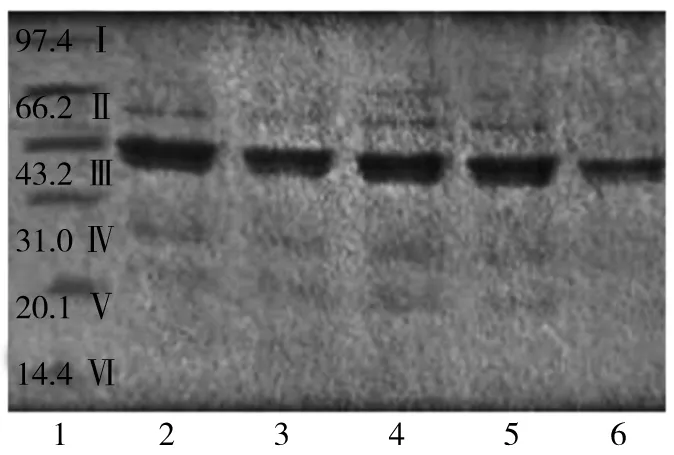
注:1为mark组;2为25 ℃时芸豆蛋白-多酚复合物;3为70 ℃时芸豆蛋白-多酚复合物;4为80 ℃时芸豆蛋白-多酚复合物;5为90 ℃时芸豆蛋白-多酚复合物;6为芸豆蛋白-多酚复合物。图5 不同处理温度下芸豆蛋白-多酚复合物的电泳分析
3 结论
考察不同加工温度下芸豆蛋白与多酚的相互作用,结果表明随着温度的升高,抗氧化活性降低,当温度升高到一定程度时,芸豆多酚与蛋白结构遭到严重破坏,从而使抗氧化活性迅速降低,通过理化功能实验发现热处理温度显著改变了芸豆蛋白-多酚复合物的溶解性、乳化性能和起泡性能,结合抗氧化实验和理化功能实验结果得出80 ℃时,形成的复合物DPPH清除率、ABTS自由基清除率分别达到41.37%、44.55%,溶解性达到77.4%,碱性环境下乳化性能也较对照组增加了26.95%,起泡性能也发生了同样的变化趋势。结合红外光谱与电泳结果推测芸豆蛋白与多酚在热处理过程中可能形成共价键,从而改变了复合物的活性。

