响应面法优化大果木姜子多糖提取工艺及抗氧化研究
魏晴,梁珊珊,3,孙庆文
(1.贵州中医药大学 药学院,贵州 贵阳 550025;2.贵州中医药大学 大果木姜子研究中心,贵州 贵阳 550025;3.贵州中医药大学 植物多糖研究中心,贵州 贵阳 550025)
大果木姜子是樟科樟属米槁(Cinnamomum migao H.W.Li)的干燥成熟果实,主要分布在我国西南地区,如贵州、云南和广西等地[1-2],具有温中散寒、理气止痛的治疗作用。可用于治疗胃痛、腹痛、胸痛等疾病[3]。大果木姜子在贵州是一种药食两用的植物,大果木姜子油常用于调味、去腥。而近年来研究表明大果木姜子具有抗心肌缺血、抗动脉粥样硬化的作用,以大果木姜子作为原料制成的中成药在临床中有很好的治疗作用[3-4]。此外,大果木姜子常用于治疗胃溃疡,已经有数百年历史,且效果显著。
近年来研究主要集中在大果木姜子的药理作用上,而对大果木姜子成分及提取工艺的研究未见报道[5-8]。传统的提取方法存在耗时长、溶剂使用量大、工艺复杂等弊端,不利于产业化生产;而超声辅助提取法具有操作简单、超声时间短、节省溶剂、提取效率高等优点,有利于大果木姜子的提取规模化和产业化生产。多糖被认为是生命科学中生物基材料(例如食品、化妆品、医疗设备和药物)生产的关键成分[9]。在过去的几十年中,多糖的生物活性已在生物化学和医学中引起越来越多的关注。在各种天然抗氧化剂中,多糖通常具有强抗氧化活性。抗氧化作用是多糖的主要的生物活性之一,多糖可以作为新型潜在的抗氧化剂而被探索[10-11]。大果木姜子抗氧化活性的研究目前尚未报道[12],因此本文采用响应面分析法优化大果木姜子多糖的提取工艺,并对多糖的抗氧化活性进行了研究,为大果木姜子深度开发提供了基础。
1 材料与方法
1.1 仪器与试剂
DR3900台式可见分光光度计:美国哈希公司;ES-A分析天平:天津市德安特传感技术有限公司;BKE-1006HT小型超声波清洗仪:山东博可超声设备有限公司。
葡萄糖标准品、DPPH:美国默克公司。其它化学试剂均为分析纯试剂。
1.2 材料
大果木姜子:采摘自贵州省黔南州罗甸县坝碰村,经贵州中医药大学药学院孙庆文教授鉴定为樟科樟属植物米槁(Cinnamomum migao H.W.Li)的干燥成熟果实。
1.3 方法
1.3.1 样品的前处理
将新鲜的大果木姜子置于阴凉处快速晾干,防止发霉,除去杂质,粉碎,过筛,即得大果木姜子粉末。
1.3.2 超声辅助提取的单因素试验
分别称取大果木姜子粉末5 g,以液料比、提取功率和超声时间为考察因素,考察不同单因素对多糖得率的影响。按照固定2个条件,考察另一个因素对多糖得率的影响程度,进行单因素试验,测定多糖得率。固定液料比20∶1(mL/g),提取功率80 W,考察超声时间在 25、30、35、40、45、50 min 时对多糖得率的影响;固定液料比 20∶1(mL/g),超声时间 30 min,考察提取功率在 20、40、60、80、100、120 W 时对多糖得率的影响;固定提取功率80 W,超声时间30 min,考察液料比在 10∶1、20∶1、30∶1、40∶1、50∶1、60∶1(mL/g)时对多糖得率的影响。
1.3.3 响应面优化试验
在单因素试验的基础上,对3个影响因素进行三因素三水平试验,试验方法参照文献中方法进行设计[13],表1为响应面因子水平及编码。
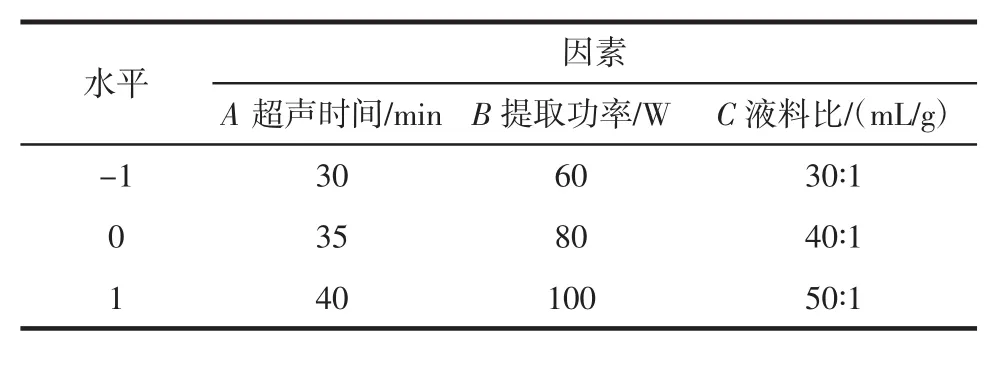
表1 响应面设计试验因素水平及编码Table 1 Response surface design test factor level and coding
1.3.4 多糖得率的测定
通过参考文献中的方法得到葡萄糖标准曲线为Y=7.999 8x+0.069 9,R2=0.999 6,样品多糖得率的测定参考文献[14]的方法。
1.3.5 大果木姜子多糖抗氧化活性研究
样品前处理参考文献[15]的方法,将溶液稀释分别得到 40、80、160、320、640、1 280 μg/mL 的待测样品溶液。大果木姜子对DPPH自由基清除能力[15-16]、对超氧阴离子自由基的清除作用[17-18]和对羟基自由基的清除作用[19]分别参考文献中的方法进行测定。
1.4 数据处理
将测得的数据用SPSS 22.0软件进行统计计算,运用Design-Expert 8.0.7软件进行响应面优化分析处理。
2 结果与分析
2.1 单因素试验结果
超声时间对大果木姜子多糖得率的影响见图1。
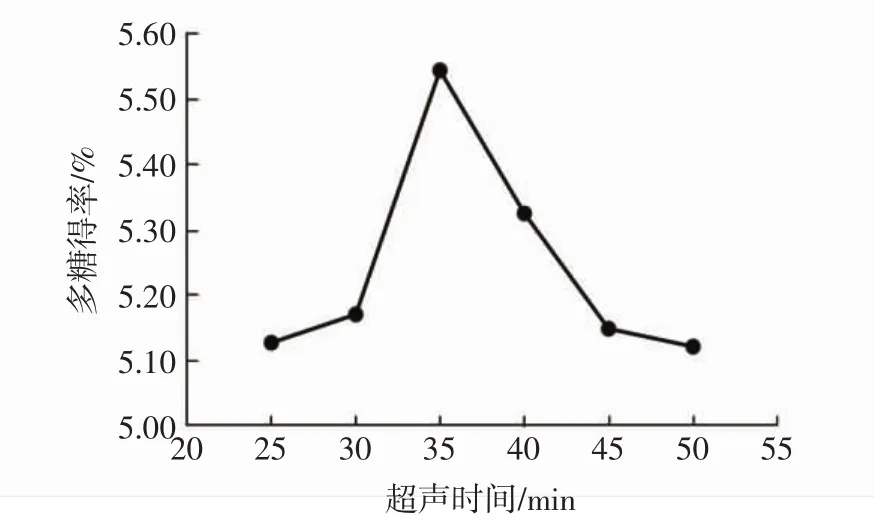
图1 超声时间对大果木姜子多糖得率的影响Fig.1 The effect of ultrasonic time on the yield of polysaccharides
由图1可知,固定液料比和提取功率,改变超声时间,大果木姜子多糖得率在35 min达到最高值,多糖得率为5.54%,35 min后多糖得率显著下降,可能是随着超声时间增加,大果木姜子中其他易溶于水的成分也被提取出来,使多糖在溶液中的占比下降,在45 min后水提液达到饱和,无更多成分被提取出来。
提取功率对大果木姜子多糖得率的影响见图2。
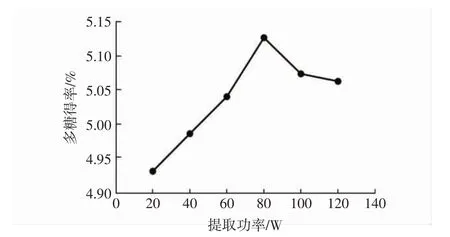
图2 提取功率对大果木姜子多糖得率的影响Fig.2 The effect of extraction power on the yield of polysaccharides
由图2可知,固定液料比和超声时间,改变提取功率,大果木姜子多糖得率在80 W达到峰值,多糖得率为5.13%,当提取功率超过80 W后,多糖得率显著下降,可能是随着提取功率增大,超声波对多糖连接的键起到破坏作用,使得多糖结构破碎,得率下降。
液料比对大果木姜子多糖得率的影响见图3。
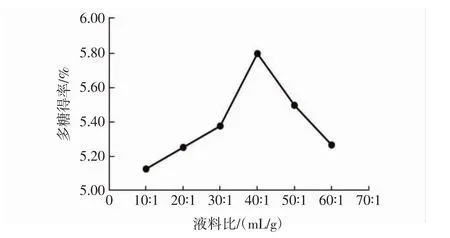
图3 液料比对大果木姜子多糖得率的影响Fig.3 The effect of material-liquid ratio on the yield of polysaccharides
由图3可知,固定超声时间和提取功率,改变液料比,大果木姜子多糖得率在40∶1(mL/g)时达到最高值5.79%,当液料比超过40∶1(mL/g)后多糖得率显著下降,可能原因是溶剂量过大,杂质分子被溶出,与多糖分子竞争溶出空间导致得率下降。
2.2 响应面方案与试验结果
利用响应面软件Design Expert 8.0.7设计三因素三水平的试验,设计方案及结果见表2,测定多糖得率,得到回归模型方差分析见表3。

表2 响应面设计及结果Table 2 Response surface design and results
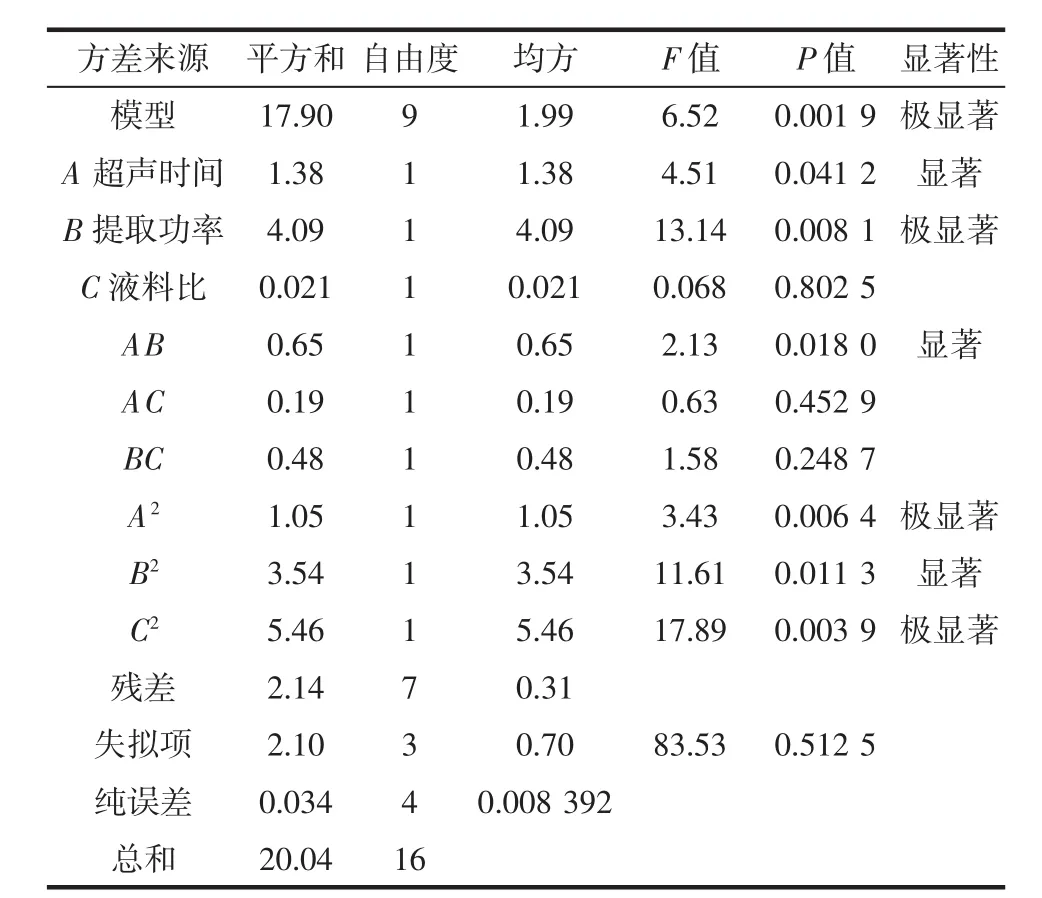
表3 响应面二次模型多糖得率的方差和回归系数分析Table 3 Analysis of variance and regression coefficient of polysaccharide yield in response surface quadratic model
将自变量超声时间(A)、提取功率(B)、液料比(C)与大果木姜子多糖得率(Y)的数据进行回归拟合,得到二次多元回归方程如下。
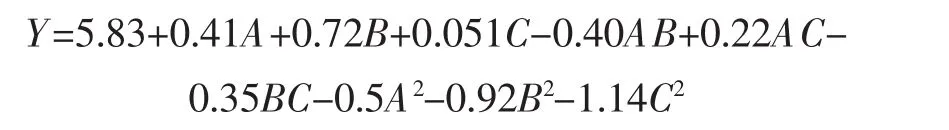
由表3可知,矫正系数R2Adj=0.956 3,预测复相关系数R2=0.963 7,预测相关系数R2(Pred)=0.956 3与预测复相关系数接近,说明拟合度比较好。失拟项P=0.5125>0.05,表明差异不显著,变异系数C.V.%为3.94%,说明选择的模型对该试验的拟合度较好。由表3可知,3个因素对大果木姜子多糖得率的影响程度的大小顺序为提取功率>超声时间>液料比。
2.3 响应面分析
当液料比固定时,提取功率与超声时间相互作用见图4。
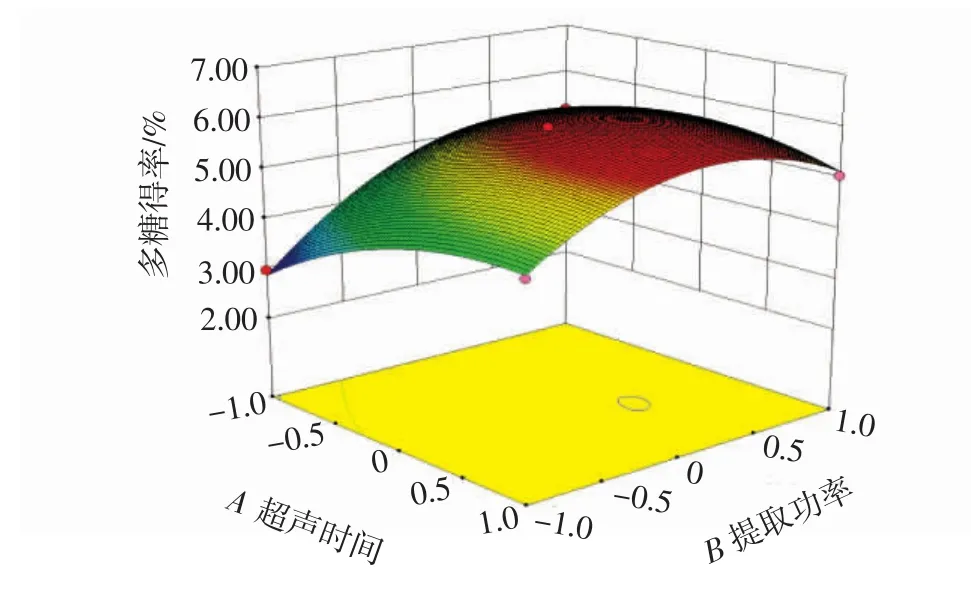
图4 超声时间和提取功率对多糖得率响应面图Fig.4 Response surface graph of ultrasonic time and extraction power versus polysaccharide yield
由图4可知,在提取功率一定时,随着超声时间的变化,多糖得率先增大后趋于平缓,但响应面坡度不明显;在超声时间一定时,随着提取功率的变化,多糖得率先增加再降低,响应面坡度较大。
当提取功率固定时,超声时间和液料比相互作用见图5。

图5 超声时间和液料比对多糖得率响应面图Fig.5 Response surface graph of ultrasonic time and materialliquid ratio versus polysaccharide yield
由图5可知,在液料比一定时,随着超声时间的变化,多糖得率变化不大,响应面坡度较平缓,先增加后趋于平缓;在超声时间一定时,随着液料比的变化,多糖得率先显著增加后显著降低,响应面坡度较陡峭。
当超声时间固定时,提取功率和液料比相互作用见图6。
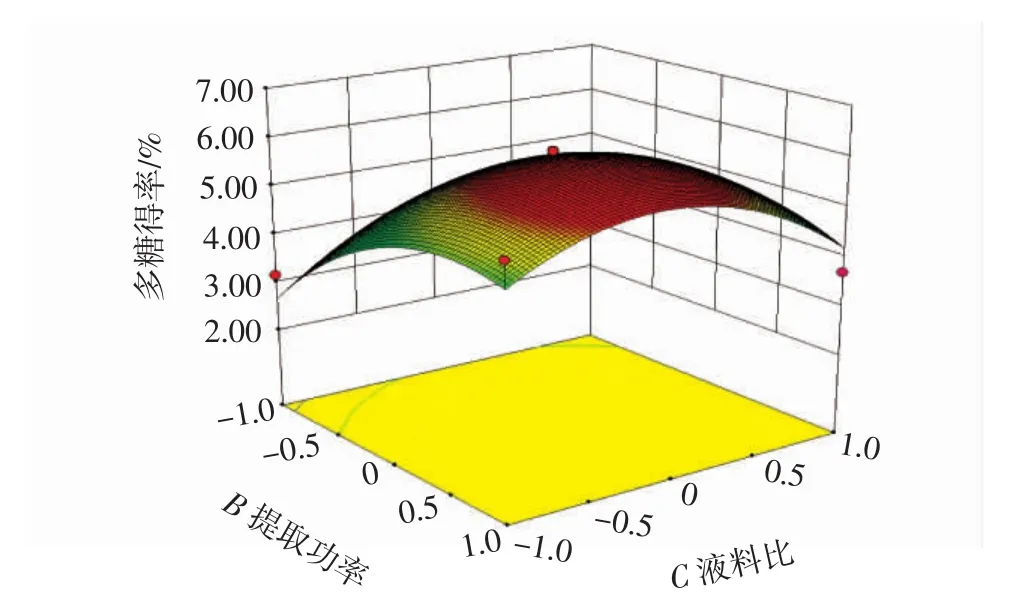
图6 液料比和提取功率对多糖得率的响应面图Fig.6 Response surface diagram of the ratio of material to liquid and extraction power to the yield of polysaccharide
由图6可知,在提取功率一定时,随着液料比的变化,多糖得率先增大后显著降低,响应面坡度较大;在液料比一定时,随着提取功率的改变,多糖得率先显著增加后降低,但降低的不明显,响应面坡度较大,液料比和提取功率的交互作用显著。
2.4 优化与验证试验
经响应面优化后最优条件为超声时间35.12min、提取功率 80.64 W、液料比 40.16∶1(mL/g),多糖得率为5.99%。依据实际操作条件,将工艺修正为超声时间35 min、提取功率80 W、液料比 40∶1(mL/g),得到实测多糖得率为5.92%。实际值与预测值之间相差较小,验证了该响应面模型的有效性。因此,响应面法对大果木姜子多糖最佳优化工艺为超声时间35 min、提取功率 80 W、液料比 40∶1(mL/g)。
2.5 大果木姜子多糖抗氧化活性结果
大果木姜子多糖抗氧化作用结果见表4。
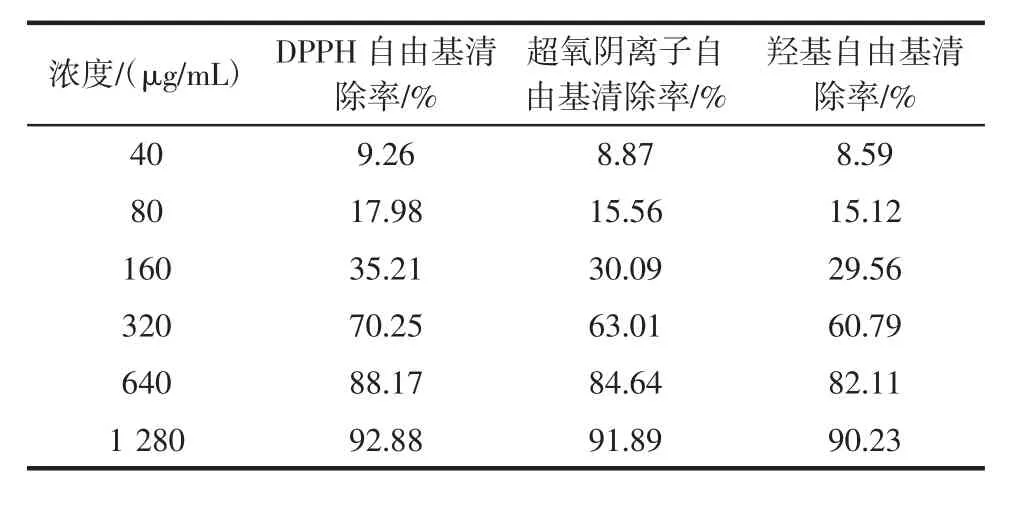
表4 大果木姜子多糖抗氧化作用Table 4 Antioxidant effect of Cinnamomum migao H.W.Li polysaccharide
由表4可知,大果木姜子多糖对DPPH自由基的最大清除率为92.88%,经计算IC50为219.60 μg/mL。对超氧阴离子自由基最大清除率为91.89%,IC50为244.37 μg/mL。对羟基自由基的最大清除率为90.23%,IC50为258.26 μg/mL。因此,大果木姜子多糖有一定的抗氧化活性。研究表明,抗氧化疗法可以在治疗疾病中发挥关键作用。在潜在的药物资源中,植物多糖是天然抗氧化成分,其应用历史悠久,广泛的可获得性以及食用的副作用小,被认为对人体健康至关重要[20]。在实验室研究和临床研究中,多种疾病模型均显示出植物多糖具有抗氧化性、抗炎症、促进细胞活力、免疫调节和抗肿瘤的功能[21-22]。
多糖发挥抗氧化作用机制之一是由于多糖中含有大量的氢离子,氢可以与自由基结合形成稳定的自由基以终止自由基链反应。多糖还可以通过降低脂质过氧化(lipid peroxidation,LPO)和丙二醛(malondialdehyde,MDA)的水平发挥抗氧化作用[23]。此外,多糖还可以在体外与自由基发生反应,从而终止自由基链反应。通过增强过氧化氢酶(catalase,CAT)活性来增强抗氧化活性,催化H2O2的分解[24]。多糖可以防止谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)消耗,并增加超氧化物歧化酶(superoxide dismutase,SOD)活性。最后,多糖还可以刺激产生自由基酶的合成,建立氧化还原循环来保护细胞免受氧化应激的影响[25]。
3 结论
本试验利用超声辅助提取法获得大果木姜子多糖,通过响应面法优化了多糖的提取工艺。研究表明最佳超声辅助提取工艺条件为超声时间35 min、提取功率 80 W、液料比 40∶1(mL/g),多糖得率为5.92%。此外,大果木姜子多糖还具有较强的抗氧化能力。
综上所述,大果木姜子多糖可通过超声方法优化提取,大果木姜子多糖还表现出较强的体外抗氧化能力,本研究为大果木姜子新产品的开发提供了理论依据。

