补体C3系膜区沉积强度与IgA肾病病理分型的相关性*
陈盼盼 周蓓 何娟 李嵘 马峰
(空军军医大学第一附属医院肾脏内科,陕西 西安 710032)
IgA肾病(IgA nephropathy, IgAN)是我国最常见的原发性肾小球疾病,IgAN患者平均寿命减少6~10岁[1-2],大约40%患者20年后进展至终末期肾病。IgAN是由于IgA1分子糖基化异常,与抗聚糖抗体结合形成免疫复合物,免疫复合物沉积于肾小球系膜区,引起补体系统活化、细胞因子释放和系膜基质增多。IgAN补体活化以替代途径和凝集素途径为主[3-7]。补体C3系膜区沉积强度是影响IgAN患者预后的危险因素[8-11],与肾脏系膜细胞增生、毛细血管内增生、肾间质纤维化正相关[12-13],提示补体C3系膜区强度与IgAN病理分级不相关。本文回顾性分析肾活检诊断为IgAN患者补体C3系膜区沉积强度与IgA肾病Lee氏分级和牛津分型的相关性,并评估补体C3系膜区沉积强度与临床病理的相关性。
1 资料与方法
1.1 一般资料 回顾性收集空军军医大学西京医院2016年1月1日~2019年12月31日行肾活检穿刺诊断为IgAN患者1094例。排除标准:肾小球数目小于10个;近6个月使用激素或免疫抑制剂;继发性IgAN(紫癜性肾炎、狼疮性肾炎、肝硬化等)。排除119例患者,其中32例肾小球数目小于10个,62例近6个月使用激素或免疫抑制剂,25例继发性IgAN,最终纳入975例IgAN患者。免疫荧光下补体C3在系膜区沉积强度评判标准。-:各种倍数的荧光显微镜均不能显现;±:低倍镜下不能显示,高倍镜下似乎可见;≥1+:低倍镜下可见。依据补体C3在系膜区沉积强度将患者分为阴性组(-或±,n=213)和阳性组(≥1+,n=762)。本研究获医院伦理委员会审核批准。
1.2 资料收集 收集患者的基线人口学指标,包括年龄、性别、住院年份和血压;实验室指标:尿蛋白定量、血肌酐、血尿酸、血清IgA和血补体C3。肾组织标本常规行光镜(HE、PAS、Masson和银染色)、免疫荧光(IgA、IgG、IgM、C3、C4和C1q)和电镜检测。eGFR采用改良MDRD公式评估,eGFR (mL/min/1.73m2) = 186×(血肌酐, mg/dL)-1.154×(年龄)-0.203×0.724(女性)×1.233(中国人)。
1.3 IgA肾病Lee氏分级及IgAN牛津分型病理指标评价病理改变程度 Ⅰ级是绝大多数肾小球正常,偶尔轻度系膜区增宽,伴或不伴细胞增生,无小管和间质改变;Ⅱ级是肾小球局灶系膜增生和硬化(<50%),罕见小新月体,无小管和间质改变;Ⅲ级是弥漫系膜增生和增宽(偶尔局灶节段),偶见小新月体和黏连,肾小管和间质局灶水肿,偶见细胞浸润,罕见肾小管萎缩;Ⅳ级重度弥漫系膜增生和硬化,部分或全部肾小球硬化,可见新月体(≤45%),肾小管萎缩,间质细胞浸润,偶见间质泡沫细胞;Ⅴ级是病变性质类似Ⅳ级,但更严重,肾小球新月体形成>45%,肾小管和间质类似Ⅳ级病变,但更严重。依据IgAN牛津分型病理指标评价病理改变程度,即系膜细胞增生(M1),内皮细胞增生(E1),节段性硬化和黏连(S1),肾小管萎缩或肾间质纤维化(T0:0%~25%;T1-2:>25%)和新月体(C0:无;C1-2:有)。肾小球硬化百分比是硬化肾小球数目与总肾小球数目比值。球囊黏连百分比是球囊黏连肾小球数目与总肾小球数目比值。
2 结果
2.1 两组一般资料比较 两组年龄、性别、收缩压、舒张压、尿蛋白定量、血尿酸和血清IgA比较差异无统计学意义(P>0.05);C3阴性组较C3阳性组血肌酐水平低,eGFR高和血补体水平高(P<0.05),见1。

表1 两组患者基线临床资料比较
2.2 补体C3与IgA肾病Lee氏分级的关系 C3阴性组和C3阳性组中Lee氏Ⅱ级以下患者分别占44.3%和25.0%(表2)。C3阴性患者在Lee氏Ⅰ级的比例最高(50.5%),之后逐渐递减,Lee氏Ⅳ-Ⅴ级的比例最低(9.8%),而在Lee氏Ⅴ级的比例升高(20.5%),呈现为“杓型”曲线,见图1。
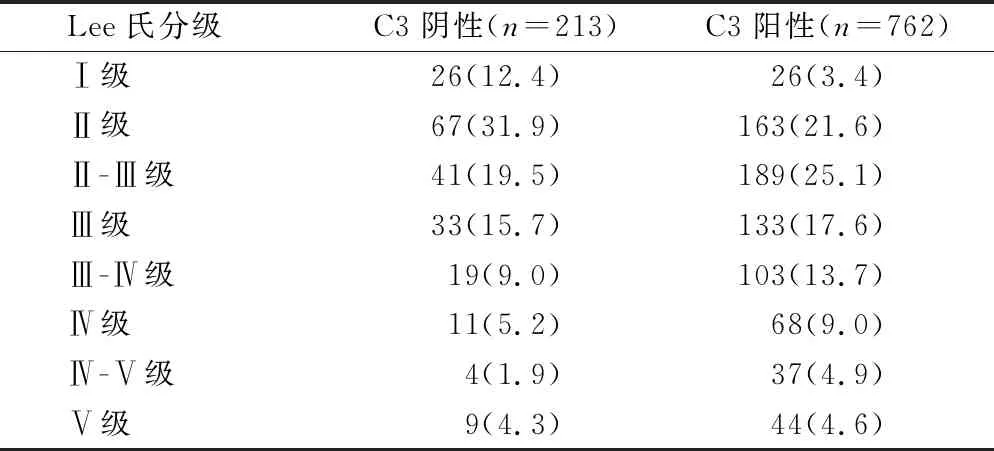
表2 补体C3阴性组和阳性组与IgA肾病Lee氏分级的关系[n(×10-2)]
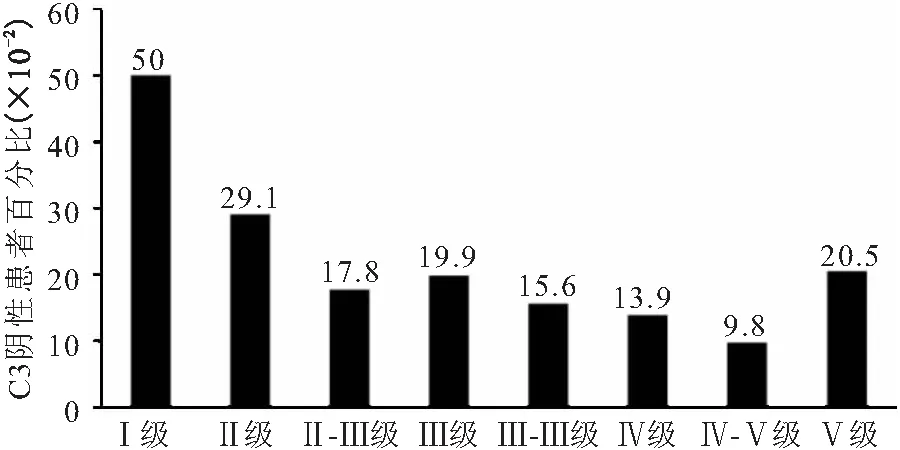
图1 补体C3阴性患者在IgA肾病Lee氏不同分级的比例
2.3 补体C3与IgA肾病牛津分型病理指标的关系 C3阴性组患者病理组织改变M1、E1、S1、T1-2和C1-2的比例显著少于C3阳性组,差异有统计学意义(P<0.05);C3阴性组球囊黏连百分比显著低于C3阳性组,差异有统计学意义(P=0.001);两组肾小球硬化百分比相比较差异无统计学意义(P>0.05),见表3。

表3 两组Oxford分型的关系[n(×10-2)]
2.4 两组IgAN Lee氏分级与IgA肾病牛津分型病理改变分析 IgAN Lee氏Ⅰ-Ⅱ级患者C3阴性组较C3阳性组活动性病变显著降低(M1, S1和球囊黏连),差异有统计学意义(P<0.05);IgAN Lee氏Ⅴ级患者C3阴性组较C3阳性组M1病变显著降低,差异有统计学意义(P<0.05),而肾小球硬化百分比升高,但差异无统计学意义(P>0.05);C3阴性组较C3阳性组C1-2病变低,差异无统计学意义(P=0.780),但C3阴性组纤维性新月体百分比显著高于C3阳性组(88.2%vs52.3%,P=0.002),见表4。
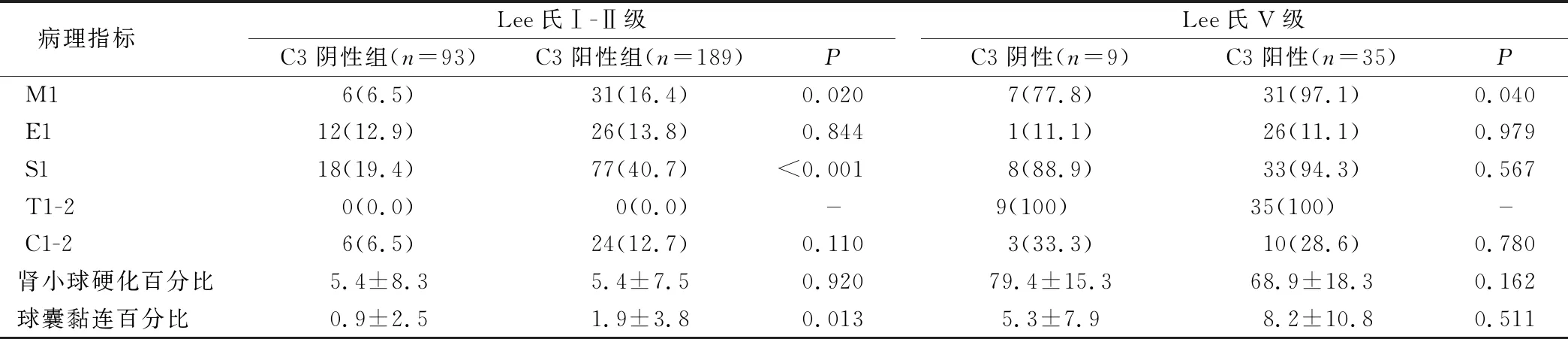
表4 两组IgAN Lee氏分级与IgA肾病牛津分型病理改变的关系[n(×10-2)]
3 讨论
IgAN是以肾小球系膜区以IgA沉积为主的肾小球疾病,其发病机制尚未完全阐明,缺乏针对病因性治疗手段。目前公认的发病机制是IgAN的四重打击学说:首先IgA1分子糖基化异常,其次与抗聚糖抗体结合形成免疫复合物,之后免疫复合物沉积于肾小球系膜区,最后引起补体系统活化、细胞因子释放和系膜基质增多。而补体活化参与了IgAN的各个过程,比如,体外实验证实多聚gd-IgA1能够激活补体替代途径和凝集素途径,循环糖基化异常IgA1免疫复合物能够激活补体替代途径[14],通过活化补体诱导系膜细胞增生和分泌系膜基质[15]。因此补体参与了IgAN发病机制中的大多环节,引起炎症级联反应和肾脏损伤。
1969年Jean Berger首次报道IgAN患者补体C3伴随着IgA沉积于系膜区,补体C3阳性患者达到90%[16]。本研究补体C3阴性发生率是21.8%。近期一些国外研究报道补体C3阴性发生率是4%~16%[17-18]。而我国研究报道其发生率较高(15.1%~22.5%)[12,19],与本研究一致。本研究发现补体C3阴性患者Lee氏I-II级约占50%,随着Lee氏分级增加补体C3阴性发生率逐渐降低,而Lee氏V级又升高,呈现为“杓型”曲线。原因可能是:①补体阴性患者与IgAN合并微小病变肾病密切相关,有学者提出对于IgAN伴肾病综合征患者,同时存在M0E0S0T0,补体C3沉积阴性和尿红细胞<10/HPF支持IgAN合并微小病变肾病,这部分患者对激素治疗敏感,预后良好[20]。②Lee氏V型患者肾脏病变多表现慢性化,补体C3沉积与疾病活动明显相关,因而V型患者中补体C3阴性的发生率升高。③肾活检指征较早有关,本研究补体阴性患者中尿蛋白定量< 1.0 g/d占50%以上,而欧美国家肾活检指征较晚。④我国IgAN肾病发病率较欧美国家高,可能与种族和易感基因有关。
补体系统参与炎症级联反应和肾脏组织损伤,但补体激活的具体途径仍不清楚。补体C3系膜区沉积是IgAN进展的危险因素之一。系膜区IgA1沉积常伴有补体的沉积,比如C3、C4、C4结合蛋白,甘露糖结合凝集素,C5b-9等。目前认为IgA肾病补体活化以替代途径和凝集素途径为主。通过单纯C3沉积考虑替代途径,C3和C4或C4d沉积考虑凝集素途径[21]。研究表明补体C3系膜区沉积是IgAN进展的危险因素之一[10]。血清中C3水平降低和系膜区C3沉积与IgAN的肾脏预后相关。Roos等[22]研究表明肾小球沉积和尿中甘露糖结合凝集素水平是预测IgAN预后的生物标记物。这些研究支持补体在IgAN发病过程的关键作用。血清、尿液和肾脏组织中补体因子可以作为疾病活动、预后的良好标志物,甚至为免疫抑制剂治疗提供参考依据。IgA肾病的Lee氏分级和牛津分型与IgAN具有良好重复性和判断肾脏预后的作用。我们研究证实了肾组织补体C3沉积与Lee氏分级密切相关。肾组织C3沉积阳性与牛津分型的M、E、S、T和C密切相关,这与其他研究结果一致[23-25]。研究表明C3a使系膜细胞收缩和增生,C5b-9使系膜细胞分泌纤维蛋白、TGF-β和IL-6,在这些炎症因子的环境下上调系膜细胞结合半乳糖缺陷的IgA1[26-27]。E和补体关系存在争议,一些研究表明C3沉积和E显著相关[25],C3引起内皮细胞增生的机制不清楚;而另外一些研究显示C3沉积和E无显著相关[23]。S1病变与足细胞损伤关系密切,C5b-9使足细胞分泌各种蛋白酶、氧化剂、细胞因子和细胞外基质,最终损伤肾小球基底膜引起细胞凋亡和肾小球疤痕形成[28]。在IgAN中,C和补体的相互作用仍不清楚,但在寡免疫复合物的新月体肾小球肾炎中补体活化中扮演了重要角色[29]。肾组织荧光染色常规行补体C3染色,特异性较强,因此补体C3沉积有无是预测IgAN预后的良好指标。
4 结论
补体C3沉积强度与IgAN的病理分型密切相关,补体C3阴性的发生率与IgA肾病Lee氏分级呈现为“杓型”曲线,补体C3阴性患者病理改变较轻或病变慢性化,活动性病变少见。因此,临床上应重视肾组织免疫荧光补体C3的沉积强度。

