基于真实情境促进核心素养发展的项目式实验教学
——以“草酸亚铁的制备及检测”为例
窦 卓 刘炯明 江合佩
(1、2.厦门双十中学,福建 厦门 361009;3.厦门市教育科学研究院,福建 厦门 361001)
一、项目内容的提出
实验是高中化学课程的重要内容,实验内容建构及实验探究教学的实施,是化学课程与教学改革的重要组成部分[1]。高中化学实验教学一般安排在高二下学期。此时,学生已掌握高中化学的大部分学科知识,亟待提升化学的实验综合能力。而传统的实验教学内容多是碎片式、无关联的,导致学生面临实验问题时,无法形成很好的综合探究能力。《普通高中化学课程标准(2017 年版)》指出,“真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台”[2]。项目式学习是一种以学生为主体,链接真实情景的学习方式。[3-4]通过共同解决真实复杂的问题和完成综合性任务进行深度学习,进而形成很强的实验探究能力,获得学科核心素养的发展。文章以水合草酸亚铁为载体,探讨项目式实验教学的设计和组织。
二、项目教学目标和项目流程
本项目的教学目标为:通过对水合草酸亚铁的制备、组成测定的研究,体会化学在探索人类未来方面的重要价值,培养科学态度与社会责任;学会从原理的角度判断化学反应的可行性,培养变化观念与平衡思想;建构物质制备、检验的一般思维模型,培养证据推理与模型认知的核心素养;强化定量研究的观念,培养宏微结合的能力;根据任务要求设计实验方案进行实验探究,提高实验能力,培养学生的创新意识。
形成解决实际问题的科学思维,进一步发展和落实学科核心素养。具体教学流程如图1 所示,围绕两个任务,三个问题展开。

图1 教学流程
三、教学过程
(一)任务1 水合草酸亚铁制备
【问题引入】近年来,4G 手机、电动汽车等便携储能设备的发展促使锂电行业的飞速发展。而草酸亚铁是磷酸铁锂动力电池的原材料,市场前景十分广阔。因此,草酸亚铁近几年成为研究热点之一。
探究问题1:如何制备水合草酸亚铁?
【学生活动1】见表1 信息,小组讨论交流,汇总如下两个方案:

表1 探究问题需要的试剂和信息
方案1:Na2C2O4溶液与硫酸亚铁溶液反应;
方案2:H2C2O4溶液与硫酸亚铁溶液反应。
1.探究实验方案的可行性
(1)探究方案1 的可行性
见表2,引导学生思考在Na2C2O4溶液中Fe2+是否容易氧化、水解。通过学生共同定量计算(所需数据见表1)发现,在一定浓度的碱性Na2C2O4溶液中,Fe2+容易被氧化,在生成草酸亚铁沉淀的同时可能生成Fe(OH)2沉淀,会导致产品不纯,因此该方案不合理。

表2 探究方案的可行性
(2)探究方案2 的可行性
见表2,引导学生思考Fe2+是否容易氧化、草酸亚铁是否容易生成。在Fe2++H2C2O4+nH2O ⇋FeC2O4·nH2O↓+2H+这个反应中,学生经计算分析,K=(Ka1·Ka2)/Ksp=12。综合分析来看,Fe2+不易被氧化,且正向反应程度较大,该方案更合理。
为尽量降低溶液的pH,可将硫酸亚铁改成更稳定的硫酸亚铁铵。学生得出制备流程,见图2。

图2 FeC2O4·xH2O 制备流程设计
2.实验方案的优化
[教师]如何分离提纯FeC2O4·xH2O?
[学生]根据表1 信息,FeC2O4·xH2O 难溶于水,用过滤的方法分离,用蒸馏水洗去表面可溶性杂质,晾干得到产品。
[教师]水洗后,为了加快产物表面水分蒸干,可采取什么操作?
[学生]水洗后,可再用乙醇洗涤产品。不仅可除去产品表面水分,同时乙醇易挥发,利于晶体快速干燥。得到再优化的制备流程,见图3。
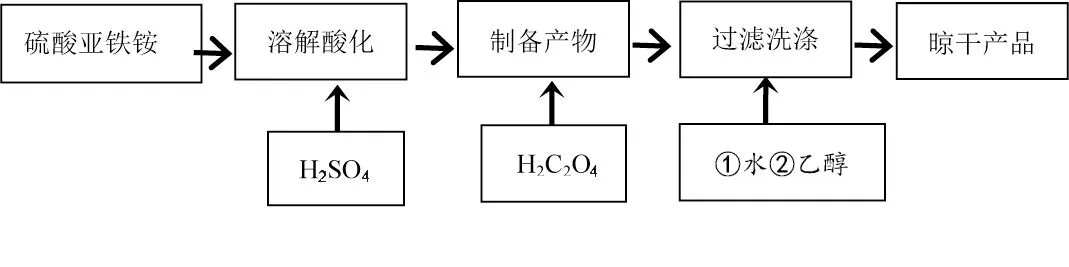
图3 FeC2O4·xH2O 制备流程设计优化
3.实验的实施
【学生活动2】分成若干小组,进行分组实验[5],见图4。练习实验操作,获得产品,计算产率。
图4 学生制备草酸亚铁晶体过程
[教师]为什么反应过程中要不断地加热搅拌?
[学生]讨论,交流,得出结论:①搅拌可增大反应物的接触面积,加热加快反应速率;②使沉淀由小颗粒变成大颗粒,加快聚沉,利于形成沉淀。
学生在真实的实验情境中,在一个个任务问题的驱动下,团结协作,自主参与实验方案设计、实验操作等过程,尝试像科研工作者一样思考、解决问题。以往物质制备的实验更多关注的只有仪器、原料的选择和实验的操作等浅层问题,对原理考虑不足。而在项目式实验教学中,无论是实验药品的选择、还是反应可行性的判断,以及实验过程中的条件控制等,都渗透了变化观念与平衡思想。学生开始从更高的理论高度认识物质的制备原理,体会理论计算和实验相结合的价值,从关注实验操作进阶到原理统率。形成制备物质的一般思路:原料选择(从原理角度)→实验操作→分离提纯→产率计算。实验能力、思维能力都得到一定程度的提升。
(二)任务二水合草酸亚铁的组成测定
1.探究问题2:如何定性检测水合草酸亚铁中的Fe2+与C2O42-?
【学生活动1】分析表1 提供试剂和信息,结合所学知识,交流研讨,得出不同的方案设计,并不断地改进优化,见表3。
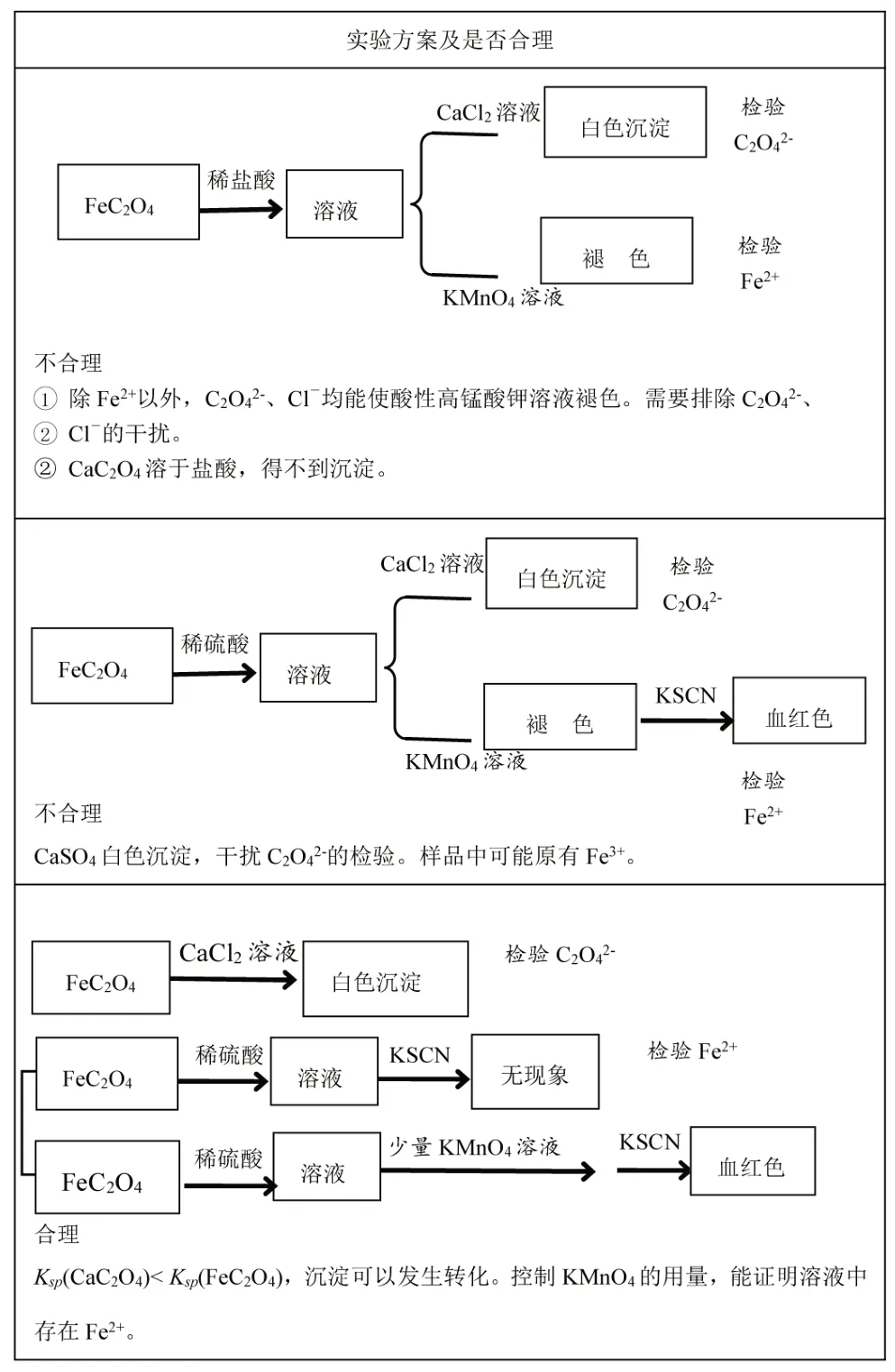
表3 检验Fe2+与C2O42-的实验方案
【学生活动2】根据合理的实验方案,进行分组实验,检验两种离子,如图5。
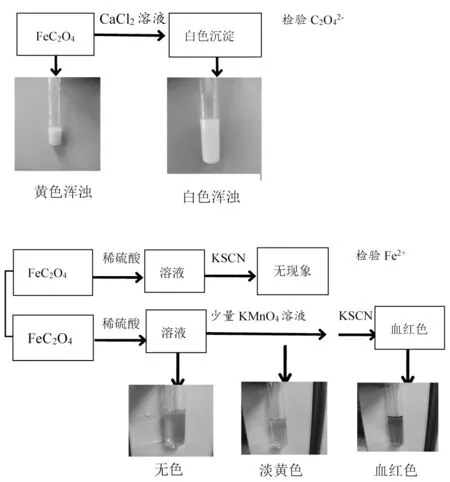
图5 学生检验Fe2+与C2O42-的实验
与FeSO4、Fe2(SO4)3等简单体系相比,草酸亚铁中的C2O42-也有还原性。而由于C2O42-的干扰,使Fe2+的检验变得复杂,从简单的理想体系进阶到真实复杂体系。学生充分发挥集体智慧,通过对提出的实验方案进行分析,不断发现问题和不足,不断控制单一变量,考虑问题越来越全面。通过检验过程建构物质检验的思想方法模型,即选择药品→排除干扰因素→确定检验顺序→注意用量问题,进而培养证据推理和模型认知的核心素养。
2.探究问题3:如何确定草酸亚铁中(nFe2+):(nC2O42-)?
【学生活动1】分析表1 信息,小组交流讨论,用滴定法操作简便,实验更准确。用高锰酸钾滴定,可先测定C2O42-和Fe2+总量;再选择适量试剂Zn[6],将Fe3+还原为Fe2+;最后进行二次滴定,测定Fe2+含量。可以得出设计流程,如图6。

图6 测定草酸亚铁组成的流程设计
【学生活动2】进行分组实验。[7]注意实验操作规范,记录V1和V2。根据氧化还原配平,可知5Fe2+~MnO4-、5C2O42-~2MnO4-,推出n(Fe2+):n(C2O42-)=,见表4。
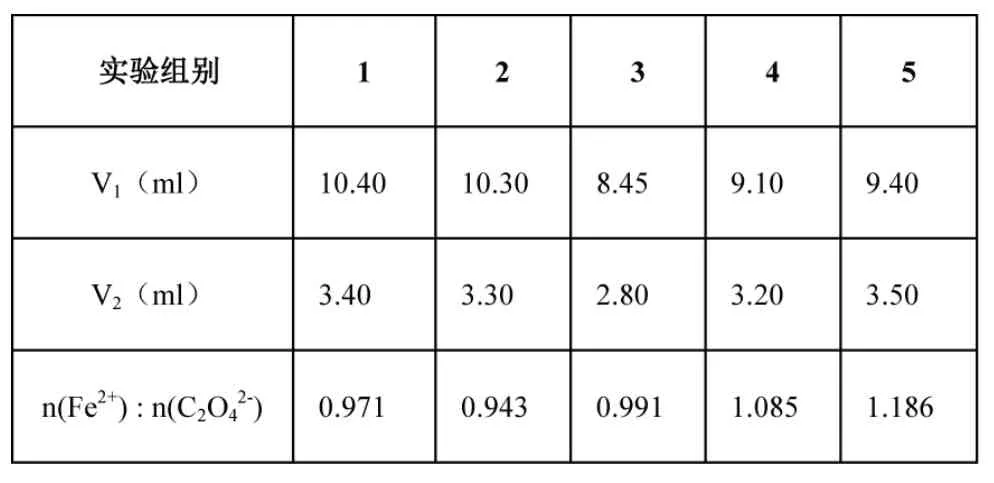
表4 实验测定草酸亚铁中n(Fe2+):n(C2O42-)部分数据汇总
[教师]①滴定过程中有什么实验现象?说明了什么题?②为什么滴定时要加热至60-80℃?
[学生]根据表1 中的信息,交流,讨论:①滴定时,溶液先变成黄绿色,说明生成了草酸铁,即Fe2+先被氧化。颜色又变浅说明C2O42-后面逐渐被氧化。②草酸根氧化比较慢,需要加热,加快反应速率,但是草酸在85℃易分解,因此加热温度不易太高。
[教师]分析表4 误差比较大的原因是什么呢?
【学生活动3】小组讨论分析,汇总结论见表5。

表5 造成实验误差的原因分析
该任务环节使研究从定性提升到定量,通过观察滴定实验中的颜色变化,准确判断出氧化顺序和氧化终点,使测量草酸亚铁中的阴阳离子的组成得以实现。体会到定量实验的重要价值。通过误差分析,学会了如何合成产率高、纯度高的草酸亚铁产品,培养了宏微结合的核心素养。
四、项目式实验教学反思
项目式实验教学将物质的制备合成、分离提纯、定性检验和定量分析,性质探究、反应条件的控制等若干实验整合成一个有机的整体。从碎片化课时任务进阶到单元整体教学,具有较强的迁移性和推广性。在一个个项目任务的驱动下,学生学习的主动性被激发。在不断的探索中,学生经历复杂推理、思辨决策等综合性、复杂性的问题解决过程,获得实验探究能力、迁移创新能力、合作沟通能力等,学科观念、思维方法逐渐形成。学生深刻体会化学实验的重要价值,化学综合实验能力得到了提升,形成了分析信息、设计方案、评价改进、动手实验、分析现象、处理数据、得出结论等解决实验问题模型。
作者经过一年多的教学实践,发现每个探究问题需要一个课时完成,也可以适当延长课时。总之,项目式实验教学对提高学生的实验能力及核心素养起到一定的促进作用。

