半夏游离块茎诱导及其遗传稳定性SSR鉴定
刘 智,王晓红,于晓松,贾 娜,李 林,田宇航,张明生
(贵州大学生命科学学院,山地植物资源保护与种质创新教育部重点实验室,贵阳 550025)
半夏[Pinelliaternata(Thunb.) Breit.]为天南星科(Araceae)半夏属(PinelliaTen.)多年生宿根草本植物,以干燥块茎入药,味辛、性温、有毒,归脾、胃、肺经,具有燥湿化痰,降逆止呕,消痞散结等功效[1]。用于湿痰寒痰,咳喘痰多,痰饮眩悸,风痰眩晕,痰厥头痛,呕吐反胃,胸脘痞闷,梅核气,外治痈肿痰核[2]。药理学研究表明,半夏具有止咳平喘、抗炎、抗衰老、抗肿瘤、镇静止呕等作用[3-5]。半夏主要生长于溪边、田野、林下和阴湿山坡,在我国海拔2 500 m以下的大部分地区均能生长[6]。
半夏为我国常用大宗中药材,已有2 000多年的药用历史,在200多种中成药中都是不可或缺的成分,市场需求量极大[7]。近年来,半夏产业面临种质资源保护力度不够、种质资源流失、栽培用种成本高、人工投入大等问题[8-9]。尤其是突破半夏人工种子技术将是解决半夏种子产业化的一个新的有效途径[10-11],而人工种子生产至关重要的一步就是利用组织与细胞培养获得可供包埋的悬浮培养物[12]。关于半夏悬浮培养物的研究中,吴爱民等[13]最早以掌叶半夏为材料,经过诱导振荡培养产生大量的体细胞胚;罗成科等[14]研究了悬浮培养过程中体细胞胚的发生及植株的再生,观察到球形胚、心形胚、鱼雷形胚和子叶形胚等不同的胚状体发育形态;毛春娜等[15]以三叶半夏疏松愈伤组织为材料,研究低温处理对半夏悬浮培养细胞同步化的影响,表明低温处理可以明显影响半夏悬浮培养细胞的同步化,初步探明了半夏组织与细胞培养所需条件。大量研究发现,在植物组织与细胞培养过程中体细胞无性系变异是普遍存在的现象[16],目前仅胡鹏[17]使用RAPD标记技术验证了在珍珠半夏试管苗15代以内DNA分子上没有发生变异,而关于半夏体细胞无性系变异的其他相关研究未见报道。
本研究通过探索不同因素对半夏组织培养各阶段的影响,以优化建立其疏松愈伤组织诱导条件及游离块茎悬浮培养体系,并采用SSR标记技术鉴定组培游离块茎体细胞无性系的遗传稳定性,进而为半夏人工种子技术、良种选育与保存提供依据。
1 材料与方法
1.1 实验材料
实验所用半夏由贵州省赫章县半夏种植基地提供。
1.2 实验方法
1.2.1愈伤组织诱导
将半夏植株置于流水冲洗3 h后转移至超净工作台,依次经过以下消毒程序:无菌水冲洗4~5次,75%酒精浸泡35 s,无菌水冲洗4~5次,0.1%升汞浸泡10 min,无菌水冲洗4~5次。将半夏叶柄剪切成0.5~1.0 cm小段,接种于MS+2,4-D 1.0 mg·L-1+6-BA 1.0 mg·L-1+蔗糖30 g·L-1+0.6%琼脂的愈伤组织诱导培养基上,30 d左右形成大量愈伤组织。
1.2.2愈伤组织继代获得疏松愈伤组织
以半夏愈伤组织为材料,以MS为基本培养基添加不同浓度的蔗糖(20、30、40 g·L-1)、2,4-D (1.0、2.0、4.0 mg·L-1)和6-BA (0.5、1.0、2.0 mg·L-1)进行L9(33)正交试验,筛选愈伤组织增殖的适宜培养基,以此培养基继代愈伤组织3~4次,每次继代间隔15~20 d,获得疏松愈伤组织。
1.2.3半夏游离块茎分化
将疏松愈伤组织接种到MS液体培养基中,在悬浮培养体系中分别设置不同激素,包括细胞分裂素类(6-BA、KT、ZT、TDZ)和生长素类(2,4-D、NAA、IAA、IBA),每个激素均设4个浓度梯度(0.5、1.0、2.0、4.0 mg·L-1)共32个处理,每个处理重复4次,统计分化率,得到适宜半夏块茎分化的细胞分裂素和生长素。在单因素试验的基础上,添加不同浓度的蔗糖(10、20、30 g·L-1)、6-BA (0.5、1.0、2.0 mg·L-1)和IBA(0.5、1.0、2.0 mg·L-1)进行三因素三水平的正交试验,优化半夏块茎分化的悬浮培养条件。将疏松愈伤组织用优化后的分化培养基继代4~5次,每次继代间隔15~20 d,最终得到半夏游离块茎。悬浮培养在恒温旋转式摇床上进行,光照强度2 000 lx,光照时间12 h·d-1,温度25 ℃,摇床转速90 r·min-1。
1.2.4DNA提取和质量检测
以诱导获得的半夏游离块茎为材料,用北京天根公司植物基因组DNA提取试剂盒(目录号:DP 350)提取半夏基因组DNA,具体操作步骤参照说明书,提取好的基因组DNA用超微量分光光度计检测其纯度。
1.2.5SSR-PCR扩增
PCR扩增反应在A 300基因扩增仪中进行,用于检测的随机引物16对,扩增反应体系为:Taq Master Mix 12.5 μL、SSR引物2.0 μL、DNA模板1.0 μL、ddH2O 9.5 μL,总体积25 μL。将反应溶液充分混匀,进行PCR扩增,SSR-PCR扩增反应程序为:95 ℃预变性3 min,95 ℃变性15 s,Tm±5 ℃(Tm据引物而定)退火30 s,72 ℃延伸60 s,共30个循环,72 ℃彻底延伸5 min,4 ℃保存。扩增完成后,取4.0 μL扩增产物进行1.0%琼脂糖凝胶电泳,放置在紫外凝胶成像分析仪观察并拍照。SSR引物均由上海生工公司合成(表1)。

注:A为以叶柄诱导的愈伤组织;B为愈伤组织第1次继代;C为继代3次后得到的疏松愈伤组织。图1 半夏疏松愈伤组织诱导过程Fig.1 Induction process of loose P. ternata callus
1.2.6数据处理
应用Microsoft Excel 2019、Minitab 16、SPSS 21.0、Origin 2018等软件进行数据处理。
2 结果与分析
2.1 半夏疏松愈伤组织诱导的影响因素
以半夏叶柄为外植体诱导愈伤组织接种20 d后,渐渐出现淡黄或透明的愈伤组织并缓慢增殖(图1 A),将愈伤组织切下接种于愈伤组织继代培养基中进行第1次继代培养,得到的愈伤组织较为紧密且呈淡黄色(图1 B);继代培养2~3次后,产生大量淡黄、易碎的疏松愈伤组织(图1 C)。在半夏疏松愈伤组织诱导的正交试验中,当蔗糖浓度一定时,随着2,4-D浓度升高,愈伤增殖倍数呈现先升高后降低的趋势,并且在全部的处理中,愈伤增殖倍数也是随着2,4-D浓度的升高呈先升高后降低的趋势,其中在2,4-D浓度为2.0 mg·L-1时达到最高(表2);8号处理的愈伤组织增殖倍数最高,但从极差分析的结果来看,半夏愈伤组织增殖培养基的适宜组合应是A2B2C1:MS+2,4-D 2.0 mg·L-1+6-BA 0.5 mg·L-1+蔗糖30 g·L-1+0.6%琼脂,经过后续验证试验,结果显示愈伤增殖倍数达286.7%,显著高于正交表中的9种培养基,为半夏愈伤继代培养的最适培养基(表3)。方差分析结果表明,2,4-D对半夏愈伤组织增殖倍数的影响达到显著水平,而蔗糖浓度与6-BA对愈伤组织增殖倍数的影响不显著(表4)。

表2 半夏疏松愈伤组织继代正交设计统计Table 2 Orthogonal design and statistics of subculture of loose P. ternata callus

表3 验证试验统计结果Table 3 Verification of test statistical results

表4 半夏愈伤组织增殖倍数方差分析Table 4 Variance analysis of callus multiplication of P. ternata
2.2 半夏悬浮培养块茎分化的影响因素
以半夏疏松愈伤组织为材料进行悬浮培养,可见6-BA对半夏块茎的分化率明显高于其他激素细胞分裂素,分化率呈先升高后降低的趋势,并在浓度为2.0 mg·L-1时达到最高(图2 A)。在生长素中,IBA对半夏块茎的分化率明显高于其他激素,分化率也呈先升高后降低的趋势,并在浓度为2.0 mg·L-1时达到最高(图2 B)。在半夏块茎分化的正交试验中,极差分析显示,3种影响因素对半夏块茎分化率的主次顺序为:6-BA>蔗糖>IBA(表5);4号处理的块茎分化率最高,但从极差分析的结果来看,半夏块茎分化的适宜组合应是A2B1C1:MS+6-BA 0.5 mg·L-1+IBA 0.5 mg·L-1+蔗糖20 g·L-1,经过后续验证试验,结果显示,块茎分化率达78.4%,显著高于正交表中的9种培养基,为半夏游离块茎分化的最适培养基(表6)。方差分析表明,6-BA对半夏块茎分化率的影响达到显著水平,而蔗糖浓度与IBA对块茎分化率的影响不显著(表7)。在对半夏块茎的诱导中,疏松愈伤组织经液体培养基初代培养后,其细胞团可形成分散性良好的悬浮细胞系,呈乳白色(图3 A)。第一次继代,细胞团明显变大,颜色呈淡黄色(图3 B);第二次继代,部分细胞团开始分化,形状近似圆球形,颜色偏嫩绿色(图3 C);第三次继代,越来越多细胞团分化,部分细胞呈绿色,大部分细胞团近似圆球状(图3 D);第四次继代,细胞团有大有小,部分细胞团形状变得不规则,颜色加深,整体呈绿色(图3 E);第五次继代,形成大小不一的绿色游离块茎(图3 F)。

图2 不同外源激素浓度对半夏块茎分化率的影响Fig.2 Effects of exogenous hormones with concentration on tuber differentiation rate of P. ternata

表5 半夏游离块茎分化正交设计统计Table 5 Orthogonal design and statistics of free tuber differentiation of P. ternata

注:A为疏松愈伤组织初代培养;B~F为第1~5次继代培养。图3 半夏疏松愈伤组织悬浮培养诱导游离块茎过程Fig. 3 Induction process of free tuber from loose P. ternata callus by suspension culture

表6 验证试验统计结果Table 6 Verification of test statistical results

表7 半夏游离块茎分化率方差分析Table 7 Variance analysis of free tuber differentiation rate of P. ternata
2.3 半夏亲本和游离块茎的SSR分析
将提取的半夏基因组DNA用1.0%琼脂糖凝胶电泳检测DNA质量和纯度,DNA完整度较好且纯度高,质量稳定,降解少,一致性高,可作为SSR-PCR扩增反应的DNA模板。
16对SSR引物共扩增出9条稳定性好、DNA长度在100~2 000 bp之间的清晰谱带,因此筛选到9对引物可作为后续实验PCR扩增引物(图4)。用该9对引物对种植基地采集的半夏植株和组织培养获得的半夏游离块茎DNA进行SSR鉴定。结果表明,供试引物共扩增出18条清晰谱带,亲本与游离块茎的18条带全部为单态带,没有条带显示多态性,变异率为0(图5),表明半夏组培游离块茎未发生体细胞无性系变异,可作为规模化种植的繁殖材料。
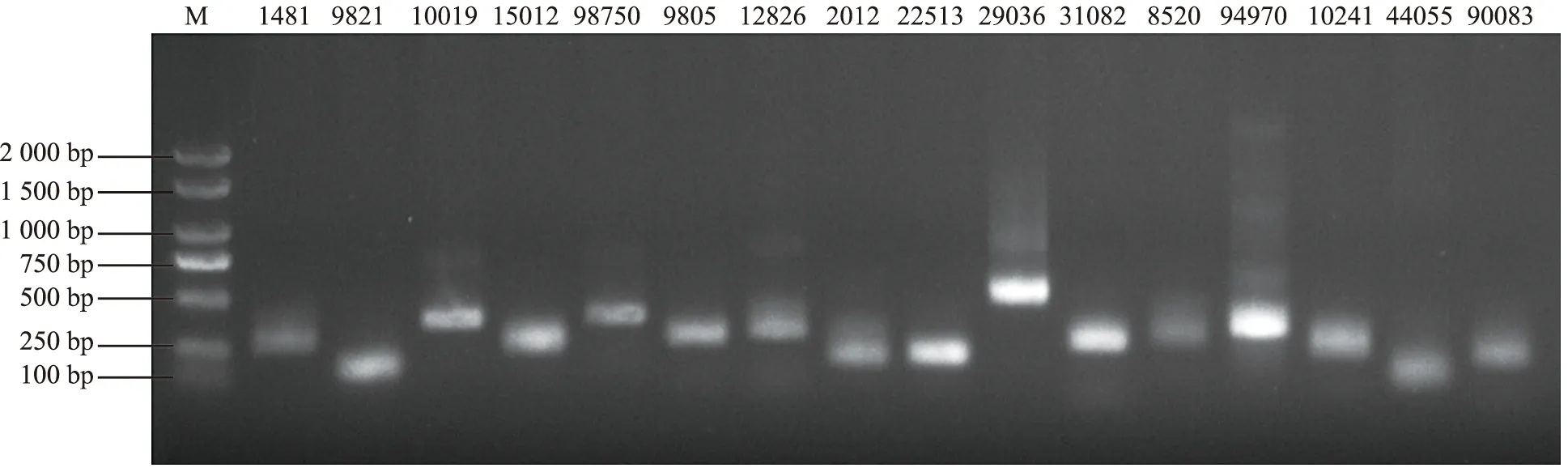
注:M为分子量标记;1481~90083为SSR引物编号。图4 半夏游离块茎SSR引物琼脂糖凝胶电泳检测结果Fig.4 Detection of free P. ternata tubers based on agarose gel electrophoresis by SSR primer
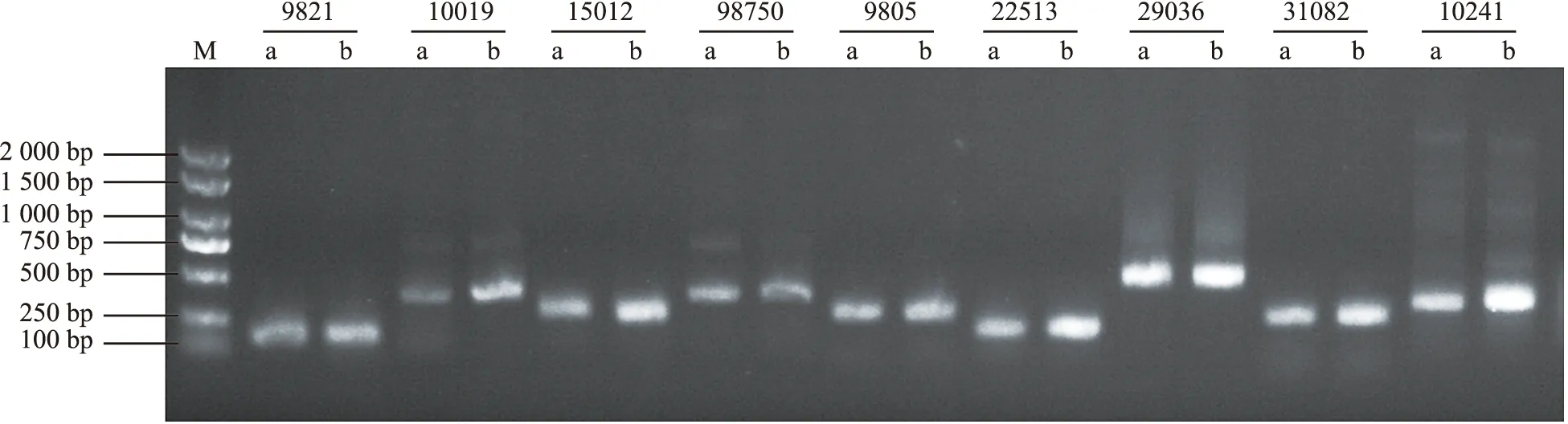
注:M为分子量标记;9821~10241为SSR引物编号;a为半夏母株,b为半夏游离块茎。图5 半夏母株与游离块茎遗传变异SSR-PCR检测Fig.5 Genetic variation detection of P. ternata mother plant and free tuber by SSR-PCR
3 讨 论
愈伤组织是植物离体培养形态发生过程中的重要组织形式,而来源于不同植物或同一植物不同组织、器官的细胞经过脱分化形成的愈伤组织,在颜色、结构等方面都可能存在差异[18]。根据愈伤组织的结构特点可以将其分为致密型与松散型,其中松散型愈伤组织是进行悬浮培养的良好材料,稍经机械振荡就能在液体培养基中形成大小均一的单细胞或微细胞团[19-20]。因此,进行悬浮培养诱导获得松散型愈伤组织就显得尤为重要。在诱导松散型愈伤组织过程中,植物生长调节剂发挥着极其重要的作用,其中生长素和细胞分裂素是启动细胞分化和脱分化的关键物质[21]。本研究通过L9(33)正交试验,探索蔗糖、2,4-D和6-BA浓度对半夏愈伤组织继代的影响,结果表明,2,4-D对半夏愈伤组织增殖倍数的影响显著,愈伤增殖倍数随着2,4-D浓度的升高呈先升高后降低的趋势,其中愈伤组织增殖倍数在2,4-D浓度为2.0 mg·L-1时达到最高,而蔗糖浓度与6-BA对愈伤组织增殖倍数的影响不显著。2,4-D被广泛用于诱导体细胞胚发生,并对胚性愈伤组织的产生十分重要;6-BA则与2,4-D共同作用促使半夏愈伤组织增殖,而蔗糖主要是作为能源物质并起到调节渗透压的作用。本实验通过对上述物质的筛选、优化,明确了半夏疏松愈伤组织形成的适宜继代培养条件。
在药用植物中利用悬浮培养主要是为了获得次生代谢物质和悬浮培养物[22],本研究则是为了获得半夏游离块茎,为此需要让疏松愈伤组织在液体培养基中分化形成胚状体直到形成游离块茎,而植物激素在细胞分化和形态建成中起着关键作用[23-25]。细胞分裂素促进细胞分裂,影响分化方向,生长素则影响细胞壁强度并促进细胞伸长,二者的不同配比是影响细胞分化的关键,而不同的材料因其自身内源激素水平不同,对外源激素的配比要求也不相同[26-28]。本实验设计了细胞分裂素类和生长素类及其浓度梯度的试验,并筛选出适于细胞分化的生长调节物质(6-BA和IBA),再以此进行正交试验,探究蔗糖、6-BA和IBA浓度对细胞分化的影响,明确了适宜半夏游离块茎分化形成的培养条件,其中6-BA对半夏游离块茎分化率的影响明显,而蔗糖浓度与IBA不显著。
在植物细胞与组织培养过程中,利用植物离体器官、组织和细胞进行培养过程中,培养细胞和再生植株极易受到非生物因子的影响,而发生体细胞无性系变异[29-30]。体细胞无性系变异普遍存在于植物细胞与组织培养的各个阶段,可能会导致组培材料品种优良性质丢失,也可能产生新的种质,因此对培养材料进行体细胞无性系变异的检测显得尤为重要[31-34]。本研究通过SSR标记将种植基地半夏植株和组织培养形成的半夏游离块茎对比分析,结果表明,半夏组培游离块茎与其天然母株DNA一致,未发生体细胞无性系变异,即该技术可用于半夏种质的离体保存与良种繁育。
4 结 论
半夏愈伤组织继代形成疏松愈伤组织的适宜培养基为MS+2,4-D 2.0 mg·L-1+6-BA 0.5 mg·L-1+蔗糖30 g·L-1+0.6%琼脂,利用该培养基可获得大量松散性好、均一性高、增殖再生能力强、适用于建立半夏游离块茎悬浮体系的半夏疏松愈伤组织;适于半夏疏松愈伤组织分化形成游离块茎的培养基为MS+6-BA 0.5 mg·L-1+IBA 1.0 mg·L-1+蔗糖20 g·L-1,得到的游离块茎可用于半夏人工种子制作或直接播种;SSR标记结果表明,组培形成的半夏游离块茎保持其天然母株的遗传特性。

