非洲猪瘟压力下北疆部分地区猪伪狂犬病抗体水平的检测与分析
常军帅,欧亚妮,谢 静,屈勇刚,梁 晏,李 娜,陈 宁,王紫阳
(1.石河子大学动物科技学院,新疆 石河子 832003;2.动物疾病防控兵团重点实验室,新疆 石河子 832003)
2018年8月3日,我国沈阳首次暴发非洲猪瘟。各地政府虽严防严控,但非洲猪瘟在全国各地仍呈现出蔓延态势,新疆于2019年4月也在某生猪场检测出了非洲猪瘟[1]。受疫情影响,2019年底生猪存栏量比同期下降40% 多,导致猪肉价格升至56元/kg(布瑞克农业数据库)[2]。在非洲猪瘟的压力下与生猪养殖的高额利润下,各养猪场势必更加重视生物安全,本试验拟对北疆部分地区的猪伪狂犬病抗体进行检测,分析非洲猪瘟压力下该病的抗体水平。
猪伪狂犬病是由伪狂犬病病毒(PRV)引起的,PRV属于疱疹病毒科疱疹病毒α-亚科,猪疱疹病毒I型。美国于1813年首次发现该病毒,之后各国都相继出现,PRV对全球养猪业每年造成的损失高达几十亿美元[3]。PRV感染后可导致母猪流产、死胎、木乃伊胎,公猪出现睾丸炎,仔猪出现脑脊髓炎,育成猪表现为呼吸系统综合征。因该病流行性强,危害各个阶段猪群,被世界动物卫生组织(OIE)列为必须上报的传染病,也被我国规定为Ⅱ类动物疫病。由于伪狂犬病清除难度大,暂无特效药等情况,生产中常采用伪狂犬病基因缺失疫苗免疫猪群,取得了良好的效果。为评价北疆部分地区猪伪狂犬病抗体水平,采用PRV-gB、PRV-gE ELISA检测方法进行为猪伪狂犬病的抗体检测与分析,以期为该地区PR的防控提供帮助。
1 材料
1.1 样品
2019年1 月至2020年12月期间从新疆石河子市、巴音郭楞蒙古自治州、伊犁哈萨克自治州、塔城地区、阿克苏市、奎屯市,随机采集717份猪血清样品,送至石河子大学动物科技学院传染病实验室进行检测。
1.2 材料和仪器
猪伪狂犬病病毒gB(PRV-gB)ELISA(酶联免疫吸附试验)抗体检测试剂盒、猪伪狂犬病病毒gE(PRV-gE)ELISA检测试剂盒均购自北京爱德士元亨生物科技有限公司;兽用一次性采血器5 mL为美康实业有限公司产品;自动酶标仪、微量移液器购自赛默飞世尔科技公司。
2 方法
2.1 样品处理
使用无菌采血器从猪前腔静脉采集约3~5 mL血液,静置后收集合格的血清,4 ℃短期保存,开始检测。
2.2 ELISA检测方法
PRV-gB:将试剂恢复至室温后摇匀,开始试验。把稀释(2倍稀释)好的样品、阴性对照、阳性对照(阴阳对照各2孔)加入抗原包被板反应孔内,室温下孵育1 h;液体倒掉,抗原包被板反应孔拍干,5次洗涤后,每孔加入100 μL酶标抗体,孵育20 min;再次拍干洗涤,加入100 μL的TMB底物,孵育15 min后加入50 μL终止液,使用酶标仪在OD650nm条件下测量记录吸光值。
PRV-gE:方法同PRV-gB。
2.3 结果判定
PRV-gB:当阴性均值-阳性均值≥0.3时,试验成立。通过计算S/N=样品OD650nm/阴性OD650nm均值,进行结果判定。当S/N>0.70时,为阴性;当0.60<S/N≤0.70时,为可疑;当S/N≤0.60时,为阳性。
PRV-gE:判定方法同PRV-gB。
2.4 数据分析
使用SPSS软件对数据进行统计分析,计算各地区、各猪群间的差异。
3 结果
3.1 不同地区PRV-gB抗体检测结果
由表1可知,在北疆6个规模化养猪场620份样品中,PRV-gB阳性数为583份,阳性率为94.03% (583/620)。其中D场阳性率最高,为100.00% (147/147);E场阳性率最低,为84.93% (62/73)。通过计算各猪场间S/N值发现,不同猪场间PRV-gB抗体水平间存在着差异,E场与A场、B场、C场、D场、F场均存在显著差异(P<0.05);B场与C场无显著差异(P>0.05)。
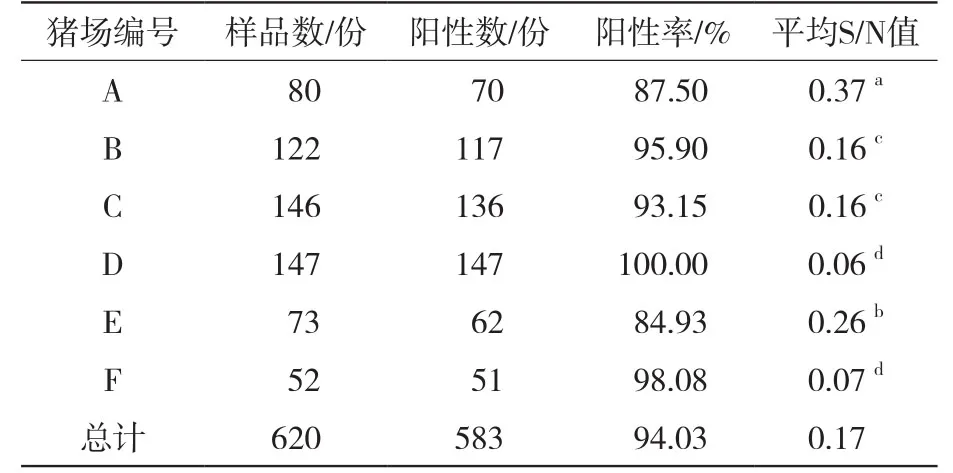
表1 不同地区PRV-gB抗体检测结果
3.2 不同地区PRV-gE抗体检测结果
由表2可知,在北疆6个规模化养猪场717份样品中,PRV-gE阳性数为310份,阳性率为43.23% (310/717)。其中D场阳性率最高,为89.86% (124/138);C场阳性率最低,为14.19% (21/148)。通过计算各猪场间S/N值发现,不同猪场间PRV-gE抗体水平间存在着差异,C场与A场、B场、D场、E场、F场均存在显著差异(P<0.05);A场与B场、E场无显著差异(P>0.05)。
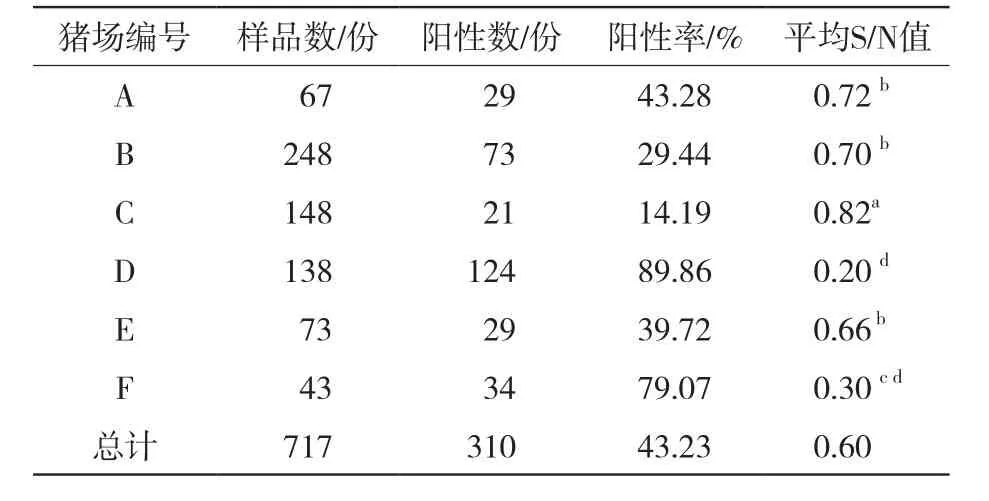
表2 不同地区PRV-gE抗体检测结果
3.3 不同猪群PRV-gB抗体检测结果
由表3可知,在6个猪群类别620份样品中,PRV-gB阳性率为94.03% (583/620)。其中种母猪阳性率最高,为97.59% (243/249);保育猪阳性率最低,为86.79% (46/53)。通过计算各类别猪群间S/N值发现,不同类别猪群间PRV-gB抗体水平间存在着差异,种公猪与哺乳仔猪、保育猪、肥育猪、后备猪、种母猪均存在显著差异(P<0.05);后备猪与哺乳仔猪、保育猪、肥育猪、种母猪无显著差异(P>0.05)。
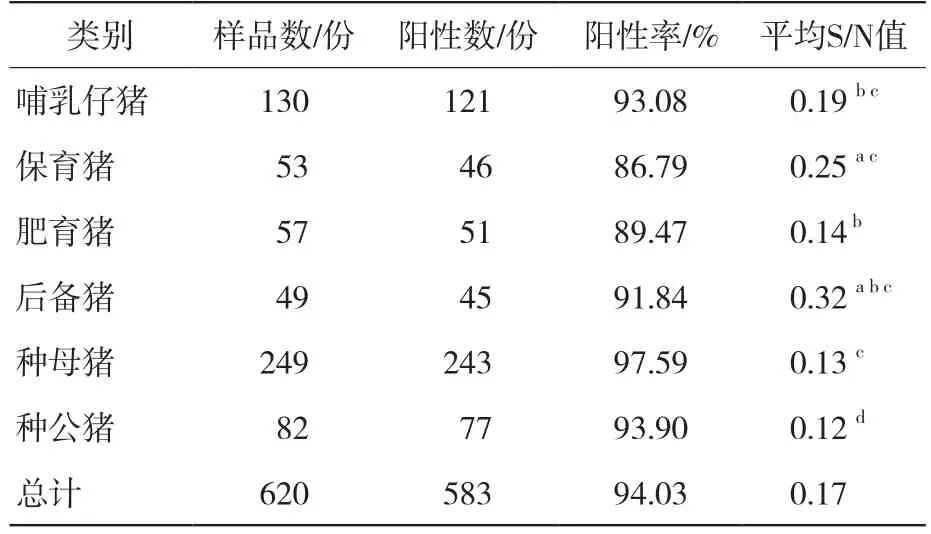
表3 不同猪群PRV-gB抗体检测结果
3.4 不同猪群PRV-gE抗体检测结果
由表4可知,在6个猪群类别717份样品中,PRV-gE阳性率为43.23% (310/717)。其中后备猪阳性率最高,为64.86% (48/74);肥育猪阳性率最低,为13.19% (12/91)。通过计算各类别猪群间S/N值发现,不同类别猪群间PRV-gE抗体水平间存在着差异,种公猪与哺乳仔猪、保育猪、肥育猪、后备猪、种母猪均存在显著差异(P<0.05);种母猪与保育猪、后备猪无差异(P>0.05)。
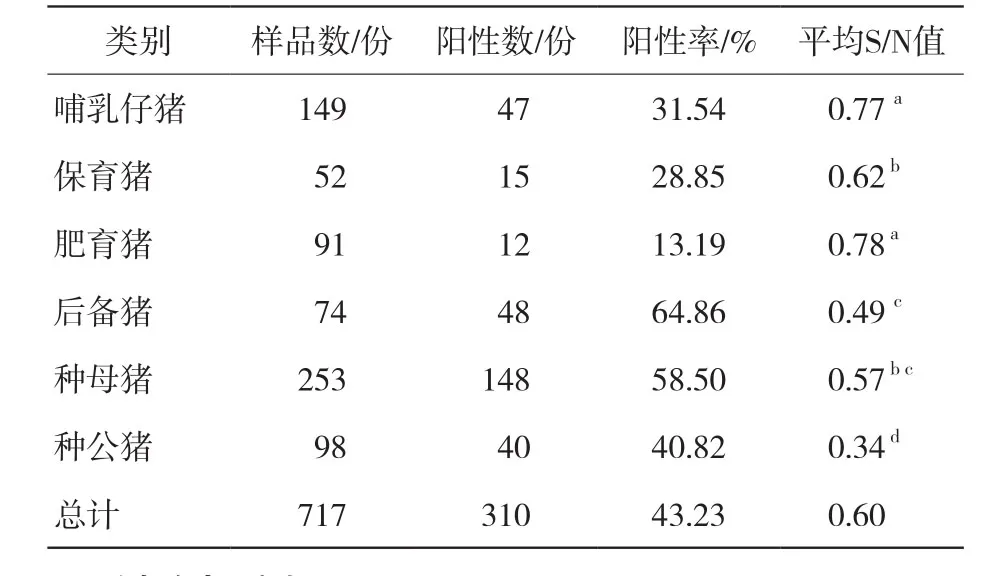
表4 不同猪群PRV-gE抗体检测结果
4 讨论与分析
4.1 PRV-gB抗体结果分析
通过检测结果发现,各个地区的PRV-gB抗体水平都超过了国家规定的70%,说明该地区免疫接种工作到位。该地区PRV-gB抗体水平为94.03% (583/620),高于明月月等[5]调查的粤西地区部分猪场PRV-gB抗体水平(92.69% ),也远高于吕远蓉等[6]调查的南充地区PRV-gB抗体水平(78.00% )。各猪场间免疫水平也不尽相同,D场免疫最为全面,A场虽然免疫较为全面,但抗体水平与D场相比,存在着显著差异(P<0.05),可同时筛查是否存在免疫抑制疾病,影响着免疫效果。各个猪群的PRV-gB抗体水平都超过了85.00%,且种猪群抗体水平都在90.00% 以上,保证了猪场的健康。
4.2 PRV-gE抗体结果分析
据了解本次试验采样猪场均使用PRV-gE基因缺失疫苗免疫猪群,所以本次试验对PRV-gE抗体的检测可以更方便了解到该地区各阶段猪群感染PRV野毒的情况。6个猪场都存在PRV野毒感染情况,其中D场和F场感染率最高,分别为89.86% (124/138)和79.07% (34/43),生产中需及时结合抗体检测结果淘汰阳性种猪,商品猪调整免疫程序,才可能逐步下调PRV野毒感染率。各阶段猪群中,后备猪群感染PRV野毒率最高,为64.86% (48/74),后备猪在引种时需抗体检测,无PRV野毒感染后隔离28 d,再次检测,出现阳性或可疑现象,不予合群。
结合PRV-gB、PRV-gE检测结果,说明该地区PRV-gB抗体阳性率高,部分原因是由于存在大量的PRV野毒感染导致的。虽说该地区PRV-gE抗体水平高达43.23% (310/717),但与魏其等[7]于非洲猪瘟发生前该地区的PRV-gE抗体水平(45.14% )相比,呈下降趋势。将来可加强阳性种猪的淘汰、改善免疫程序及技术依托,有计划地开展猪场中PRV的进化。