QuEChERS-同位素稀释-气相色谱-串联质谱法测定动物源性食品中9种N-亚硝胺类化合物
孔祥一, 庄丽丽, 方恩华, 林 鹏, 郑子龙, 郑向华, 徐敦明*
(1. 集美大学水产学院, 福建 厦门 361021; 2. 厦门海关技术中心, 福建 厦门 361000; 3. 福建省市场监督管理局, 福建 福州 350003)
亚硝胺是一类含有N-亚硝基(N-NO)的亚硝基化合物[1],广泛存在于饮用水、熏肉制品和腌制蔬菜中[2]。蛋白质腐败分解时可以产生胺类物质,因此蛋白质含量丰富的食物往往容易N-亚硝胺类化合物含量超标,此外经过烟熏、油炸、腌制的动物源性食品也容易产生亚硝胺[3]。1937年,Freund[4]第一次报道了两例由于职业接触N-亚硝基二甲胺(NDMA)而导致中毒的案例,目前已经证实亚硝胺对生物具有很强的基因毒性,可诱导人体的食管、肝脏和肾脏等器官发生癌症[5],其中NDMA、N-二乙基亚硝胺(NDEA)被国际癌症研究机构(IRAC)评定为2A级致癌物,其他的N-亚硝胺类化合物为2B级致癌物。目前,我国在GB 2762-2017食品安全国家标准 食品中污染物限量》中也对动物源性食品中NDMA限量指标做了要求,其中肉及肉制品(肉类罐头除外)的限量为3 μg/kg,水产动物及其制品(水产品罐头除外)的限量为4 μg/kg。动物源性食品中的N-亚硝胺类化合物严重危害人体健康,如何控制动物源性食品生产过程中N-亚硝胺类化合物的产生也是当前N-亚硝胺类化合物研究的重要方向,开发对N-亚硝胺类化合物含量进行快速检测和定量的技术尤为重要[6]。
热能分析仪作为基于化学发光设计的专门测定N-亚硝胺类化合物的检测器,具有检测快速、灵敏度高的优点[7,8],但其价格昂贵,应用范围窄,且使用过程中经常需要检修和维护,一般实验室都未配备,故基于热能分析仪的N-亚硝胺类化合物检测法未能广泛应用。此外,针对亚硝胺的检测方法还有色谱-核磁法[9]、电化学检测法[10-13]、液相色谱法[14]、液相色谱-质谱法[15,16]、气相色谱-氮磷检测器法[17]、气相色谱-质谱法[18-20]等。其中电化学检测方法的精度和灵敏度仍有待提高;液相色谱-串联质谱法对相对分子质量较小的N-亚硝胺类化合物的响应无法达到要求;气相色谱-质谱法容易产生NDMA假阳性现象,气相色谱-串联质谱法因其高特异性和高灵敏度,是目前针对N-亚硝胺类化合物检测最为广泛使用的方法。
N-亚硝胺类化合物的前处理方法主要包括液液萃取法、水蒸气蒸馏萃取法、超临界萃取法和QuEChERS等。目前国内对N-亚硝胺类化合物的标准检测方法为GB 5009.26-2016《食品安全国家标准 食品中N-亚硝胺类化合物的测定》,其提取方法为水蒸气蒸馏法,但该方法的样品需求量过大,操作过程复杂,耗时较长,且回收率波动较大;朱萌萌等[21]采用蒸馏萃取法结合气相色谱-串联质谱法对肉制品中10种挥发性N-亚硝胺类化合物进行检测,可实现蒸馏和提取同时进行,但仍存在耗时较长和样品用量大等问题,在面对大量待测样品时具有一定的局限性;何淑娟等[22]和高蕙文等[23]利用净化剂对N-亚硝胺类化合物提取液进行净化后氮吹至近干,但N-亚硝胺类化合物在氮吹至近干时损失较大,容易造成回收率较低;李玮等[24]使用N-丙基乙二胺(PSA)、十八烷基键合硅胶(C18)和无水硫酸钠对N-亚硝胺类化合物提取液进行净化和除水,但PSA的净化效果较弱,可能导致定量结果不准确;硫酸钠除水效果较弱,可能造成除水不彻底,从而影响仪器性能。
QuEChERS是近年来国际上兴起的一种新型农产品检测的快速样品前处理技术,是利用基质分散萃取机理来吸附样品中的杂质,从而达到保留目标物和净化样品的目的。本文通过优化样品前处理条件、色谱和质谱条件,建立了QuEChERS-同位素稀释-气相色谱-串联质谱同时快速测定动物源性食品中9种N-亚硝胺类化合物的方法。该方法具有操作简单、提取高效、更加经济的优点,可准确、快速测定动物源性食品中的N-亚硝胺类化合物。
1 实验部分
1.1 仪器与试剂
7890气相色谱-7000三重四极杆质谱仪(美国Agilent公司); 2-16KL高速离心机(德国Sigma公司); VORTEX 3涡旋混匀仪(德国IKA公司)。
乙腈、二氯甲烷、乙酸乙酯均为色谱纯(德国Merck公司); MgSO4和NaCl均为分析纯(广州西陇化工有限公司),聚苯乙烯二乙烯苯聚合物(PLS-A)、十八烷基键合硅胶吸附剂(C18)(北京迪马公司);增强型脂质去除(EMR)小柱(美国Agilent公司);实验用水由Milli-Q超纯水系统(美国Millipore公司)制备。
9种N-亚硝胺类化合物标准品包括NDMA、N-亚硝基乙基甲基胺(NMEA)、NDEA、N-亚硝基二丁胺(NDBA)、N-亚硝基二丙胺(NDPA)、N-亚硝基哌啶(NPIP)、N-亚硝基吗啉(NMorPh)、N-亚硝基二苯胺(NDPhA)及内标N-亚硝基二甲胺-d6(NDMA-d6)、N-亚硝基二正丙胺-d14(NDPA-d14),均购自英国LGC公司,质量浓度均为1 000 μg/mL。
1.2 实验方法
1.2.1标准溶液的配制
将9种N-亚硝胺类化合物标准品(1 000 μg/mL)用乙腈稀释配制成1.0 μg/mL的混合标准工作液,低于-18 ℃避光保存,有效期6个月。
将内标标准品(1 000 μg/mL)用乙腈稀释配制成1.0 μg/mL的内标工作液,低于-18 ℃避光保存,有效期6个月。
1.2.2样品前处理
液态样品摇匀后提取处理;粉状样品直接提取处理;其他样品取可食部分组织捣碎。将制备好的试样于0~5 ℃冷藏保存,待测。
提取:称取10 g(精确至0.01 g)试样,置于50 mL离心管中,加入200 μL内标工作液和10 mL乙腈,涡旋1 min混匀,置于冰箱-20 ℃冷冻30 min,加入陶瓷均质子2粒、4 g MgSO4和1 g NaCl,涡旋1 min,于0 ℃以9 000 r/min离心5 min,上清液待净化。
净化:取150 mg PLS-A粉末和5 mL水,置于15 mL离心管中,振荡后加入5 mL上述上清液,并涡旋1 min,于0 ℃以9 000 r/min离心5 min。
除水:将净化液转移至另一15 mL离心管中,加入1.6 g MgSO4和0.4 g NaCl,涡旋30 s,于0 ℃以9 000 r/min离心5 min,取1 mL上层有机相过0.22 μm微孔滤膜,然后移入进样瓶中上机检测。
1.2.3分析条件
色谱柱:毛细管气相色谱柱HP-Innowax(30 m×0.25 mm×0.25 μm,美国Agilent公司);进样口温度:220 ℃;载气:氦气;流速60 mL/min;溶剂放空模式;程序升温模式:初始温度50 ℃,保持0.16 min,以900 ℃/min升温至220 ℃,保持5 min;进样量5 μL。
电子轰击电离(EI)源;离子源温度250 ℃;传输线温度250 ℃;溶剂延迟6 min;电子能量:70 eV;采集模式:MRM模式。9种亚硝胺类化合物及内标的保留时间、前体离子、子离子、碰撞能量(CE)见表1。

表 1 9种N-亚硝胺类化合物及2种内标的质谱参数
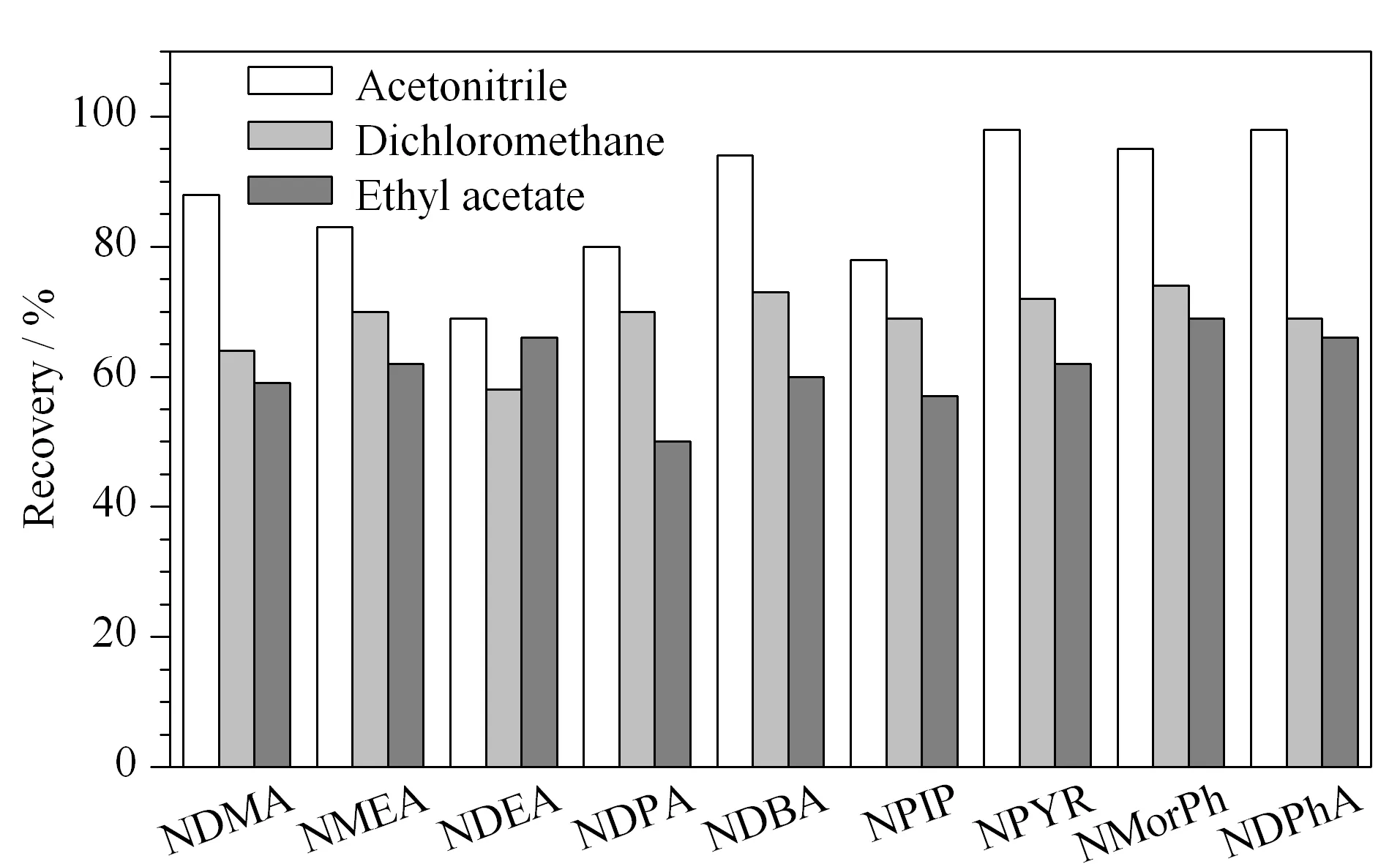
图 1 不同提取溶剂对9种N-亚硝胺类化合物回收率的影响Fig. 1 Effect of different extraction solvents on the recoveries of the nine N-nitrosamines
2 结果与讨论
2.1 提取液的选择
N-亚硝胺类化合物相对分子质量较小,极性较强,在强极性溶剂中溶解性更强,常用的提取溶剂有乙腈、二氯甲烷和乙酸乙酯[25]。实验对这3种溶剂进行对比,结果见图1。可以看出,乙腈对N-亚硝胺类化合物的溶解性较强,对油脂和色素等杂质溶解度相对较小,提取效率最佳;乙酸乙酯对极性强的N-亚硝胺类化合物提取效果较差,且容易与油脂共萃取,从而对上机造成干扰;二氯甲烷提取效果差,且操作中由于挥发性极强容易造成误差。因此本实验选择乙腈作为提取溶剂。
2.2 吸附剂的选择
肉制品、水产品等动物源性食品通常含有色素、脂肪酸等复杂基质,很容易影响测定的准确性。C18通常用来去除脂肪酸、色素,同时吸附非极性化合物,PLS-A可较好地吸附有机酸、脂肪酸、糖、色素等干扰物质。根据何淑娟等[22]的研究,本文选取PLS-A粉末、C18粉末和EMR小柱对其净化效果进行对比。准备待测样品3份,将样品中加入200 μLN-亚硝胺类化合物内标工作液,其中两份样品分别用150 mg PLS-A和150 mg C18进行净化处理,第三份样品采用EMR小柱净化,3份样品按照1.2.2节进行处理,其中EMR小柱加入1 mL水进行活化后再加入1.2.2节的待净化液4 mL进行净化,样品回收率见图2。结果表明,采用PLS-A时,净化效果较好,对油脂、色素等杂质的净化效果理想。因此本文采用PLS-A作为净化剂。

图 2 不同净化方式对9种N-亚硝胺类化合物回收率的影响Fig. 2 Effect of different purification methods on the recoveries of the nine N-nitrosamines PLS-A: polystyrene divinylbenzene polymer; EMR: enhanced lipid removal.
经由PLS-A净化后的溶液含水,需除水后才能进行仪器分析,本方法采用MgSO4和NaCl作为除水剂。NaCl可以增强溶液极性,减小N-亚硝胺类化合物在水中的溶解度,得到更高的萃取效率;MgSO4除水能力更好,但在吸水过程中会大量放热,亚硝胺在高温条件下易挥发,减少MgSO4的用量可减少损失,但减少过多又容易导致除水不彻底。经对比研究最终采用1.6 g MgSO4和0.4 g NaCl除水。
2.3 色谱、质谱条件的选择
参考翟孟婷等[26]的研究结果,选用毛细管气相色谱柱HP-Innowax (30 m×0.25 mm×0.25 μm)。按1.2.3节条件对9种N-亚硝胺类化合物进行测定,得到总离子流色谱图和MRM色谱图(见图3)。

图 3 9种N-亚硝胺类化合物及其内标的总离子流 和MRM色谱图(10 μg/L)Fig. 3 Total ion current and MRM chromatograms of the nine N-nitrosamines and their IS (10 μg/L)
2.4 基质效应
基质效应(ME)是指在测定过程中,由于待测成分的离子化效应被改变,从而信号受到增强或者抑制的现象。基质效应会影响结果的准确度。本文参考Al-Kaseem等[14]的方法,采用标准曲线法(基质效应=基质匹配溶液斜率与溶剂标准溶液斜率的比值×100%)来考察N-亚硝胺类化合物在动物源性食品中的基质效应。ME值在85%~115%之间可认为该基质不存在基质效应。用空白样品提取液作为标准溶液的稀释溶液,使标准溶液和样品溶液的离子化效应相同。结果表明,9种N-亚硝胺类化合物的ME值均小于70%,可认为亚硝胺在动物源性食品中表现出较强的基质抑制效应,为确保测定的准确性,本文采用内标法进行准确定量。

表 3 9种N-亚硝胺类化合物在动物源性食品中的添加回收率和相对标准偏差(n=6)
2.5 标准曲线、检出限和定量限
精密吸取9种N-亚硝胺类化合物混合标准工作液和内标工作溶液适量,用乙腈稀释成质量浓度为0.1、0.5、1.0、5.0、20.0和50.0 μg/L的系列混合标准溶液,其中内标的质量浓度均为20.0 ng/mL,实验按浓度由低到高的顺序进样分析。以N-亚硝胺类化合物及其对应氘代同位素内标的浓度比值为横坐标,以N-亚硝胺类化合物及其对应氘代同位素内标的峰面积比值为纵坐标,绘制标准曲线,从而获得线性方程和相关系数(R2),见表2。结果表明,线性相关系数均不小于0.99,说明N-亚硝胺类化合物在0.1~50.0 μg/L范围内有良好的线性关系。以定量离子信噪比(S/N)为3和10时的响应定义方法的检出限(LOD)和定量限(LOQ), 9种N-亚硝胺类化合物的检出限和定量限分别为0.03~0.30 μg/kg和0.10~1.00 μg/kg。

表 2 9种N-亚硝胺类化合物的线性方程、相关系数、检出限和定量限
2.6 准确度和精密度
按照前述方法,对不含N-亚硝胺类化合物的鱼肉、虾肉、牛肉和腊肠等4种空白样品进行添加回收试验,设定添加水平为0.5、1.0、3.0 μg/kg,考察方法的准确度和精密度,结果见表3。结果表明,9种N-亚硝胺类化合物的回收率为80.4%~98.5%, RSD为2.41%~12.50%,方法准确度和精密度良好。

表 3 (续)
2.7 实际样品检测
按照本文建立的方法对采集的60批动物源性食品,包括肉糜、腌制肉制品、水产制品等样品进行分析,有18批样品中检出N-亚硝胺类化合物(见表4),其中NDMA、NDBA、NPIP、NPYR、NDPhA的检出率最高,且部分腌制水产品的NDMA含量高出我国GB 2762-2017《食品安全国家标准 食品中污染物限量》中的限量值(NDMA≤3 μg/kg),其中腌制鱿鱼丝样品中的NDMA含量甚至高达7.93 μg/kg。

表 4 实际样品中9种N-亚硝胺类化合物的检测结果
3 结论
建立了QuEChERS-同位素稀释-GC-MS/MS测定动物源性食品中9种N-亚硝胺类化合物残留的方法。方法的回收率和精密度良好,线性范围广,重复性好,检出限低,可以同时对9种N-亚硝胺类化合物快速地进行定性和定量分析,从而为动物源性食品中N-亚硝胺类化合物含量的安全评价提供依据。

