不同外源物质对西瓜番茄红素含量及其关键酶基因表达的影响
马荣雪,周永海,程登虎,李世玉,张 显,李 好,马建祥,张 勇
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
西瓜(Citrulluslanatus(Thunb.) Matsum. & Nakai)为葫芦科西瓜属植物,其果实汁多味美、营养丰富,富含番茄红素[1]。番茄红素是类胡萝卜素中最有效的抗氧化剂,具有重要的抗病和保健功能[2-3]。研究表明,红瓤西瓜中的番茄红素含量比许多鲜食番茄品种高,并且鲜西瓜的番茄红素与烹饪后番茄汁中的番茄红素的生物可利用性相同[4],所以提高西瓜番茄红素含量具有重要意义。
影响果实番茄红素含量的因素很多,温度、水分、土壤等生态环境都是重要的影响因子。李莉等[5]研究表明,适当加大昼夜温差有利于番茄果实中番茄红素的合成。Brandt等[6]发现,50%最适水分供给量的番茄果实中番茄红素含量(86.5 mg/kg)高于100%最适水分供给量的果实(62.5 mg/kg)。Dia等[7]发现,西瓜番茄红素含量因环境不同造成的差异比品种之间的差异更显著。有研究表明,外源物质也能影响番茄果实的番茄红素含量,如Mn2+、K+等阳离子可促进番茄果实中番茄红素的积累[8]。而外源激素也能调节类胡萝卜素等次生产物的代谢,如脱落酸(ABA)、油菜素内酯(BR)、茉莉酸甲酯(MeJA)、乙烯(ETH)等均可促进番茄红素的积累[9-11],而对番茄果实外源涂抹赤霉素(GA3)则抑制番茄红素的合成[9]。
番茄红素的合成过程包括缩合、脱氢、环化、羟基化及环氧化等一系列反应,其中植物烯合成酶(PSY)催化2分子的牻牛儿基牻牛儿基焦磷酸(GGPP)合成1分子的八氢番茄红素,然后通过八氢番茄红素脱氢酶(PDS)转化为六氢番茄红素和ζ-胡萝卜素。ζ-胡萝卜素由ζ-胡萝卜素异构酶(Z-ISO)异构化并且通过ζ-胡萝卜素脱氢酶(ZDS)两次脱氢成为链孢红素和四-顺式-番茄红素,然后在胡萝卜素异构酶(CRTISO)的作用下异构化为红色的全反式番茄红素。番茄红素有两条主要的代谢途径:一是通过番茄红素ε-环化酶(LCYE)和番茄红素β环化酶(LCYB)生成α-胡萝卜素,然后合成叶黄素;二是通过LCYB生成β-胡萝卜素,进一步通过9-顺式-环氧类胡萝卜素双加氧酶(NCED)合成ABA[12-13]。Dou等[14]研究认为,番茄红素合成途径上游PSY基因和控制分解的LCYB基因在番茄红素合成中可能起到较为重要的作用,其中LCYB基因对西瓜瓤色起关键作用。Haejeen等[15]研究发现,西瓜番茄红素含量与LCYB基因有关。
目前有关外源物质对番茄红素含量及其关键酶基因影响的研究较少,且在西瓜上鲜有报道。为此,本试验在前人研究基础上,选用ABA、MnSO4和褪黑素(MT) 3种外源物质,探讨其对西瓜番茄红素含量及合成代谢相关酶基因表达的影响,为明确番茄红素积累内在机理和提高西瓜番茄红素含量提供理论依据。
1 材料与方法
1.1 试验材料
供试西瓜品种为红瓤西瓜玲珑王,嫁接砧木为南瓜。
所用试剂甲醇、乙腈、MTBE均为色谱级,番茄红素标准品为Sigma公司产品,EASY多糖多酚RNA提取试剂盒(离心柱型)由北京君诺德生物技术有限公司生产,FastKing cDNA First Chain Synthesis Kit试剂盒由TIANGEN 公司生产,iQ5实时定量仪由美国Bio-rad公司生产,SYBR® Premix Ex Taq TM II(2×)试剂盒由日本TaKaRa生产。
1.2 试验设计
试验于2020年3-7月在西北农林科技大学揉谷镇西甜瓜试验站塑料大棚中进行。西瓜种植株行距为80 cm×50 cm,均采用常规栽培管理方式及水肥供给方法。在植株长到伸蔓期时,按前期筛选到的最佳浓度,叶面分别喷施20 μmol/L ABA、0.002 μmol/L MnSO4和500 μmol/L MT,以喷施清水为对照(CK),每7 d喷施1次,直至授粉期结束,共喷施3次。试验采用随机区组排列,每个处理3次重复,每重复30株。授粉后10 d开始采样,每7 d采样1次,即分别于授粉后10,17,24,31,38 d采样,共采收5次。每个重复选取5个长势一致且发育良好的果实纵切,在果实中心部位取样后混合,用锡箔纸包裹后迅速在液氮中冷冻,然后放于超低温冰箱中储存,一部分用于番茄红素测定,一部分用于定量分析。
1.3 方 法
1.3.1 番茄红素的提取纯化 称取瓜样2 g,置于冷冻干燥机中干燥,用丙酮-乙醇提取液(体积比1∶1,含0.01%丁羟甲苯(BHT))洗涤至无色,合并洗涤液并定容至10 mL。使用水浴旋转蒸干仪蒸干,用1 mL乙酸乙酯(色谱级)溶解,0.22 μm有机相滤膜过滤后加入进样瓶中。
1.3.2 番茄红素含量的测定 番茄红素的HPLC测定参照刘庆[16]的方法,根据实际情况稍加改动。色谱柱使用YMC C30类胡萝卜素专用色谱柱(4.6 mm×250 mm,5 μm)。流动相:A相为V(乙腈)∶V(甲醇)=3∶1(含0.01% BHT和0.05%三乙胺),B相为100%甲基叔丁基醚(含0.01% BHT)。流速1.00 mL/min,柱温25 ℃,检测波长450 nm,进样量10 μL。洗脱条件为:0 min.V(A)∶V(B)=99∶1;0~10 min.V(A)∶V(B)=85∶15;10~16 min.V(A)∶V(B)=82∶18;16~25 min.V(A)∶V(B)=75∶25;25~54 min.V(A)∶V(B)=50∶50;54~64 min.V(A)∶V(B)=18∶82;65 min.V(A)∶V(B)=99∶1;66 min 停止。出峰时间为45.53 min。
1.3.3 番茄红素生物合成相关酶基因的实时荧光定量PCR分析 采用EASY多糖多酚RNA提取试剂盒(离心柱型)提取果肉样品RNA。采用FastKing cDNA First Chain Synthesis Kit试剂盒反转录成cDNA。通过http://cucurbitgenomics.org/search/genome/4网页查询牻牛儿基牻牛儿基焦磷酸合成酶基因(GGPS)、ZDS、PSY、LCYB、LCYE、NCED等番茄红素代谢酶基因的全长序列,利用Primer3Plus设计目的基因特异引物(表1),引物均由北京奥科鼎盛生物科技有限公司合成,基因的相对定量分析采用iQ5实时定量仪进行分析,用SYBR® Premix Ex Taq TM Ⅱ(2×)试剂盒扩增PCR产物。

表1 番茄红素代谢酶基因的RT-PCR引物序列Table 1 Sequences of real-time PCR primers for genes of lycopene metabolizing enzymes
反应体系总计20 μL,分别为SYBR荧光燃料10 μL、cDNA 1 μL、ROX 0.2 μL、ddH2O 7.8 μL、上下游引物各0.5 μL。PCR扩增条件为:95 ℃灭火活3 min:95 ℃失活30 s,58 ℃退火30 s,72 ℃延伸30 s,共计40个循环。以适用于西瓜荧光定量PCR的Actin为内参基因,以喷施清水西瓜植株授粉后10 d的果肉cDNA为对照,利用合成的引物,采用2-ΔΔCt法对荧光定量PCR扩增数据进行处理,目的基因相对于内参基因的相对表达量通过2-ΔΔCt值来确定,每个基因3次重复。
1.4 数据处理
试验数据用Excel、SPSS软件进行分析处理。
2 结果与分析
2.1 不同外源物质对西瓜番茄红素积累的影响
2.1.1 对西瓜果肉颜色生长发育的影响 不同处理果实各个发育时期的果肉颜色变化如图1所示。由图1可以看出,在授粉后10 d,西瓜果肉颜色均为白色;授粉后17 d时,果肉颜色开始显现红色,此时3种外源物质处理果肉颜色均比清水对照的深;授粉后24~31 d,随着果实的膨大,西瓜果肉颜色不断加深,3种外源物质处理的西瓜瓤色仍强于对照;授粉后38 d时,果实完全成熟,果肉颜色最红,处理间果肉颜色相近,从颜色上看,与对照相比无明显差异。
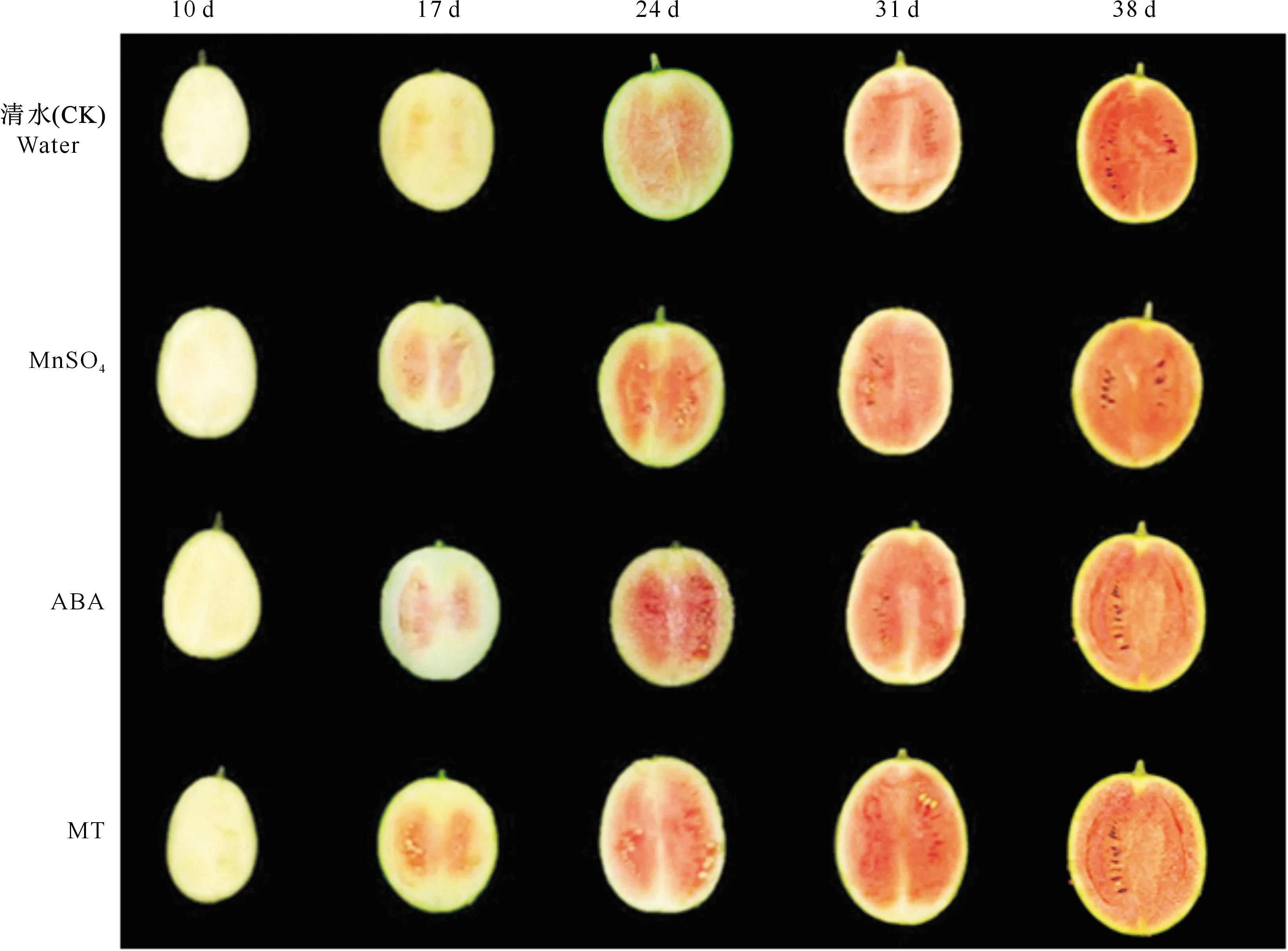
图1 不同外源物质处理西瓜授粉后果肉颜色随时间的变化Fig.1 Changes of flesh color in watermelon at different stages after pollination under different exogenous substances treatments
2.1.2 对西瓜果实番茄红素积累量的影响 如图2所示,西瓜番茄红素含量随着授粉后时间的延长逐步增加。在授粉后10 d,MnSO4处理番茄红素含量为5.54 μg/g,ABA处理番茄红素含量为1.58 μg/g,而其他处理则未检测到番茄红素。在授粉后17 d,4种处理西瓜果实均可检测到番茄红素,MT处理番茄红素含量(12.85 μg/g)最高, MnSO4处理次之,二者无显著差异,ABA处理番茄红素含量显著低于MnSO4和MT处理,但3种外源物质处理番茄红素含量均显著高于清水对照,分别较清水对照高2.78,2.46和1.36倍,随后西瓜果实番茄红素含量迅速积累。到授粉后31 d时,番茄红素积累速度开始减慢,授粉后38 d时西瓜完全成熟,番茄红素含量达到峰值,MnSO4、ABA、MT 3个外源物质处理西瓜果实番茄红素含量分别为90.78,82.24和82.13 μg/g,且均显著高于清水对照(65.00 μg/g),但3种外源物质处理间番茄红素含量差异不显著。

图柱上标不同小写字母表示在P<0.05水平上处理间差异显著Different lowercase letters indicate significant differences between treatments at the P<0.05 level图2 不同外源物质处理西瓜授粉后果肉番茄红素含量随时间的变化Fig.2 Changes in lycopene content in watermelon fruits at different stages after pollination under different exogenous substances treatments
2.2 不同外源物质处理后西瓜关键酶基因表达量的变化
2.2.1 ABA处理 由图3可以看出,ABA处理后,西瓜不同授粉时间果实番茄红素关键酶基因的相对表达量与清水对照处理间存在差异,其中番茄红素环化酶基因(LCYB、LCYE)的差异尤为明显。
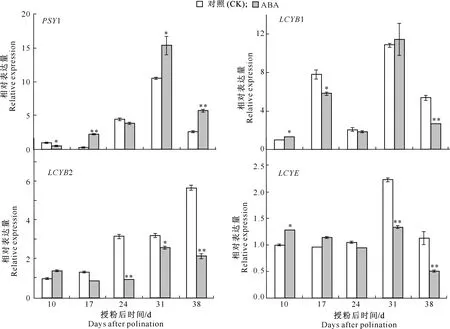
*表示在P<0.05水平差异显著,**表示在P<0.01水平差异极显著。下同* means significant difference at P<0.05,** means extremely significant difference at P<0.01.The same below图3 ABA处理西瓜授粉后不同时间果实番茄红素关键酶基因相对表达量的动态变化Fig.3 Dynamic changes in expression levels of lycopene key enzyme genes in watermelon fruits after pollination under ABA treatment
与对照相比,番茄红素合成的主要限制酶基因PSY1的相对表达量在授粉后17,31和38 d时显著或者极显著上调表达,而授粉后10 d显著下调表达。与对照相比,LCYB1基因的相对表达量在授粉后17和38 d显著或极显著下调;LCYB2基因的相对表达量在授粉后24,31和38 d显著或极显著下调;LCYE基因的下调表达主要在授粉后24 d开始出现,在授粉后31 和38 d时相对表达量极显著下调。
2.2.2 MnSO4处理 由图4可以看出,MnSO4处理后,影响西瓜果实番茄红素含量的主要原因是番茄红素合成上游基因的上调表达。与对照相比,GGPS1和GGPS2基因在授粉后17 和38 d时显著或极显著上调表达。与对照相比,PSY1基因的相对表达量在授粉后17,24和38 d时显著或极显著上调表达,PSY2基因表达量在授粉后10,17和38 d时显著或极显著上调表达,PSY1基因的相对表达量在整个生长周期明显高于PSY2,说明PSY1基因具有主要调控作用。与对照相比,ZDS基因在授粉后17和38 d时极显著或显著上调表达,而LCYB1基因在授粉17 d后一直下调表达,说明下游基因也参与一部分调控。

图4 MnSO4处理西瓜授粉后不同时间果实番茄红素关键酶基因相对表达量的动态变化Fig.4 Dynamic changes in expression levels of lycopene key enzyme genes in watermelon fruits after pollination under MnSO4 treatment
2.2.3 MT处理 由图5可以看出,MT处理后西瓜果实番茄红素关键酶基因的表达差异主要是由NCED和LCYB引起的。在整个发育周期,NCED1和NCED7基因的相对表达量极显著低于清水对照,在授粉后31 d时对照NCED1基因相对表达量约为MT处理的195倍;而NCED7基因在授粉后38 d时与对照差异最大,对照相对表达量约为MT处理的5.4倍。LCYB1基因的相对表达量在授粉后17 和31 d时较清水对照显著下调表达;LCYB2在授粉24 d后持续下调表达,均极显著低于清水对照。

图5 MT处理西瓜授粉后不同时间果实番茄红素关键酶基因相对表达量的动态变化Fig.5 Dynamic changes in expression levels of lycopene key enzyme genes in watermelon fruits after pollination under MT treatment
3 讨 论
Mn2+、ABA、MT能增加西瓜果实中番茄红素的含量。研究表明,对番茄果实单独喷施MnSO4和ABA,均促进了果实中番茄红素的积累,其含量较空白对照增加了36.01%和50.36%[8]。孙倩倩[17]采用MT溶液浸泡绿熟期番茄2 h发现,MT处理番茄果实中番茄红素含量是对照的5.1倍。本研究结果表明,3种外源物质处理能促进西瓜果实番茄红素提前合成,其含量在西瓜整个发育期均显著高于对照,且在西瓜果实成熟期即授粉后38 d, MnSO4、ABA、MT 3个外源物质处理西瓜果实番茄红素含量分别为90.78,82.24和82.13 μg/g,且均显著高于清水对照(65.00 μg/g)。
外源ABA可以增加西瓜果实中番茄红素的积累量。本研究发现,ABA处理使西瓜果实番茄红素环化酶基因LCYB1、LCYB2和LCYE的相对表达量总体呈下调趋势。而番茄红素环化酶基因的表达量降低或者受到抑制时,会导致番茄红素向α、β-胡萝卜素转化的效率降低[18],这与本试验研究结果一致。Yu等[19]研究发现,外源施加ABA是通过降低番茄内源ABA含量来释放内源乙烯,引起番茄红素的积累。Diretto等[20]研究发现,LCYB基因过表达会引起番茄中β-胡萝卜素含量增加,从而使内源ABA含量增加,导致乙烯释放量降低。结合前人的研究结果认为,外源施加ABA会抑制LCYB基因的表达,导致β-胡萝卜素含量下降,进而引起内源ABA含量下降,乙烯含量增加,从而促进番茄红素的积累。
GGPP是类胡萝卜素的合成前体。在西瓜果实发育过程中,GGPS基因控制异戊烯焦磷酸(IPP)向GGPP转化,其表达量对类胡萝卜素的合成具有重要的正向调节作用[21]。PSY控制GGPP转化为八氢番茄红素,是控制番茄红素合成的一个限速酶基因,对番茄红素的合成至关重要。研究表明,Mn2+是决定GGPS合成类胡萝卜素的关键调控因子,PSY催化八氢番茄红素的形成也依赖Mn2+[22]。本研究发现,外源MnSO4处理提高了西瓜果实GGPS、PSY基因的相对表达量,由此认为,MnSO4处理使番茄红素合成酶相关基因上调表达,增加了番茄红素合成的前体物质,从而加快了番茄红素的合成。
MT能增加番茄果实中番茄红素含量,并且以乙烯依赖方式来促进番茄果实番茄红素的合成,也能显著降低NCED的表达量[23]。本研究结果表明,外源MT处理显著降低了西瓜果实NCED1和NCED7基因的相对表达量。NCED是催化植物ABA合成的关键限速酶基因[24]。NCED活性显著降低会导致番茄成熟过程中正常通道游离ABA的合成前体和代谢物积累部分受阻,从而导致类胡萝卜素途径上游化合物番茄红素和β-胡萝卜素等积累增加[25],这可能是MT影响西瓜果实番茄红素含量的主要原因。
综上所述,3种外源物质均促进了西瓜番茄红素的积累,但其在转录水平的调控机制并不相同,且番茄红素的合成代谢不只受到转录水平的调控。Zhang等[26]研究发现,LCYB的蛋白丰度与番茄红素的积累呈负相关。为了进一步明确这3种外源物质对西瓜番茄红素积累的影响机制,还需要进一步从酶活性、激素调控、转录后调控、蛋白水平、基因等方面进行深入探究。
4 结 论
MnSO4、ABA和MT 3种外源物质均增加了西瓜番茄红素含量,但其在转录水平上的调控机制并不相同。ABA主要通过抑制番茄红素环化酶基因LCYB1和LCYB2的表达,降低番茄红素转化速率,增加番茄红素含量;MnSO4主要通过番茄红素合成酶基因的上调表达,增加番茄红素的合成速率;MT主要通过NCED等基因的大幅下调表达,抑制ABA等代谢物的积累,从而使类胡萝卜素途径产物番茄红素含量增加。本研究结果从栽培管理措施方面为提高西瓜番茄红素含量提供了思路,也为影响西瓜番茄红素的内在机理研究提供了一定的理论基础。

