栀子UGT基因家族UGT86A1和UGT85A2基因克隆与表达模式分析
刘 倩,谷振军,符 潮,2,杨春霞
(1.江西省林业科学院,江西 南昌 330032;2.中南林业科技大学,湖南 长沙 410004)
栀子Gardenia jasminoides是茜草科Rubiaceae植物中的一种传统中药,具有镇痛止血、护肝利胆、消炎消肿等作用,主要产自江西、湖南、四川、重庆等地,种植面积广,产量高[1-2]。栀子果实中的活性成分之一西红花苷是一种能够抗氧化、炎症以及肿瘤的脱辅基类胡萝卜素类化合物[3-4],包括西红花苷I、II、III、IV、V,主要成分为西红花苷I,存在于鸢尾科Iridaceae植物番红花Crocus sativus的柱头和栀子果实中。由于番红花柱头产量极低且价格昂贵,而种植面积广且产量高的栀子果实中的西红花苷含量仅次于番红花柱头,因此,栀子果实有望替代番红花成为生产西红花苷的主要来源。
近年来,栀子西红花苷生物合成途径中的关键基因的克隆与表达模式分析成为热门研究,尤其栀子染色体水平基因组的破译为西红花苷合成生物学研究及栀子分子辅助育种等提供理论支撑。西红花苷在生物体内合成复杂,由多种酶共同催化生成。西红花苷合成的骨架物质为异戊二烯焦磷酸(isopentenyl diphosphate,IPP),而IPP合成则来自质体内的甲基赤藓糖磷酸MEP 途径(Rodríguez-Concepción,2004),1-脱氧木酮糖-5-磷酸合成酶 (DXS)是MEP 途径中的限速酶[5-6]。目前在栀子中已发现一些参与西红花苷合成的相关基因,并研究了乙烯反应元件因子基因(ERF)、八氢番茄红素合成酶基因(PSY)、八氢番茄红素脱饱和酶基因(PDS)、类胡萝卜素剪切双加氧酶基因(CCD4)等关键基因的克隆与表达分析[7-11]。
UDP-葡萄糖基转移酶家族基因(UGT)编码一种葡萄糖醛酸化途径的UDP 葡萄糖醛酸转移酶,负责将尿苷5′-二磷酸葡萄醛酸转移至形成β-d 葡萄糖醛酸的有效底物上[12-13],参与花色苷的生物合成以及调节有机体的生物活性[14-15]。在西红花苷合成途径中,糖基转移酶催化最后一步的合成,即将非亲水性西红花酸催化生成水溶性的西红花苷[16]。有研究表明在栀子果实中发现了两个糖基转移酶 UGT75L6 和UGT94E5 在西红花苷合成中催化糖基化反应[17-18]。最新研究完整解析了西红花苷生物合成途径中GjUGT74F8 和GjUGT94E13共同催化西红花酸合成西红花苷[19],并在此基础上将栀子来源的UGT 整合至大肠杆菌中高效合成西红花苷[20],但对该家族基因的克隆表达及分析却鲜有报道。因此,本研究基于栀子转录组功能注释结果,在栀子中发现UGT家族基因87 个,主要包括GT1、GT3、UGT74F8、UGT94E5-1、UGT94E5-2、UGT709C2、UGT86A1和UGT85A2等基因,从中挑选出2 个差异表达的基因UGT86A1与UGT85A2进行克隆,对其蛋白理化性质、信号肽和亚细胞定位预测、跨膜结构、基因结构、蛋白结构、空间结构以及不同物种中同源性对比进行分析,同时对两个基因进行组织表达特异性分析和西红花苷-1 含量测定,为阐明栀子中西红花苷的合成调控机制奠定理论基础。
1 材料与方法
1.1 试验材料
栀子叶、花、7月果(果皮绿色,果肉白色)、8月果(果皮绿色,果肉浅黄色)、9月果(果皮浅黄色,果肉橘色)以及11月果(果皮红色,果肉橘红色)均采自江西省共青城(29°11′24″N,115°46′48″E),所有材料75%酒精消毒后剪下立即放入液氮中速冻,-80℃保存。
1.2 试验试剂
RNA 提取试剂盒(0416-50 GK 型)购自华越洋生物有限公司,大肠杆菌(trans5α)感受态(CD201)、pEASY®-Blunt Zero Cloning Kit(CB501-01)载体购自北京全式金生物技术有限公司,cDNA 反转录试剂盒(RR420A)、胶回收试剂盒(9762)以及荧光定量PCR试剂盒(RR036A)购自TaKaRa 公司,西红花苷I 对照品(B21337,纯度≥98%)购自西上海源叶生物科技有限公司。
1.3 试验方法
1.3.1 UGT86A1 和UGT85A2 基因克隆
采用华越洋RNA 提取试剂盒提取栀子成熟果实的RNA,利用反转录试剂盒将RNA 反转成cDNA。基于栀子转录组功能注释结果,利用GENSCAN、Pfam 和SMART 得到候选的具有全长开放阅读框(ORF)的UGT86A1与UGT85A2序列,利用Oligo 7 设计出UGT86A1、UGT85A2的ORF克隆引物(表1)进行聚合酶链式反应(PCR)扩增,PCR反应体系为:模板cDNA 50 ng,Primer STAR Max DNA polymerase(2×)25 μL,正向和反向引物(10 μmol/L)各1.0 μL,加灭菌的Milli-Q 水补充至50 μL。PCR 的扩增程序为:98℃10 s,55℃ 5 s,72℃ 10 s,35 个循环;72℃3 min。PCR 扩增产物通过回收纯化后与pEASY®-Blunt Zero Cloning Vector 进行连接,转化至大肠杆菌(trans5α)感受态细胞中,挑取阳性单克隆细胞进行扩繁,经验证后进行测序分析。引物合成由金斯瑞生物科技有限公司完成,序列测定由TaKaRa 公司完成。
1.3.2 生物信息学分析
利用在线工具ExPasy ProtParam(https://web.expasy.org/protparam/)分析栀子UGT86A1 与UGT85A2 蛋白分子质量、氨基酸组成以及等电点等蛋白理化性质。运用SignalP 5.0( http://www.cbs.dtu.dk/services/SignalP/)预测UGT86A1 和UGT85A2 蛋白的信号肽,TMHMM Server v.2.0( http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜区,Cell-PLoc 2.0( http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测亚细胞定位。使用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测UGT86A1 和UGT85A2 蛋白的二级结构,通过Pfam 数据库( http://pfam.xfam.org/)预测蛋白的结构域。采用ClustalX 2.0 软件对UGT86A1、UGT85A2 蛋白进行多重序列对比,随后用MEGA 7.0 软件进行系统进化树的分析。空间结构预测使用SWISS-PDB 在线软件(https://swissmodel.expasy.org/)进行分析。
1.3.3 UGT86A1 和UGT85A2 基因组序列测定
栀子果实DNA 按照CTAB 法进行提取[21],用ORF 框正反引物扩增基因UGT86A1、UGT85A2在栀子基因组上的序列。扩增正确的目的片段经切胶回收、连接T 载体后,在大肠杆菌trans5α中转化,PCR 菌液检测阳性菌落后送测。引物合成由金斯瑞生物科技有限公司完成,序列测定由TaKaRa 公司完成。
1.3.4 荧光定量PCR
分别以栀子的不同组织叶、花、7月果、8月果、9月果以及11月果的cDNA 为模板,对栀子UGT86A1、UGT85A2基因进行实时荧光定量多聚核苷酸链式反应(qRT PCR)检测。用Primer Premier 5 软件设计18S、UGT86A1和UGT85A2的荧光定量引物(表1)。qRT-PCR 使用TB Green®Premix Ex TaqTM试剂盒在CFX96 Real-Time PCR Detection System 仪器上进行测定,每个样品进行3 次重复。反应体系为:TB Green Premix Ex Taq(2×)12.5 μL,正向和反向引物(10 μmol/L)各0.5 μL,DNA 模板2 μL,加灭菌的Milli-Q 水补充至25 μL。反应程序为:95℃ 30 s;95℃ 5 s,60℃30 s,40 个循环,循环结束后通过溶解曲线检测引物的特异性。以18S基因作为内参基因,运用2-△△CT计算基因相对表达量。

表1 栀子克隆和荧光定量引物序列Table 1 Gardenia jasminoides cloning and fluorescent quantitative primer sequence
1.3.5 西红花苷含量测定
采用高效液相色谱法(HPLC)测定栀子不同部位及不同发育阶段果实的西红花苷-I 含量。取栀子药材粉末约0.35 g,精密称定,分别置100 mL容量瓶中,用50%乙醇定容,超声提取30 min,放冷,经0.45 mm 微孔滤膜,滤液即为供试品溶液。色谱条件:岛津LC-20AT HPLC,岛津ODS 柱(150 mm×4.6 mm,5 μm),流动相为乙腈(A):1%乙酸水(B)梯度洗脱,流速1.0 mL/min,检测波长440 nm,进样量20 μL,柱温30℃。
2 结果与分析
2.1 栀子UGT86A1、UGT85A2 基因克隆及序列分析
以UGT86A1、UGT85A2基因的ORF 框特异性引物,以栀子成熟果实cDNA 为模板,PCR扩增分别获得987、1 446 bp 的目的基因片段,推导其编码的氨基酸数目分别为328 和481 个。UGT86A1 蛋白中含量最高的氨基酸为丝氨酸(Ser),占总氨基酸的9.8%,带负电残基总数,即天冬氨酸(Asp)和谷氨酸(Glu)数量之和为39 个,带正电荷的残基总数,即精氨酸(Arg)和赖氨酸(Lys)数量之和为30 个;而UGT85A2蛋白中含量最高的氨基酸为异亮氨酸,占总氨基酸的12.5%,带负电残基总数为60 个,带正电荷的残基总数为43 个。通过分析预测UGT86A1 和UGT85A2 蛋白分子质量(MW)分别约为36.6和53.5 kD,理论等电点(pI)分别为5.23 和5.06,脂溶指数(Aliphatic index)分别为99.48和91.23。UGT86A1 和UGT85A2 蛋白的原子组成均有C、H、N、O、S,UGT86A1 蛋白的原子总数是5 156,为C1648H2578N432O485S13;UGT85A2蛋白的原子总数是7 518,为C2411H3758N614O712S23。UGT86A1 不稳定性指数(II)为35.65,据此将该蛋白归类为稳定蛋白;UGT85A2 蛋白不稳定性指数(II)为45.22,据此将该蛋白归类为不稳定蛋白。UGT86A1 和UGT85A2 蛋白总平均亲水性(GRAVY)分别为0.047 和-0.130,预测UGT86A1 蛋白为疏水性蛋白,UGT85A2 蛋白为亲水性蛋白。
SignalP 5.0 预测栀子UGT85A2 蛋白无信号肽,UGT86A1 氨基酸序列的N 端具有信号肽酶切位点,切割位点位于18 和19 位氨基酸之间(图1)。TMHMM Server v.2.0 预测UGT86A1 与UGT85A2 均无跨膜结构。根据Cell-PLoc 2.0 预测显示,UGT86A1 与UGT85A2 蛋白均为叶绿体蛋白。使用SOPMA 在线软件预测UDPG14 蛋白的二级结构,结果显示UGT86A1与UGT85A2α 螺旋(Alpha helix)结构分别占41.77%和43.04%,延伸链(Extended strand)结构分别占13.11%和15.59%,β 转角(Beta turn)结构分别占7.01%和7.07%,无规则卷曲(Random coil)结构分别占38.11%和34.30%。使用SWISS-PDB 在线软件预测栀子UGT86A1、UGT85A2 蛋白空间结构(图2),UGT86A1 建模蛋白与模板序列相似度为32.52,而UGT85A2 建模蛋白与模板序列相似度为58.53,推测UGT85A2 蛋白同源建模更具参考意义。

图1 UGT86A1 蛋白信号肽预测Fig.1 Prediction of signal peptide of UGT86A1 protein

图2 栀子UGT86A1、UGT85A2 蛋白空间结构预测Fig.2 Prediction of spatial structure of UGT86A1 and UGT85A2 proteins in Gardenia jasminoides
2.2 UGT86A1、UGT85A2 序列对比及进化树构建
通过BlastP 检索发现,栀子UGT86A1 蛋白与同为茜草科的中粒咖啡Coffea canephora(CDP18343.1)、小粒咖啡Coffea arabica(XP_027107200.1)序列相似度高达92%~93%,与同源UGT75L6 和UGT74F8 序列相似性在85%左右,与不同科属的蓝果树Nyssa sinensis(KAA8518730.1)、林烟草Nicotiana sylvestris(XP_009802698.1)、野生烟草Nicotiana attenuata(XP_019250687.1)、绒毛状烟草Nicotiana tomentosiformis(XP_009610181.1) 的序列相似度也在75%以上,与同源UGT94E13相似度为74%; 栀子UGT85A2 蛋白与同源UGT75L6、UGT74F8 序列相似度高达97%,与UGT94E13、UGT94E5 序列相似度为92%,与茜草科的欧基尼奥伊德斯种咖啡Coffea eugenioides(XP_027149647)、小粒咖啡Coffea arabica(XP_027094782.1)、中粒咖啡Coffea canephora(CDP01076.1)的相似度高达90%以上,与茄科的宁夏枸杞Lycium barbarum(BAG80542.1)、野生烟草Nicotiana attenuata(XP_019225689.1)、夹竹桃科的长春花Catharanthus roseus(F8WLS6.1)等物种相似度也在74%以上。采用ClustalX 2.0 软件对这些物种的氨基酸序列进行多重序列对比分析,发现UGT86A1 蛋白在91~286 位氨基酸区域和UGT85A2 蛋白在207~448 位氨基酸区域均存在一个保守UDPGT 结构域,且UDPGT 蛋白在这些物种中高度保守(图3)。

图3 栀子UGT86A1 和UGT85A2 蛋白的氨基酸序列分析Fig.3 Amino acid sequence analysis of UGT86A1 and UGT85A2 protein from Gardenia jasminoides

续图3Continuation of Fig.3
利用MEGA 7.0 软件的邻接法(Neighbor joining,NJ)对这些氨基酸序列进行系统进化树分析(图4),发现这些植物的UDPGT 蛋白具有共同的进化源,由两个大的进化枝组成,UGT94E13和UGT94E5 组成第一个进化枝。第二个大进化枝由两个小分支构成,UGT75L6 和UGT74F8 构成一个小分支,在另一个小分支中,栀子UGT86A1蛋白与中粒咖啡、小粒咖啡、蓝果树、林烟草、野生烟草、绒毛状烟草属于同一分支,栀子UGT85A2 蛋白与欧基尼奥伊德斯种咖啡、小粒咖啡、中粒咖啡、宁夏枸杞、野生烟草和长春花属于另一分支。在亲缘关系上,栀子UGT86A1 蛋白与中粒咖啡、小粒咖啡关系最近;UGT85A2 蛋白也与同属茜草科的欧基尼奥伊德斯种咖啡、小粒咖啡以及中粒咖啡关系最近。

图4 UDPGT 在不同物种中的系统进化分析Fig.4 Phylogenetic analysis of UDPGT in different species
2.3 UGT86A1、UGT85A2 基因结构分析
以栀子成熟果实DNA 为模板,PCR 扩增分别获得987 和1 657 bp 的目的基因片段。通过将UGT86A1、UGT85A2ORF 框cDNA 序列与基因组序列进行Blast 序列对比,显示UGT86A1基因不含内含子(图5A),而UGT85A2基因含有两个外显子一个内含子(图5B)。
2.4 UGT86A1、UGT85A2 基因的qRT-PCR 表达分析
运用qRT-PCR 技术对UGT86A1与UGT85A2基因在栀子不同部位及不同发育阶段果实的表达情况进行定量分析(图6)。结果表明:UGT86A1与UGT85A2在栀子叶和花中均有表达,且在叶中表达量较高;UGT86A1在栀子发育的不同阶段大致呈现递减式表达,即UGT86A1基因的表达量随着栀子果实不断发育成熟而降低,而UGT85A2在栀子果实不同发育阶段则呈递增式表达,即栀子果实的UGT85A2表达量随着果实的不断成熟而增加,并且11月果的表达量远高于其他阶段果实的表达量。
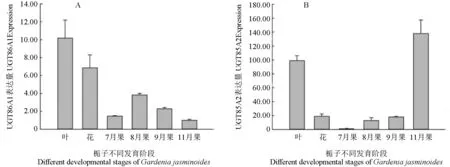
图6 栀子不同发育阶段的UGT86A1 和UGT85A2 表达量Fig.6 Expression of UGT86A1 and UGT85A2 in Gardenia jasminoides at different developmental stages
2.5 UGT86A1、UGT85A2 基因表达量与西红花苷I 含量的相关性分析
运用HPLC 法对栀子中不同部位及不同发育阶段果实的西红花苷Ⅰ含量进行分析测定(图7A),并运用SPSS 分别对西红花苷含量与UGT86A1和UGT85A2表达相关性进行分析(图7B)。结果表明,在栀子叶和花中检测不到西红花苷Ⅰ,而在栀子不同发育阶段中西红花苷含量则随着果实不断发育成熟而增加,在采摘期(11月初)含量达到最高。相关性结果分析表明栀子果实中西红花苷含量的增加趋势与UGT85A2基因表达呈现不显著正相关(相关系数为0.128),表明UGT85A2对西红花苷合成可能具有促进作用,但不关键,提示下一步应该从候选基因中进一步筛选关键正调控基因。西红花苷含量与UGT86A1基因的表达量呈显著负相关(相关系数为-0.69),表明UGT86A1对西红花苷合成可能具有负调控作用,下一步将通过遗传转化体系进行功能验证。

图7 UGT86A1、UGT85A2 基因表达与西红花苷含量的相关性分析Fig.7 Correlation analysis of UGT86A1,UGT85A2 gene expression and crocin content
3 结论与讨论
西红花苷是栀子的有效活性成分之一,其含量的差异性是衡量栀子是否能够作为地道中药材的关键性评价指标。西红花苷合成关键基因及通路的研究是栀子进一步深入研究的关注点。众多相关研究认为UGT基因家族是控制栀子西红花苷合成的重要基因家族之一。因此,本研究对UGT基因家族中UGT86A1与UGT85A2的克隆表达模式进行分析,并对其所控制合成的蛋白结构及亲源性关系进行预测,结果表明UGT86A1与UGT85A2基因编码的蛋白均与同为茜草科植物的中粒咖啡、小粒咖啡亲缘关系最近,这一点基本与茜草科植物遗传背景与进化关系保持一致。
其次,UGT是膜结合酶超家族,其糖基化调控机制在植物激素平衡、胁迫防御反应及次生代谢产物修饰等方面发挥重要作用[13]。大部分的植物激素及植物花果中类黄酮、类胡萝卜素等物质的合成与积累均需要糖基转移酶的参与[22]。如最常见的类黄酮3-O-葡萄糖基转移酶(3GT)能够催化葡萄糖糖基化取代花色素3-OH 基团,使花色素合成为各种花色苷[13];也有相关研究表明UGT73B6,UGT72B14等UGT基因家族通过控制合成尿苷二磷酸葡萄糖基转移酶,在红景天苷合成途径中发挥关键作用[23]。UGT基因的表达存在正负调控作用,相关研究表明,sgUDPG1基因对罗汉果甜苷的合成具有正调控作用[24],海荪鸢尾在镉胁迫下部分UGT基因会出现负调控作用[13]。西红花苷作为植物次生代谢物中的一种类胡萝卜素,其合成积累同样需要糖基转移酶的参与。Dufresne 等[25]与Cote 等[26]研究发现并证实番红花中两个糖基转移酶GTase1 和GTase2 能够催化西红花酸生成西红花苷。栀子基因组完整解析了GjUGT74F8 和GjUGT94E13 共同催化西红花酸合成西红花苷[19],进一步证实了UGT基因家族在西红花苷合成途径中发挥了关键作用。
栀子基因组的破译为栀子西红花苷合成关键基因的挖掘与合成通路的研究提供了基础,但UGT基因家族中众多基因的作用与西红花苷合成的关联性亟需进一步分析验证。相关研究表明,在栀子果实中有两个糖基转移酶UGT75L6 和UGT94E5 在西红花苷合成中催化糖基化反应,但结果表明其基因的表达与西红花苷积累并无相关性[17-18]。而本研究结果表明栀子UGT85A2 的表达西红花苷含量积累无显著相关,而UGT86A1 的表达与栀子果实中西红花苷的积累具有显著负相关性。因此,推测UGT86A1在栀子西红花苷合成中发挥负向调控作用。这一点为解析UGT基因家族参与调控西红花苷合成的相关研究提供了新的思路与证据。由于栀子本体遗传转化体系的构建具有局限性,下一步将研究这两个基因在烟草、拟南芥中的遗传表达及其亚细胞定位分析等,最终阐明其在栀子中的生物学功能及其调控机制。

