白屈菜碱对四氯化碳诱导肝纤维化模型大鼠的改善作用及机制
李晓明 王文豹 郭丽娜 宋波 董巍 徐天娇 王晓丽






中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2021)23-2868-07
DOI 10.6039/j.issn.1001-0408.2021.23.09
摘 要 目的:研究白屈菜碱对四氯化碳诱导肝纤维化模型大鼠的改善作用及可能机制。方法:将48只大鼠按随机数字表法随机分成正常对照组,模型组,白屈菜碱低、中、高剂量组(0.125、0.25、0.50 mg/kg)和阳性对照组(护肝片,0.42 g/kg),每组8只。除正常对照组外,其余各组大鼠均采用腹腔注射四氯化碳-橄榄油溶液8周建立肝纤维化模型。于造模第5周开始,正常对照组和模型组大鼠灌胃水,各给药组大鼠灌胃相应药液,每天1次,连续10周。末次灌胃后,计算大鼠肝指数;测定大鼠血清中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、透明质酸(HA)和肝组织中羟脯氨酸(Hyp)水平;观察大鼠肝组织中胶原纤维蛋白染色情况;测定大鼠肝组织中α-平滑肌肌动蛋白(α-SMA)、微管相关蛋白1轻链3(LC3)、p62蛋白表达水平和磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(Akt)、哺乳动物雷帕霉素靶蛋白(mTOR)的磷酸化水平,以及上述蛋白对应的mRNA表达水平。结果:与正常对照组比较,模型组大鼠肝指数,血清中AST、ALT、HA、Hyp水平,肝组织中胶原纤维蛋白阳性染色面积百分比和α-SMA、LC3-Ⅱ的mRNA及其蛋白表达水平均显著升高(P<0.05);p62蛋白表达水平,PI3K、Akt、mTOR的蛋白磷酸化水平以及p62、PI3K、Akt、mTOR mRNA表达水平均显著降低(P<0.05)。与模型组比较,白屈菜碱低剂量组大鼠PI3K、mTOR的蛋白磷酸化水平均显著降低(P<0.05);白屈菜碱中、高剂量组上述指标(除中剂量组肝指数、HA水平外)的变化均被显著逆转(P<0.05)。结论:白屈菜碱对四氯化碳所致大鼠肝纤维化具有一定的改善作用;其机制可能与激活PI3K/Akt/mTOR信号通路、抑制细胞自噬有关。
关键词 白屈菜碱;肝纤维化;磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路;自噬
Improvement Effects of Chelidonine on CCl4-induced Hepatic Fibrosis Model Rats and Its Mechanism
LI Xiaoming1,WANG Wenbao2,GUO Lina2,SONG Bo2,DONG Wei2,XU Tianjiao1,WANG Xiaoli2(1. Institute of Medicine, Qiqihar Medical College, Heilongjiang Qiqihar 161006, China; 2. School of Pharmacy, Qiqihar Medical College, Heilongjiang Qiqihar 161006, China)
ABSTRACT OBJECTIVE: To study the improvement effects and potential mechanism of chelidonine on CCl4-induced hepatic fibrosis model rats. METHODS: According to the random number table method, a total of 48 rats were randomly divided into normal control group, model group, chelidonine low-dose, middle-dose and high-dose groups (0.125, 0.25, 0.50 mg/kg), positive control group (Liver-protecting tablet,0.42 g/kg), with 8 rats in each group. Except for normal control group, other groups were given CCl4-olive oil solution intraperitoneally for 8 weeks to induce hepatic fibrosis model. From the fifth week of modeling, normal control group and model group were given water intragastrically; administration groups were given relevant medicine intragastrically, once a day, for consecutive 10 weeks. After last intragastric administration, hepatic index of rats was calculated. The levels of aspartate aminotransferase (AST), alanine aminotransferase (ALT) and hyaluronic acid (HA) in serum and the level of hydroxyproline (Hyp) in liver tissue were determined. The staining of collagen fibrin in rat liver was observed. The protein expression of α-smooth muscle actin (α-SMA),microtubule-associated protein 1 light chain 3 (LC3) and p62 as well as the phosphorylation level of phosphoinositide 3 kinase (PI3K),protein kinase B (Akt) and mammalian target of rapamycin (mTOR) in liver tissue were determined; mRNA expression corresponding to above protein were also determined. RESULTS: Compared with normal control group, the hepatic index, the serum levels of AST, ALT, HA and Hyp, the percentage of positive staining area for collagen fibrin, the mRNA and protein expression of α-SMA and LC3-Ⅱ were increased significantly (P<0.05). Protein expression of p62, phosphorylation levels of PI3K, Akt and mTOR as well as mRNA expression of p62, PI3K, Akt and mTOR were significantly down-regulated (P<0.05). Compared with model group, phosphorylation levels of PI3K and mTOR were decreased significantly in chelidonine low-dose group (P<0.05). The changes of above indexes in chelidonine middle-dose and high-dose groups (except for liver index, HA level in middle-dose group) were reversed significantly (P<0.05). CONCLUSIONS: Chelidonine can attenuate CCl4-induced liver fibrosis in rats; the mechanism of it may be associated with activating PI3K/Akt/mTOR signaling pathway and inhibiting autophagy.
KEYWORDS Chelidonine; Hepatic fibrosis; PI3K/Akt/mTOR signaling pathway; Autophagy
肝纤维化是由多种原因导致的急性或慢性肝病的共同病理过程,如病毒性肝炎、酒精肝、脂肪肝以及自身免疫性疾病等均可引起肝组织细胞外基质(ECM)过度沉积,最终导致肝纤维化[1-2]。肝纤维化是一个动态发展的过程,当肝脏受到损伤时,会刺激肝星状细胞(HSC)活化,进而分泌α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白和纤维连接蛋白等ECM,加快肝纤维化进程,甚至会发展成为肝硬化-肝细胞癌;若肝脏在发生纤维化时经过积极治疗,可终止或逆转肝纤维化的病理学改变[3-4]。细胞自噬是通过自我消化受损的细胞器等来维持细胞内、外环境的稳定,可为HSC提供能量,促进HSC的活化、增殖,进而促进肝纤维化的发展[5]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)在肝纤维化的进程中扮演着重要角色,其中mTOR是PI3K和Akt下游的重要靶点,同时也是自噬的关键负调节因子,因此可通过PI3K/Akt/mTOR信号通路来调节细胞自噬[6]。
白屈菜为罂粟科白屈菜属多年生草本植物白屈菜Chelidonium majus L.的全草,味苦,性凉,有小毒,归肺、心、肾经,具有镇痛、止咳、平喘、消肿之功效[7]。白屈菜碱是中药白屈菜中的主要活性成分之一[8]。现代药理学研究表明,白屈菜碱具有抗纤维化、抗炎、抗肿瘤、抗菌、镇痛、解痉等多种药理作用[9],尤其是其抗纤维化、抗肿瘤作用,近年受到了越来越多学者的关注。相关研究显示,白屈菜碱可调节丙氨酸转氨酶(ALT)等肝酶活性,抑制大鼠肝纤维化[10]。本课题组前期研究也表明,白屈菜碱对活化的大鼠HSC——CFSC-8B细胞的增殖和细胞中的胶原合成具有抑制作用[11]。但目前关于白屈菜碱抗肝纤维化的作用机制尚未完全阐明。鉴于此,本研究拟以四氯化碳(CCl4)诱导建立大鼠肝纤维化模型,探讨白屈菜碱的抗肝纤维化作用及其对PI3K/Akt/mTOR信号通路和自噬的调控作用,为进一步阐明白屈菜碱抗肝纤维化的作用机制提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有Stratagene Mx3005P型实时荧光定量聚合酶链式反应(PCR)仪(美国Agilent公司),JY-ZY2型转移电泳槽、JY-CZ1型单垂直电泳槽(北京君意东方电泳设备有限公司)、CKX41型倒置显微镜(日本Olympus公司)、SmartChemiTM Ⅱ型一体式化学发光图像分析系统(北京赛智创业科技有限公司)、ELX800型全自动酶标仪(美国Bio Tek公司)、XPE504型分析天平(瑞士Mettler-Toledo公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂包括:白屈菜碱对照品(中国食品药品检定研究院,批号18041303,纯度≥98%),护肝片(黑龙江葵花药业股份有限公司,批号201609128,规格为每片0.35 g),苦味酸-酸性品红(VG)染色试剂盒、BCA蛋白定量试剂盒(北京索莱宝科技有限公司,批号分别为20161121、20160519),透明质酸(HA)检测试剂盒(武汉默沙克生物科技有限公司,批号201709),肝组织羟脯氨酸(Hyp)检测试剂盒、ALT检测试剂盒、天冬氨酸转氨酶(AST)检测试剂盒、兔抗鼠p62多克隆抗体(南京建成生物工程研究所,批号分别为20180103、20171220、20171216、20200113),PrimeScript RT Reagent Kit反转录试剂盒[宝生物工程(大连)有限公司,批号AJ10935A],细胞核蛋白与细胞浆蛋白抽提试剂盒、兔抗鼠Akt多克隆抗体、兔抗鼠磷酸化Akt(p-Akt)多克隆抗体(上海碧云天生物技术有限公司,批号分别为052720200827、033018200921、033018200921),TRIzol试剂(美国Ambion公司,批号229009),兔抗鼠微管相关蛋白1轻链3(LC3)多克隆抗体(美国Abcam公司,批号GR219724-1),兔抗鼠α-SMA多克隆抗体、兔抗鼠PI3K多克隆抗体、兔抗鼠磷酸化PI3K(p-PI3K)多克隆抗体、兔抗鼠mTOR多克隆抗体、兔抗鼠磷酸化TOR(p-mTOR)多克隆抗体、兔抗鼠3-磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(美国Cell Signaling公司,批号分别为19245、4257、4228、2983、2974、2118S),生物素標记的山羊抗兔免疫球蛋白G(IgG)二抗、ECL超敏发光检测试剂盒(北京康为世纪生物科技有限公司,批号分别为00051405、40532),欧丽薇兰橄榄油(益海嘉里食品营销有限公司,批号F20160814);PCR实验中引物均由生工生物工程(上海)股份有限公司合成;其余试剂均为分析纯,水为自制双蒸水。
1.3 动物
本研究所用动物为SPF级雄性Wistar大鼠,共48只,5~6周龄,体质量为(180±10) g,由齐齐哈尔医学院动物实验中心提供,动物生产许可证号为SCXK(黑)- 2016-001。全部大鼠饲养于SPF级动物实验室中,实验室温度为20~25 ℃,12 h照明/12 h黑暗交替。大鼠饲养期间常规进食、饮水,适应性饲养1周后进行正式实验。
2 方法
2.1 分组、造模与给药
将48只大鼠按随机数字表法随机分为正常对照组,模型组,白屈菜碱低、中、高剂量组(0.125、0.25、0.50 mg/kg,剂量根据前期预实验结果设定)和阳性对照组 (护肝片,0.42 g/kg[12]),每组8只。除正常对照组外,其余各组大鼠均采用腹腔注射CCl4-橄榄油溶液诱导建立肝纤维化模型(造模前禁食12 h)。本研究所用的造模方法是在文献[13]的基础上加以改进后得到,具体为:造模大鼠首次按8 mL/kg的剂量腹腔注射50%CCl4-橄榄油溶液,之后均继续以5 mL/kg的剂量注射,每3天1次,持续8周。于造模第5周开始,各给药组大鼠灌胃相应药物(均以水溶解),正常对照组和模型组大鼠灌胃水,灌胃体积均为1 mL,每天1次,连续10周。
2.2 样本采集与处理
于第14周末次灌胃后,大鼠禁食不禁水24 h,称其体质量后以乙醚麻醉,于股动脉取血。将血液以3 000 r/min离心5 min,收集上层血清,备用。将大鼠处死,摘取其肝组织并称定质量,然后于冰盒上取一小块肝组织并置于4%甲醛溶液中固定24 h,用于病理组织学检查;将一部分肝组织置于液氮中快速冻存,用于Western blot和PCR实验相关指标检测;剩余肝组织直接用于Hyp水平测定。
2.3 肝指数测定
根据大鼠体质量和肝组织质量计算大鼠肝指数:肝指数(%)=肝组织质量/体质量×100%。
2.4 血清中AST、ALT和HA水平测定
取“2.2”项下血清适量,分别按相应试剂盒说明书方法操作,测定大鼠血清中AST、ALT和HA水平。
2.5 肝组织中Hyp水平测定
取“2.2”项下肝组织,参照文献[14]方法进行处理后,按相应试剂盒说明书方法操作,测定大鼠肝组织中Hyp水平。
2.6 肝组织中胶原纤维蛋白表达情况观察
取“2.2”项下于甲醛溶液中固定24 h后的肝组织,常规制备石蜡切片(厚度约3 μm),经二甲苯及梯度乙醇脱蜡至水后,按照VG染色试剂盒说明书方法对切片进行染色(VG阳性染色呈鲜红色)。将切片置于倒置显微镜下观察、拍照,利用Image-Pro Plus 6.0软件计算胶原纤维蛋白阳性染色面积和染色总面积,并计算胶原纤维蛋白阳性染色面积百分比(胶原纤维蛋白阳性染色面积/染色总面积×100%)。结果处理时,以正常对照组数据为标准(100%)计算其余各组结果的相对值。
2.7 肝组织中α-SMA、LC3-Ⅱ、p62的蛋白表达水平和PI3K、Akt、mTOR的蛋白磷酸化水平测定
采用Western blot法进行测定。取“2.2”项下冻存的肝组织,于冰上常规解冻后,按细胞核蛋白与细胞浆蛋白抽提试剂盒说明书方法提取肝组织中的总蛋白。采用BCA法测定总蛋白浓度后,煮沸5 min使其变性。取变性后的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(浓缩胶电压75 V、电泳时间30 min,分离胶电压110 V、电泳时间90 min),然后电转至硝酸纤维素膜上(电流350 mA,转膜时间2 h),加入含5%脱脂奶粉的TBST溶液,于4 ℃封闭过夜;分别加入α-SMA、LC3、p62、p-PI3K、PI3K、p-Akt、Akt、p-mTOR、mTOR、GAPGH一抗(稀释比例均为1 ∶ 1 000),于37 ℃孵育4 h;以TBST洗膜3次、每次10 min,然后加入生物素标记的IgG二抗(稀释比例1 ∶ 1 000),于37 ℃孵育2 h;以TBST洗膜3次、每次10 min,然后加入ECL荧光检测剂,采用一体式化学发光图像分析系统测定各蛋白条带的灰度值。以α-SMA、LC3-Ⅱ、p62与内参GAPDH的蛋白条带灰度值的比值表示这3种蛋白的表达水平,以p-PI3K与PI3K、p-Akt与Akt、p-mTOR与mTOR的蛋白条带灰度值的比值表示这3种蛋白的磷酸化水平。
2.8 肝组织中α-SMA、LC3-Ⅱ、p62、PI3K、Akt、mTOR的mRNA表达水平测定
采用实时荧光定量PCR法进行测定。取“2.2”项下冻存的肝组织,于冰上常规解冻后,采用TRIzol试剂提取肝组织中总RNA,然后按反轉录试剂盒说明书方法反转录合成cDNA,并以cDNA为模板进行PCR扩增(引物序列及扩增产物片段长度见表1)。PCR反应体系为:cDNA模板2 μL,dNTP溶液1.6 μL,上、下游引物各0.8 μL, BeyoTaq Buffer 2 μL,BeyoTaq DNA Polymerase 0.1 μL,加双蒸水至总体积为20 μL。PCR反应条件为:95 ℃预变性4 min;95 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。最后进行溶解曲线分析。以GAPDH为内参,采用2-ΔΔCt法计算肝组织中α-SMA、LC3、p62、PI3K、Akt、mTOR的mRNA表达水平(公式中Ct表示每个反应管内荧光信号强度达到设定阈值时所经历的循环次数),并以正常对照组数据为标准(1.00)计算其余各组结果的相对值。
2.9 统计学方法
采用SPSS 13.0软件进行统计分析。实验数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK检验。检验水准α=0.05。
3 结果
3.1 大鼠肝指数和血清中AST、ALT、HA水平
与正常对照组比较,模型组大鼠肝指数和血清中AST、ALT、HA水平均显著升高(P<0.05)。与模型组比较,白屈菜碱中剂量组大鼠血清中AST、ALT水平均显著降低(P<0.05);白屈菜碱高剂量组和阳性对照组大鼠肝指数和血清中AST、ALT、HA水平均显著降低(P<0.05)。各组大鼠肝指数和血清中AST、ALT、HA水平测定结果见表2。
3.2 大鼠肝组织中Hyp水平
与正常对照组比较,模型组大鼠肝组织中Hyp水平显著升高(P<0.05)。与模型组比较,白屈菜碱中、高剂量组和阳性对照组大鼠肝组织中Hyp水平均显著降低(P<0.05)。各组大鼠肝组织中Hyp水平测定结果见表3。
3.3 大鼠肝组织中纤维蛋白染色情况
正常对照组大鼠肝组织结构正常,汇管区及中央静脉周围无纤维增生。模型组大鼠肝组织汇管区扩大,胶原纤维大量增生。与模型组比较,各给药组大鼠肝组织汇管区不同程度地缩小,胶原沉积不同程度地减少;其中白屈菜碱高剂量组和阳性对照组大鼠肝组织汇管区及中央静脉周围仅有极少量的胶原沉积。与正常对照组比较,模型组大鼠肝组织中胶原纤维蛋白阳性染色面积百分比显著升高(P<0.05);与模型组比较,白屈菜碱中、高剂量组和阳性对照组大鼠肝组织中胶原纤维蛋白阳性染色面积百分比均显著降低(P<0.05) 。各组大鼠肝组织中胶原纤维蛋白染色显微图见图1,胶原纤维蛋白阳性染色面积百分比测定结果见表3。
3.4 大鼠肝组织中α-SMA、LC3-Ⅱ、p62蛋白表达水平和PI3K/Akt/mTOR信号通路相关蛋白磷酸化水平
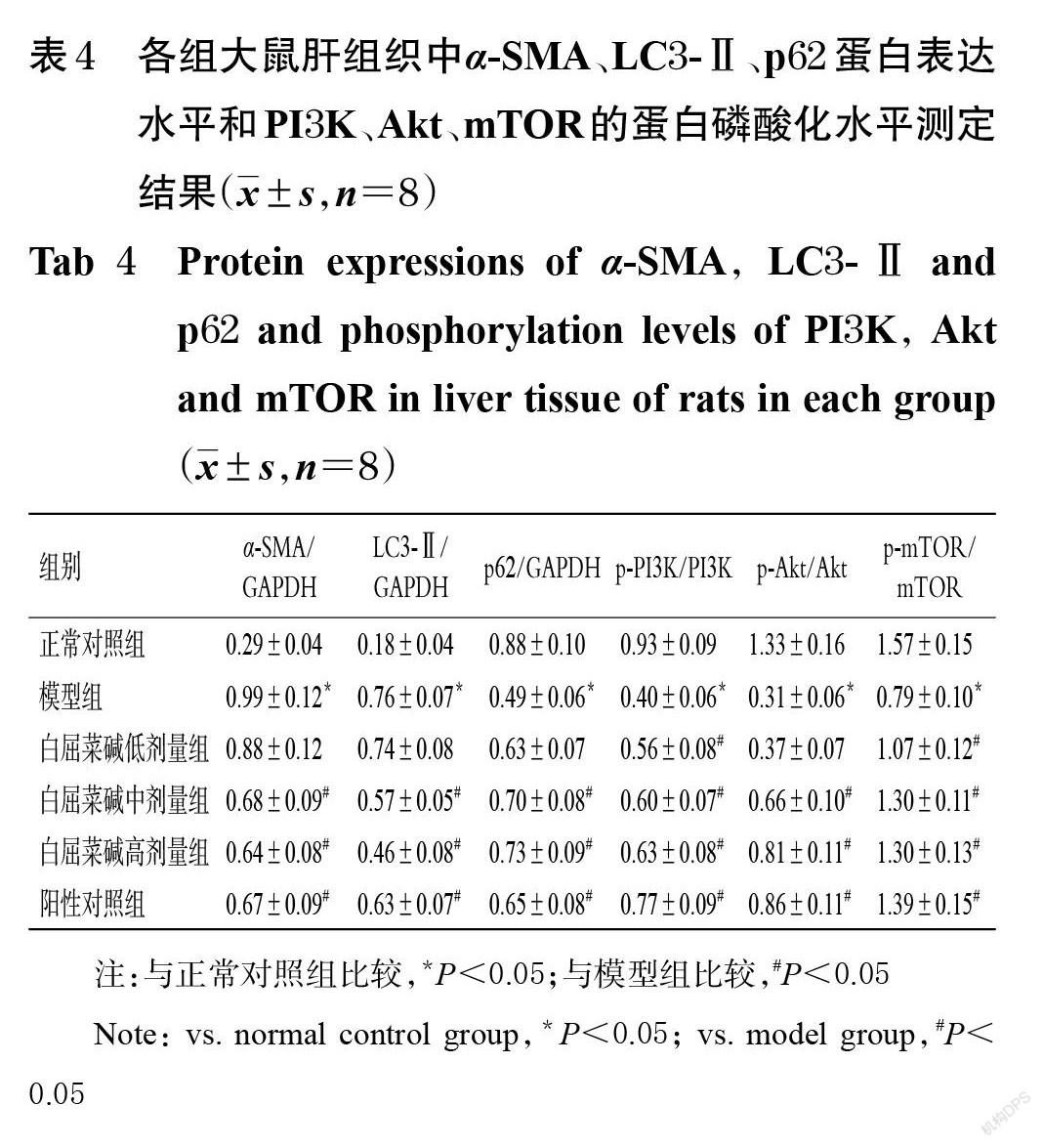
与正常对照组比较,模型组大鼠肝组织中α-SMA、LC3-Ⅱ蛋白表达水平均显著升高(P<0.05),p62蛋白表达水平和PI3K、Akt、mTOR的蛋白磷酸化水平均显著降低(P<0.05)。与模型组比较,白屈菜碱低剂量组大鼠肝组织中PI3K、mTOR的蛋白磷酸化水平均显著升高(P<0.05) ;白屈菜碱中、高剂量组和阳性对照组大鼠肝组织中α-SMA、LC3-Ⅱ蛋白表达水平均显著降低(P<0.05),p62蛋白表达水平和PI3K、Akt、mTOR的蛋白磷酸化水平均显著升高(P<0.05)。各组大鼠肝组织中α-SMA、LC3-Ⅱ、p62和PI3K/Akt/mTOR信号通路相关蛋白表达的电泳图见图2,蛋白表达水平或磷酸化水平测定结果见表4。
3.5 大鼠肝组织中α-SMA、LC3、p62和PI3K/Akt/mTOR信号通路相关基因mRNA表达水平
与正常对照组比较,模型组大鼠肝组织中α-SMA、LC3 mRNA表达水平均显著升高(P<0.05),p62、PI3K、Akt、mTOR mRNA表达水平均显著降低(P<0.05)。与模型组比较,白屈菜碱中、高剂量组和阳性对照组大鼠肝组织中α-SMA、LC3 mRNA表达水平均显著降低(P<0.05),p62、PI3K、Akt、mTOR mRNA表达水平均显著升高(P<0.05)。各组大鼠肝组织中α-SMA、LC3、p62和PI3K/Akt/mTOR信号通路相关基因mRNA表达水平测定结果见表5。
4 讨论
CCl4进入体内后,可在肝脏中生成三氯甲基自由基和氯自由基,进而溶解肝细胞膜,使肝细胞中大量肝内酶(AST、ALT等)渗入血液,造成肝损伤和肝纤维化[15]。因此,本研究选择腹腔注射CCl4-橄榄油溶液来建立大鼠肝纤维化模型。护肝片具有保护肝损伤的作用,在肝损伤相关研究中常用作阳性对照药物进行对照观察[16-17]。
血清中肝内酶(AST、ALT)水平是评价肝损伤和肝纤维化程度的重要指标,轻度的肝细胞损伤即可使血液中肝内酶的浓度增加数倍[18]。肝损伤后会导致组织中HSC激活并合成α-SMA,产生大量以胶原蛋白为主的ECM沉积。Hyp是胶原蛋白特有的氨基酸,HA是ECM中糖胺聚糖的主要成分,随着ECM的不断沉积,肝组织中Hyp、HA含量也随之增加,因此检测肝组织中α-SMA、Hyp、HA水平对于判断肝组织损伤和肝纤维化程度具有重要意义[19]。本研究结果显示,模型组大鼠肝指数和血清中AST、ALT水平以及肝组织中α-SMA、Hyp、HA水平较正常对照组均显著升高,肝组织纤维化明显,表明肝纤维化大鼠模型制备成功。当给予不同剂量白屈菜碱处理后,大鼠肝指数和血清中AST、ALT水平以及肝组织中α-SMA(mRNA及其蛋白表达)、Hyp、HA水平较模型组均不同程度地降低,肝组织纤维化程度减轻,说明白屈菜碱对CCl4诱导的大鼠肝纤维化损伤具有较好的改善作用。
肝内自噬是肝细胞对自身结构蛋白及细胞器进行降解的一种方式,在肝纤维化损伤中具有重要作用[20-21]。自噬可以通过分解、减少脂滴而促进HSC活化[22]。Thoen等[23]用3-甲基腺嘌呤抑制HSC自噬时,细胞内脂滴的数量和体积明显增加、脂肪酸合成明显减弱,HSC的活化受到抑制。上述结果提示,通过调节细胞自噬,可抑制HSC活化,进而抑制肝纤维化。自噬相关蛋白LC3在自噬小体的形成中具有重要作用,是细胞自噬的特异性标志物[24]。LC3可分为Ⅰ型(LC3-Ⅰ)和Ⅱ型(LC3-Ⅱ),当自噬发生时,LC3于细胞质内转变为可溶性LC3-Ⅰ;LC3-Ⅰ被自噬相关蛋白Atg7识别并活化后,再经泛素化加工修饰生成LC3-Ⅱ——LC3-Ⅱ的表达水平与自噬体数量成正比,且LC3-Ⅱ在自噬过程的晚期阶段表达,因此常作为反映自噬强度的指标[25]。p62蛋白作为自噬降解的底物之一,也是反映自噬水平的重要指标[26]。本研究结果显示,给予不同剂量白屈菜碱处理后,肝纤维化模型大鼠肝组织中LC3 mRNA及其蛋白的表达水平均不同程度地降低,p62 mRNA及其蛋白的表达水平均不同程度地升高,提示白屈菜碱能够对肝内自噬产生影响。
PI3K/Akt/mTOR信号通路在自噬过程中起到关键的调节作用,其中PI3K是一种存在于细胞质中的复合体,是该信号通路的重要组成部分[27]。激活的PI3K(即p-PI3K)会将磷脂酰肌醇二磷酸(PIP2)磷酸化为磷脂酰肌醇三磷酸(PIP3),PIP3再将目标蛋白Akt募集到细胞膜上,进而磷酸化激活Akt分子;激活后的Akt分子再磷酸化激活下游的mTOR;而mTOR是抑制自噬过程的关键蛋白,可阻碍自噬小体的形成,进而抑制细胞自噬[28]。本研究结果显示,给予不同剂量白屈菜碱处理后,肝纤维化模型大鼠肝组织中PI3K、Akt、mTOR的蛋白磷酸化水平及相应基因的mRNA表达水平均不同程度地升高。这表明白屈菜碱能够调节PI3K/Akt/mTOR通路相关基因mRNA及其蛋白的表达,进而影响细胞自噬标志蛋白LC3、p62的表达,阻止HSC的活化,并抑制肝纤维化的发生。
综上所述,白屈菜碱可改善CCl4诱导大鼠的肝纤维化,其机制可能与激活PI3K/Akt/mTOR信号通路、抑制细胞自噬有关。然而,自噬是一把“双刃剑”,其与肝纤维化的关系复杂。因此,白屈菜碱通过调控自噬抗肝纤维化的作用机制还需后续进一步深入研究。
參考文献
[ 1 ] EZHILARASAN D,SOKAL E,NAJIMI M. Hepatic fibrosis:it is time to go with hepatic stellate cell-specific therapeutic targets[J]. Hepatobiliary Pancreat Dis Int,2018,17(3):192-197.
[ 2 ] CHEN G,XIA B,FU Q,et al. Matrix mechanics as regulatory factors and therapeutic targets in hepatic fibrosis[J]. Int J Biol Sci,2019,15(12):2509-2521.
[ 3 ] WANG S,FRIEDMAN S L. Hepatic fibrosis:a convergent response to liver injury that is reversible[J]. J Hepatol,2020,73(1):210-211.
[ 4 ] CUI Z,HUANG N,LIU L,et al. Dynamic analysis of m6A methylation spectroscopy during progression and reversal of hepatic fibrosis[J]. Epigenomics,2020,12(19):1707-1723.
[ 5 ] HU Z,SU H,ZENG Y,et al. Tetramethylpyrazine ameliorates hepatic fibrosis through autophagy-mediated inflammation[J]. Biochem Cell Biol,2020,98(3):327-337.
[ 6 ] ZHANG Z,WEN H,WENG J,et al. Silencing of EPCAM suppresses hepatic fibrosis and hepatic stellate cell proli- feration in mice with alcoholic hepatitis via the PI3K/Akt/mTOR signaling pathway[J]. Cell Cycle,2019,18(18):2239-2254.
[ 7 ] 王晓丽,郭丽娜,孙辑凯,等.齐齐哈尔地区野生白屈菜质量考察研究[J].齐齐哈尔医学院学报,2014,35(14):2031-2032.
[ 8 ] PAN J,YANG Y,ZHANG R,et al. Enrichment of chelidonine from Chelidonium majus L. using macroporous resin and its antifungal activity[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2017,1070:7-14.
[ 9 ] HOU F J,GUO L X,ZHENG K Y,et al. Chelidonine enhances the antitumor effect of lenvatinib on hepatocellular carcinoma cells[J].Onco Targets Ther,2019,12:6685- 6697.
[10] LIU X W,TANG C L,ZHENG H,et al. Investigation of the hepatoprotective effect of Corydalis saxicola Bunting on carbon tetrachlorideinduced liver fibrosis in rats by 1H-NMR-based metabonomics and network pharmaco- logy approaches[J]. J Pharm Biomed Anal,2018,159:252-261.
[11] 李晓明,林鹏飞,董妙先,等.白屈菜碱对活化后大鼠肝星状细胞CFSC-8B的增殖、胶原合成及TGF-β1受体的影响[J].中国药房,2019,30(13):1759-1763.
[12] 梁增荣,龙梓,陈少锐,等.护肝片对四氯化碳致大鼠慢性肝损伤肝阴虚证的保护作用[J].中国实验方剂学杂志,2015,21(24):137-141.
[13] 龙丹丹,张清,占凯,等.大黄素对四氯化碳诱导肝纤维化大鼠的干预作用[J].广西医学,2020,42(16):2120-2124.
[14] 李晓明,欧阳婷庭,董妙先,等.白屈菜红碱对肝纤维化小鼠TGF-β/Smads信号通路的影响[J].中国病理生理杂志,2018,34(7):1323-1328.
[15] WU B M,LIU J D,LI Y H,et al. Margatoxin mitigates CCl4-induced hepatic fibrosis in mice via macrophage polarization,cytokine secretion and STAT signaling[J]. Int J Mol Med,2020,45(1):103-114.
[16] 李娜,周琪,趙鑫,等.大蒜素对小鼠酒精性肝纤维化的预防作用研究[J].食品研究与开发,2018,39(6):177-181.
[17] 齐玉梅,呼和木仁.额力根-Ⅱ号对肝纤维化大鼠肝脏组织形态学的影响[J].中国民族医药杂志,2016,22(12):32-34.
[18] WONG R J,LE A,NGUYEN M T,et al. Significant hepatic fibrosis among treatment-naive chronic hepatitis B virus with increased hepatitis B virus DNA and normal alanine aminotransferase[J]. Clin Gastroenterol Hepatol,2018,16(1):146-148.
[19] 柯迎妹,江敏,周树波,等.兰坪虫草多糖组分分析及缓解小鼠肝纤维化研究[J].中国中药杂志,2020,45(21):5256-5264.
[20] GE M,LIU H,ZHANG Y,et al. The anti-hepatic fibrosis effects of dihydrotanshinone Ⅰ are mediated by disrup- ting the yes-associated protein and transcriptional enhancer factor D2 complex and stimulating autophagy[J]. Br J Pharmacol,2017,174(10):1147-1160.
[21] HUANG Y,LI Y,LOU A,et al. Alamandine attenuates hepatic fibrosis by regulating autophagy induced by NOX4- dependent ROS[J]. Clin Sci (Lond),2020,134(7):853- 869.
[22] LU C F,XU W X,ZHANG F,et al. Nrf2 knockdown attenuates the ameliorative effects of ligustrazine on hepatic fibrosis by targeting hepatic stellate cell transdifferentiation[J]. Toxicology,2016,365:35-47.
[23] THOEN L F,GUIMARAES E L,DOLLE L,et al. A role for autophagy during hepatic stellate cell activation[J]. J Hepatol,2011,55(6):1353-1360.
[24] SONG M,ZHANG H,CHEN Z,et al. Shikonin reduces hepatic fibrosis by inducing apoptosis and inhibiting autophagy via the platelet-activating factor-mitogen-activated protein kinase axis[J]. Exp Ther Med,2021,21(1):28.
[25] GÓMEZ-SÁNCHEZ R,YAKHINE-DIOP S M,RODRÍGUEZ-ARRIBAS M,et al. mRNA and protein dataset of autophagy markers (LC3 and p62) in several cell lines[J]. Data Brief,2016,7:641-647.
[26] LIAN C,ZHAO Y,SUN J,et al. Role of cell autophagy in the generation of IgM and hepatic fibrosis in primary biliary cholangitis[J]. Clin Rheumatol,2020,39(11):3499-3506.
[27] DONG Z,LI S,WANG X,et al. IncRNA GAS5 restrains CCl4-induced hepatic fibrosis by targeting miR-23a through the PTEN/PI3K/Akt signaling pathway[J]. Am J Physiol Gastrointest Liver Physiol,2019,316(4):G539- G550.
[28] KIM Y C,GUAN K L. mTOR:a pharmacologic target for autophagy regulation[J]. J Clin Invest,2015,125(1):25-32.
(收稿日期:2021-05-25 修回日期:2021-10-20)
(編辑:林 静)

