金钗石斛的化学成分及药理作用研究进展
令狐楚,谷荣辉,秦礼康
金钗石斛的化学成分及药理作用研究进展
令狐楚,谷荣辉*,秦礼康
贵州大学 酿酒与食品工程学院,贵州 贵阳 550025
通过搜索Web of Science、PubMed和CNKI数据库中金钗石斛的研究报道,对该植物的化学成分和药理作用的相关研究进行归纳总结。金钗石斛的化学成分主要包括生物碱、倍半萜、菲和联苄类等;药理作用主要表现在抗肿瘤、降血糖以及对神经系统保护等方面。在此基础上,进一步对金钗石斛化学成分的具体结构类型以及各类型的结构特征和波谱规律进行了梳理。有利于指导金钗石斛化学成分和药理作用的认识及研究,对该药食两用资源的深入开发利用提供参考依据。
金钗石斛;生物碱;倍半萜;菲;联苄;抗肿瘤
金钗石斛Lindl又名金钗石、扁金钗等,为兰科石斛属植物,主要分布于贵州、云南、广西等长江以南的亚热带地区[1]。据《神农本草经》记载,石斛在我国的药用历史已有1500多年,其与灵芝、人参、冬虫夏草等一直被认为是中国的珍贵高档中药材。金钗石斛是古代本草中最早能确定的石斛品种,是药用石斛主流品种之一,同时也是历版《中国药典》收载的石斛品种[2]。金钗石斛味苦、微咸且无毒,用于滋阴、清热、润肺、止咳、明目等,这些作用在《神农本草经》和《本草纲目》中都有记载。现代研究表明,金钗石斛的主要活性成分有生物碱、倍半萜、菲和联苄类等;药理作用主要表现在抗肿瘤、降血糖以及对神经系统保护等方面。目前,金钗石斛在石斛明目丸、石斛夜光丸、脉络宁注射液等药物中均有添加[3]。随着金钗石斛化学成分及药理的研究日益增多,非常有必要对这些研究进行总结,本文将其化学成分及药理作用研究进行综述,以期加深人们对金钗石斛的认识,促进其研究和开发利用。
1 化学成分
截止到2020年7月,从金钗石斛中分离出的化学成分主要为生物碱类(1~25)、菲类(26~63)、联苄类(64~89)、倍半萜类(90~132)以及其他类型(133~185),共计185个化合物(不含初级代谢物)。这些化合物均从金钗石斛茎中分离得到,化合物主要经甲醇或乙醇溶液提取,石油醚、醋酸乙酯、正丁醇等溶剂萃取分层,再利用多种柱色谱分离纯化得到,最后采用核磁共振、高分辨质谱、圆二色谱(circular dichroism,CD)等波谱技术鉴定结构。
1.1 生物碱类
生物碱类是最早从石斛属植物中分离得到的化合物类型。自1932年首次从金钗石斛中分离到生物碱,并命名为石斛碱(dendrobine,2),之后的研究表明石斛碱为金钗石斛的特征成分[4]。石斛碱的生物活性与木防己毒素(picrotoxin)相似,且有类似木防己毒烷(picrotoxane)的骨架,是首个被检测到的picrotoxane类生物碱[5]。《中国药典》2015年版将石斛碱含量作为金钗石斛质量检测指标,规定其含量不得低于0.4%,而其他药用石斛以甘露糖、多糖或毛兰素等的含量为测定指标[6]。
从金钗石斛中报道的生物碱有25个,按其结构不同可分为picrotoxane骨架的倍半萜生物碱(1~19)、酰胺类生物碱(21~25)以及腺苷类(20),其中倍半萜生物碱又可分为石斛碱型(dendrobine-type,1~15)和石斛次碱型(nobilonine-type,16~19)2个亚型(图1)。如图1所示,金钗石斛的倍半萜生物碱多具一个由C3位羟基与C15羧基酯化(石斛碱型)或C3位羟基与C11羧基酯化(石斛次碱型)形成的五元内酯环。除以上五元内酯环外石斛碱型中还具有以N同C2位及C10位形成的五元杂环,且N上通常含有甲基(2~7),C10位易发生乙酸(4)、乙酯(5)、丙酮(6)和羰基(7)等多种取代,部分成分N上的乙基还常与C2位羟基成五元醚环(8~12),还有化合物以季铵盐(11~15)的形式存在于金钗石斛;nobilonine-type中的N常分布在C9位(16~17)和C2位(18~19)。酰胺类生物碱(amide-type)通常在C4上有羟基取代(21~25),在C4′(22~25)和C3′(22、25)上也会出现羟基或甲氧基取代。
化合物绝对构型的确定一直都是天然药物化学研究的热点。由于金钗石斛中picrotoxane类倍半萜生物碱手性中心较多,难以确定构型。目前仅Meng等[7]采用NOESY、单晶X射线衍射、CD等多种技术确定了(−)-(1,2,3,4,5,6,9,11)-11-carboxy- methyldendrobine(4)和dendrobine(5)的绝对构型。化合物1~25的结构见图1,其相关信息见表1。

图1 金钗石斛中生物碱类成分的结构

表1 从金钗石斛中分离出的生物碱类化合物
1.2 菲类
菲类化合物具有广泛的生物活性,其中抗细胞毒性尤为引人注目。但该类化合物仅在植物界的极少几个科中有报道,兰科植物是天然菲类的最主要来源[16]。金钗石斛属兰科植物,菲类是该植物的主要成分和热点研究物质之一,已从该植物中报道了38个菲类化合物,主要包括单菲类(26~56)和双菲类(57~63)。
单菲类是金钗石斛中的主要菲类成分,根据C9-C10间键的饱和程度分为二氢菲类(dihyhrophenanthrenes,9,10-dihydro type)(26~36)和去氢菲类(dehyhrophenanthrenes,9,10-dehydro type)(37~46),该类即为人们常称的菲类(phenanthrenes)。从图2可见,9,10-dihydro和9,10-dehydro两种类型的单菲通常以C2和C4~C7位上发生多取代的形式存在,C2和C7位的取代最为常见,且这些多位取代的取代基主要为羟基和甲氧基,偶有糖基取代(36);其他位置的取代现象较少见,如C1位(37、46)、C3位(42、44、45)、C8位(44)和C10位(36、41),C9位的取代还未见报道。单菲类除具有明显多取代的特征外,取代基氧化也较为常见,其中C5、C8位氧化成羰基比较多见(47~51),偶见C7位(52),C7、C10位(53)的氧化。单菲中还存在C5位羟基与C4位羧基酯化成环的结构(54),以及菲类中心的C8和C9位附有呋喃环结构的新颖单菲类成分(55、56)。金钗石斛中报道的双菲类大多以2个单菲通过C-C直接相连聚合而成,常见类型有:去氢单菲-二氢单菲(57、58)、去氢单菲-去氢单菲(59、60)、二氢单菲-二氢单菲(61、62)。这些C-C连接位置多样化,主要包括C1/C6′、C3/C6′、C8/C1′或C1/C8′;在金钗石斛中也存在通过取代基缩合形成C-O-C连接而成的双菲化合物(63)。
化合物26~63的结构见图2,其相关信息见表2。

图2 金钗石斛中菲类成分的结构
1.3 联苄类
金钗石斛中已报道26个联苄类化合物。根据这些化合物的结构特征,主要分为简单取代联苄(64~68)、桥碳取代联苄(69~80)和双联苄类(81~84),这些化合物苯环上的取代基通常为甲氧基和羟基。金钗石斛的简单取代联苄的C3和C5位上全部发生取代,其他位置偶有取代。桥碳取代联苄是指在桥碳链上存在取代基的一类特殊联苄化合物,这种物质在天然产物中较为少见,主要分布在石斛属植物[24]金钗石斛的桥碳取代联苄上的取代基多为甲氧基和羟基,但在某些特定位置上的取代基存在一致性,如C4位均为羟基、C5′位均为甲氧基。双联苄类的结构为4个苯环通过2个联苄键连接而成的一类化合物,金钗石斛中的双联苄常见于通过醚桥和C-C键连接(81、82)或2个醚桥连接(83、84)。此外,近年来文献报道了一些结构复杂新颖的其他类联苄。87、88在2个苄基之间或在一个丙苯基与一个苄基之间存在C-C连接[20],以及存在一个联苄通过醚桥连接其他非联苄结构的化合物(85、86、89)。82和83的绝对构型通过计算电子圆二色谱(electrostatic circular dichroism,ECD)分析确定[23],84~86的绝对构型通过手型拆分、NOESY和ECD确定[25]。

表2 从金钗石斛中分离出的菲类化合物
化合物64~89的结构见图3,其相关信息见表3。
1.4 倍半萜类
从金钗石斛中报道的倍半萜化合物(倍半萜生物碱除外)有43个,主要可分为picrotoxane型(90~111)、allo-aromadendrane型(112~119)、cyclocopacamphane型(120~122)和copacamphane型(123~125)。金钗石斛中分离得到的picrotoxane类倍半萜的含氧取代基较多,为多羟基结构的倍半萜。目前picrotoxane类中确定的绝对构型较少,仅Ma等[31]利用ECD、核磁共振和单晶X射线衍射确定了98、99和120的绝对构型,并且98和99具有罕见的C15-C2内酯环,以及Zhang等[32]采用CD谱和键角规律确定了122的绝对构型。allo-aromadendrane类倍半萜的结构中五七环呈顺式稠合,具有特征的环丙烷结构片段。Cycloco pacamphane与 copacamphane 2类化合物的结构相似,主要差异为cyclocopacamphane类的羟基取代多存在于C2和C8,且 C14位常被氧化成羰基(120~122),而copacamphane类的C8、C9和C14位环合形成了一个三元环,且其羟基取代多存在于 C4和C7位(123~125)。金钗石斛中的其他类型倍半萜成分有杜松烷型(126~128)、emmotin型(129)、卡达烯型(130),muurolene型(131)和axane型(132)。130是卡达烯型倍半萜葡萄糖苷,该类化合物骨架生源上由杜松烷型倍半萜高度去氢形成萘环得到,该骨架在天然产物中较少见[33]。化合物90~132的结构见图4,其相关信息见表4。

图3 金钗石斛中联苄成分的结构

表3 从金钗石斛中分离出的联苄类化合物
1.5 其他化合物
金钗石斛中报道的其他类化合物包括酚类(133~145、151~157)、芴酮类(158~162)、木脂素(163~169)、香豆素(170~172)、内酯类(173~176)、甾体(180~182)等,其中木脂素、多酚均具有较好的抗氧化活性,在天然抗氧化剂等领域具有较好的开发潜力[40-42]。化合物133~185的结构见图5,其相关信息见表5。
2 药理作用
综合金钗石斛的药理活性研究报道发现,金钗石斛的提取物或从中分离的化合物主要具有抗肿瘤、抗衰老、抗白内障、降血糖调血脂和保护神经系统等药理作用。
2.1 抗肿瘤作用
金钗石斛多糖(Lindl. polysaccharides,DNLP)和金钗石斛生物碱(Lindl. alkaloids,DNLA)能抑制肿瘤细胞增殖和促进肿瘤细胞凋亡。研究发现DNLP和DNLA不仅对Sarcoma180肿瘤细胞、白血病HL-60细胞、人宫颈癌HeLa细胞、乳腺癌MCF-7细胞、肺癌A549细胞、肝癌HepG2细胞和胃癌MNK45细胞的生长均具有抑制作用,而且能够促进MCF-7、A549、HepG2和MNK45细胞的凋亡,这种凋亡促进作用呈剂量-时间依赖关系[1, 49-51]。此外,Zheng等[52]通过构建HPLC指纹图谱对金钗石斛的成分进行相对定量比较,分析HPLC指纹图谱和癌细胞抑制活性,结果发现金钗石斛中一些低极性成分对A549细胞具有强抑制作用。

图4 金钗石斛中倍半萜类成分的结构

表4 从金钗石斛中分离出的倍半萜类化合物
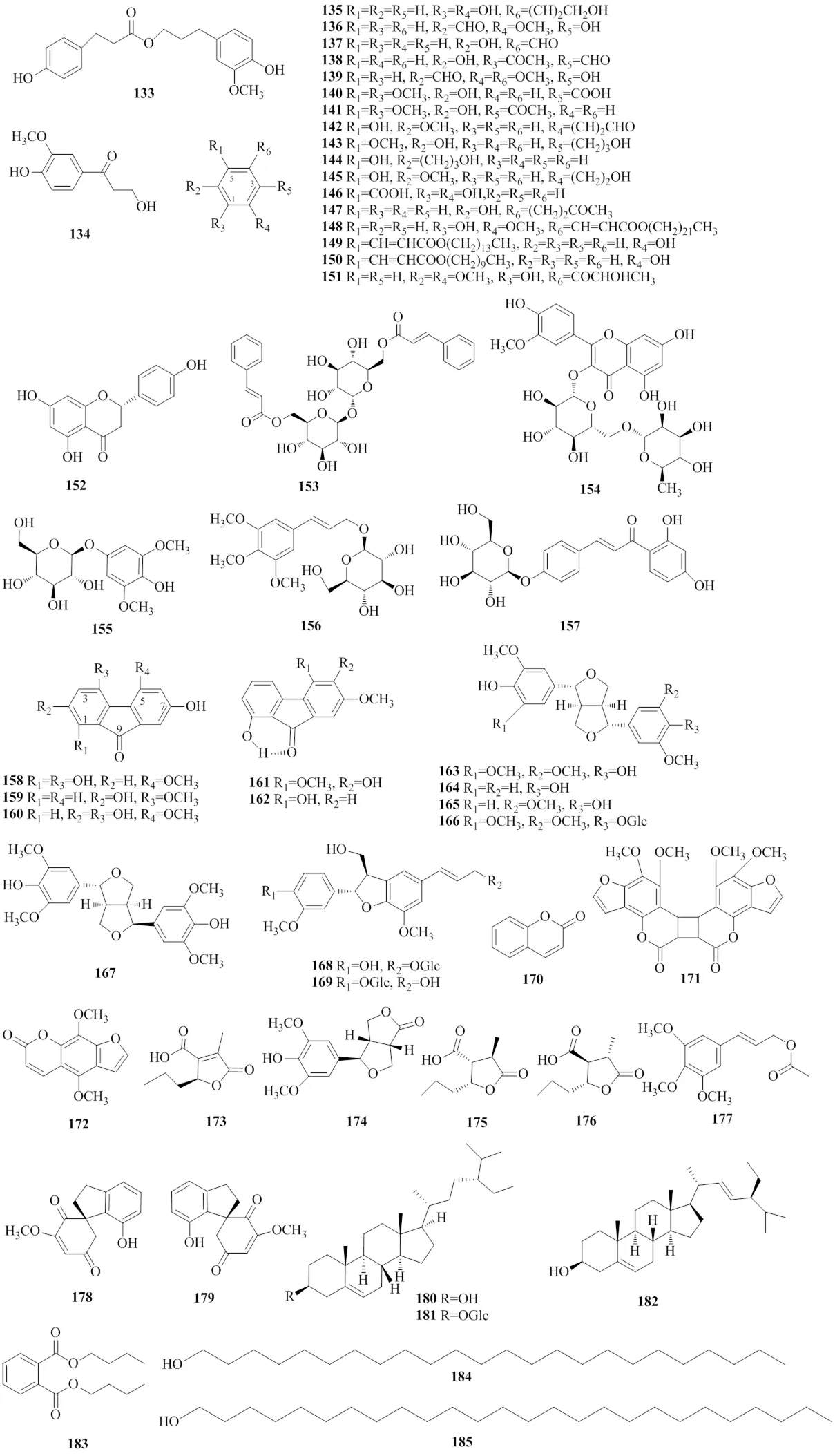
图5 金钗石斛中其他成分的结构

表5 从金钗石斛中分离出的其他类化合物
菲类化合物也具有较好的抗肿瘤活性,在体外抗肿瘤活性研究中,化合物coelonin(28)、densiflorol B(47)和cypripedin(48)具有显著抑制MCF-7细胞的增殖作用,可作为抗肿瘤活性候选药物[21]。lusianthridin(27)和denbinobin(49)对A549、HL-60和卵巢癌SK-OV-3细胞具有细胞毒性且27还显示了抑制Sarcoma180肿瘤细胞的活性[18],49还可通过抑制C3肉毒素底物1的活性,从而抑制肿瘤趋化因子诱导前列腺癌PC-3细胞的迁移,表现出抑制癌细胞扩散的作用[53]。联苄类化合物crepidatin(71)、chrysotoxin(72)和moscatilin(69)对人肝癌高侵袭细胞系的增殖具有一定的抑制作用[54]。
2.2 抗衰老
金钗石斛可以清除氧自由基、延缓DNA损伤、抑制细胞凋亡和改变DNA甲基化,从而表现出延缓衰老的重要活性。Denham[55]认为自由基是衰老的关键因素,通过研究金钗石斛胶囊灌胃老龄小鼠,发现试验组血清中丙二醛水平下降,清除自由基的超氧化物歧化酶与谷胱甘肽过氧化物酶活力水平升高[56]。金钗石斛中的许多化合物有清除自由基和抗氧化的的活性,且有比维生素C更有效的1,1-二苯基-2-三硝基苯肼自由基清除活性,如confusarin(44)和nobilin D(80)等[22, 26]。dendroflorin(158)有利于降解活性氧,有望作为抗衰老药物[46]。此外,金钗石斛可以保护胃黏膜,调节肠胃蠕动,促进消化液和消化酶的分泌,调节肠的微生态,提高肠的免疫力等,这些可能是延缓与年龄有关的疾病的重要机制[57]。Nie等[58]认为补阴益气、壮肠胃和健体延寿是金钗石斛治疗阿尔茨海默病(Alzheimer′s disease,AD)、高脂血症和糖尿病等老年病的主要作用。金钗石斛抗衰老、治疗老年病的具体机制仍有待进一步探索。
2.3 对神经系统的作用
DNLA可在体内和体外保护神经元免受损伤。DNLA对脑内Tau蛋白的过度磷酸化具有抑制作用,且能够改善脂多糖诱导的大鼠脑细胞凋亡,用金钗石斛处理7 d可以显著减少海马体周围的凋亡细胞数量[59]。在体外实验中,DNLA可通过改善神经元的自噬通量来减轻Aβ25-35引起的轴突损伤[60]。DNLA可有效改善多种AD模型中的实验动物的认知缺陷。有研究报道,DNLA通过抑制内质网应激相关的内质网激酶信号通路,连续抑制Calpain 1,GSK-3β和Cdk5的活性,从而降低Tau蛋白的过度磷酸化,达到改善老龄小鼠的认知障碍,DNLA的这种改善认知障碍效果甚至和二甲双胍的效果相当[61]。此外,DNLA还可调节AD大鼠海马神经元中的α-和β-分泌酶来降低β淀粉样蛋白的形成和折叠,以改善老年小鼠的学习和记忆功能[62],研究发现金钗石斛黄酮类成分也存在较好的抗AD活性[63]。
DNLA对慢性应激诱导的大鼠焦虑行为具有改善作用,其作用机制与调节血清中5-羟色胺系统、抑制下丘脑-垂体-肾上腺轴亢进、以及调节-氨基丁酸A受体和N-甲基-D-天冬氨酸受体蛋白的表达有关[64]。DNLA具有预防由氧化应激引起的各种人类神经系统疾病的潜在作用[65]。
2.4 抗白内障的作用
金钗石斛是石斛明目丸、石斛夜光丸等制剂的重要成分。通过将DNLA和DNLP分别给药于白内障Wistar大鼠模型,结果显示均可以升高模型大鼠晶状体中的水溶性蛋白、谷胱甘肽含量及总超氧化物歧化酶的活性,同时降低丙二醛活性,表明金钗石斛总生物碱和粗多糖在体外有一定的抗白内障的作用,且总生物碱的效果优于粗多糖[66]。也有研究发现DNLA可以通过抑制一氧化氮合酶的表达,对糖尿病性白内障具有显著的治疗作用[67]。
金钗石斛可以调节非蛋白质巯基的含量和白内障晶状体中还原型辅酶Ⅱ的含量,使其恢复至正常晶状体的水平,达到改善白内障的作用效果;此外还能改善由半乳糖性白内障引起总脂类含量降低、总胆固醇含量及脂类过氧化水平升高、总脂类与胆固醇之比明显下降等病理变化[68]。据相关研究,低剂量的金钗石斛脂溶性生物碱可以通过抗氧化损伤的作用促进人晶状体上皮细胞的增殖,抑制晶状体上皮细胞调亡,从而改善白内障[69]。
倍半萜类化合物(+)-(1,2,3,4,5,6,9)-3,11,12-trihydroxypicrotoxane-2(15)-lactone(98)、(−)-(1,2,3,4,5,6,9,12)-3,11,13-trihydroxy -picrotoxane-2(15)-lactone(99)和(+)-(1,5,6,8, 9)-8,12-dihydroxy-copacamphan-3-en-2-one(120)对H2O2诱导的大鼠肾上腺嗜铬细胞瘤细胞PC12细胞氧化损伤表现出显著神经保护活性[31],且在25和50μM的浓度下98和99具有比维生素E更好的神经保护活性。
2.5 降血糖和调血脂
研究发现金钗石斛对多种类型所致的糖尿病都具有一定的保护作用,例如对肾上腺素性高血糖小鼠[70]和四氧嘧啶诱导的糖尿病大鼠均有降血糖作用[58]。临床研究结果表明金钗石斛的不同部位提取物可调节氧化应激反应,降低糖尿病小鼠肝、肾组织的氧化酶活性。除了直接的降血糖作用外,金钗石斛还可以改善糖尿病并发症,如糖尿病肾病和糖尿病视网膜病变[58]。
金钗石斛可以调节血脂并治疗脂肪肝。金钗石斛能降低高脂血症模型小鼠总胆固醇和低密度脂蛋白胆固醇,升高高密度脂蛋白胆固醇,并减轻动脉粥样硬化和调节脂质代谢异常,此外DNLA和DNLP可以改善高脂血症大鼠肝脏组织的脂肪变性[71-72]。
2.6 其他作用
金钗石斛还有提高免疫力[73]、抗炎、抗疲劳、保肝护肾和抗氧化等活性。DNLA可以调节小鼠肝脏脂质代谢基因的表达[74]和保护肝脏免受CCl4导致的线粒体损伤[75]。此外DNLP可明显降低非酒精性脂肪肝病大鼠肝脏中CYP2E1蛋白以及mRNA的表达,进而改善肝功能和血脂水平,提高过氧化氢酶和超氧化物歧化酶的活力,最终达到有效缓解非酒精性脂肪肝病大鼠症状的作用[76]。DNLA可有效改善多柔比星肾病大鼠肾纤维化并可保护肾脏功能,其机制可能与抑制PI3K/Akt/HIF-1α信号通路有关[77]。
金钗石斛中分离的多糖DNPE6(4)在体内具有抗烟草花叶病毒和黄瓜花叶病毒的活性[78],多糖DNPE6(11)具有抗黄瓜花叶病毒和马铃薯Y病毒的活性[79],此类成分具有研究和开发抗病毒药物的前景。并且,DNLP可改善多囊卵巢综合症大鼠卵泡发育和抑制卵巢颗粒细胞凋亡以保护来曲唑诱导的多囊卵巢综合征大鼠模型的卵巢[80]。
在一定浓度下,化合物dendronobilin B(90)对舒尼替尼诱导的斑马鱼血管损伤具有显著的改善和保护效果,体现出了较好的促血管生成作用[7]。dendroside A(112)和dendronobiloside A(108)具有提高免疫力的作用,在体外可刺激小鼠T淋巴细胞和B淋巴细胞的增殖[38]。此外化合物64~70对一些植物病原真菌具有广谱抗真菌活性[17]。
3 结语
中国九大仙草有石斛、天山雪莲、三两重人参、百年首乌、花甲之茯苓、深山灵芝、海底珍珠、冬虫夏草以及苁蓉[81],石斛在此位列首位,可见自古人们就非常看重石斛的功效。如今,传统中药材、药食两用资源以及天然产物的开发利用越来越成为药物研发和食疗保健科研工作者关注的焦点。金钗石斛不仅是一种有着悠久使用历史的传统药食两用资源,而且现代研究也表明其具有多种结构类型的药理活性成分,非常值得继续深入研究和挖掘更为广泛的潜在利用价值。
未来可将金钗石斛活性成分全面、快速、精准地发现以及药理功效的系统作用机制作为研究的重点;结合其活性成分及作用机制,加快相关治疗保健药物的研发,同时可将金钗石斛在护肤明目、功能性食品等方面的应用作为新的开发利用方向。
利益冲突 所有作者均声明不存在利益冲突
[1] 安凤娟, 何宇新. 金钗石斛多糖的研究进展 [J]. 安徽农业科学, 2014, 42(13): 3857-3862.
[2] 许莉, 王江瑞, 郭力, 等. 金钗石斛化学成分的研究 [J]. 中成药, 2018, 40(5): 1110-1112.
[3] 王琳, 叶庆生, 刘伟. 金钗石斛研究概况 [J]. 亚热带植物科学, 2004, 33(2): 73-76.
[4] 李墅, 王春兰, 郭顺星. 高效液相色谱法测定金钗石斛中石斛碱含量 [J]. 中国药学杂志, 2009, 44(4): 252-254.
[5] 王亚芸, 任建武. 石斛碱的研究进展 [J]. 山东农业大学学报: 自然科学版, 2015, 46(1): 152-158.
[6] 宋小蒙, 王洪新, 马朝阳, 等. HPLC-ESI-MS/MS分析金钗石斛花花色苷组成及其抗氧化活性测定 [J]. 江苏农业科学, 2018, 46(15): 151-154.
[7] Meng C W, He Y L, Peng C,. Picrotoxane sesquiterpenoids from the stems ofand their absolute configurations and angiogenesis effect [J]., 2017, 121: 206-211.
[8] Wang Y H, Avula B, Abe N,. Tandem mass spectrometry for structural identification of sesquiterpene alkaloids from the stems ofusing LC-QToF [J]., 2016, 82(7): 662-670.
[9] Liu Q F, Zhao W M. A new dendrobine-type alkaloid from[J]., 2003, 14(3): 278-279.
[10] Wang H, Zhao T, Che C T. Dendrobine and 3-Hydroxy-2-oxodendrobine from[J]., 1985, 48(5): 796-801.
[11] 汪代芳, 侴桂新, 赵宁毅, 等. 金钗石斛茎的化学成分研究 [J]. 中草药, 2012, 43(8): 1492-1495.
[12] Okamoto T, Natsume M, Onaka T, et al. Further studies on the alkaloidal constituents of(Orchidaceae)-structure determination of 4-hydroxy-dendroxine and nobilomethylene[J]., 1972, 20(2): 418-421.
[13] Hedman K, Leander K, Liaaen-Jensen S,. Studies on Orchidaceae alkaloids. XXVII. quaternary salts of the dendrobine type fromlindl [J]., 1972, 26: 3177-3180.
[14] Wang P, Chen X, Wang H,. Four new picrotoxane-type sesquiterpenes fromlindl [J]., 2019, 7: 812.
[15] Zhou X M, Zheng C J, Wu J T,. A new phenolic glycoside from the stem of[J]., 2017, 31(9): 1042-1046.
[16] Tóth B, Hohmann J, Vasas A. Phenanthrenes: A promising group of plant secondary metabolites [J]., 2018, 81(3): 661-678.
[17] Zhou X M, Zheng C J, Gan L S,. Bioactive phenanthrene and bibenzyl derivatives from the stems of[J]., 2016, 79(7): 1791-1797.
[18] Lee Y H, Park J D, Baek N I,.andantitumoral phenanthrenes from the aerial parts of[J]., 1995, 61(2): 178-180.
[19] Hwang J S, Lee S A, Hong S S,. Phenanthrenes fromand their inhibition of the LPS-induced production of nitric oxide in macrophage RAW 264.7 cells [J]., 2010, 20(12): 3785-3787.
[20] Liu Q F, Chen W L, Tang J,. Novel Bis(bibenzyl) and (propylphenyl)bibenzyl derivatives from[J]., 2007, 90(9): 1745-1750.
[21] 周威, 曾庆芳, 夏杰, 等. 金钗石斛的菲类抗肿瘤活性成分研究 [J]. 中国药学杂志, 2018, 53(20): 1722-1725.
[22] Zhang X, Xu J K, Wang N L, et al. Antioxidant phenanthrenes and lignans from[J]., 2008, 17(4): 314-318.
[23] Cheng L, Guo D L, Zhang M S,. Dihydrophenanthrofurans and bisbibenzyl derivatives from the stems of[J]., 2020, 143: 104586.
[24] 寇泽琪, 闫德彪, 冯锋. 天然联苄类化合物研究进展 [J]. 海峡药学, 2013, 25(9): 1-6.
[25] 张茂生, 令狐浪, 张建永, 等. 金钗石斛中联苄基衍生物化学成分研究 [J]. 有机化学, 2019, 39(11): 3289-3293.
[26] Zhang X, Xu J K, Wang J,. Bioactive bibenzyl derivatives and fluorenones from[J]., 2007, 70(1): 24-28.
[27] Ye Q H, Zhao W M. New alloaromadendrane, cadinene and cyclocopacamphane type sesquiterpene derivatives and bibenzyls from[J]., 2002, 68(8): 723-729.
[28] 肖世基, 刘珍, 张茂生, 等. 金钗石斛中一个新的联苄类化合物 [J]. 药学学报, 2016, 51(7): 1117-1120.
[29] Zhang X, Gao H, Wang N L,. Three new bibenzyl derivatives from[J]., 2006, 8(1/2): 113-118.
[30] 肖世基, 翁清花, 张茂生, 等.金钗石斛中一个新化合物及其提取分离方法.中国, CN201710396370.5 [P]. 2017.05.31.
[31] Ma C, Meng C W, Zhou Q M,. New sesquiterpenoids from the stems ofand their neuroprotective activities [J]., 2019, 138: 104351.
[32] Zhang X, Liu H -W, Gao H,. Nine new sesquiterpenes from[J]., 2007, 90(12): 2386-2394.
[33] 武婷, 张茂生, 张建永, 等. 金钗石斛中一个新的卡达烯型倍半萜葡萄糖苷 [J]. 药学学报, 2019, 54(7): 1257-1259.
[34] 张雪, 高昊, 韩慧英, 等. 金钗石斛中的倍半萜类化合物 [J]. 中草药, 2007, 38(12): 1771-1774.
[35] Zhang X, Tu F J, Yu H Y,. Copacamphane, picrotoxane and cyclocopacamphane sesquiterpenes from[J]., 2008, 56(6): 854-857.
[36] Ye Q, Qin G, Zhao W. Immunomodulatory sesquiterpene glycosides from[J]., 2002, 61(8): 885-890.
[37] Shu Y, Zhang D M, Guo S X. A new sesquiterpene glycoside fromLindl [J]., 2004, 6(4): 311-314.
[38] Zhao W, Ye Q, Tan X,. Three new sesquiterpene glycosides fromwith immunomodulatory activity [J]., 2001, 64(9): 1196-1200.
[39] 肖世基, 钱怡, 张良, 等. 黔产金钗石斛中1个新的杜松烷型倍半萜 [J]. 中草药, 2016, 47(17): 2972-2974.
[40] Zhou X M, Zheng C J, Wu J T,. Five new lactone derivatives from the stems of[J]., 2016, 115: 96-100.
[41] 费雯, 淳泽, 何沁嶷, 等. 金钗石斛总多酚提取工艺及体外抗氧化活性 [J]. 应用与环境生物学报, 2015, 21(4): 623-628.
[42] 高华山, 陈明辉, 齐光, 等. 金钗石斛总黄酮提取工艺优化及抗氧化活性 [J]. 江苏农业科学, 2019, 47(24): 194-199.
[43] 张雪, 高昊, 王乃利, 等. 金钗石斛中的酚性成分 [J]. 中草药, 2006, 37(5): 652-655.
[44] 周威, 沈祥春, 曾庆芳, 等. 金钗石斛的芴酮类成分研究 [J]. 中药材, 2018, 41(8): 1887-1889.
[45] 罗丹, 张朝凤, 林萍, 等. 金钗石斛化学成分的研究 [J]. 中草药, 2006, 37(1): 36-38.
[46] Jin J, Liang Y, Xie H,. Dendroflorin retards the senescence of MRC-5 cells [J]., 2008, 63(4): 321-323.
[47] Talapatra B, Mukhopadhyay P, Chaudhury P,. Denbinobin, a new phenanthraquinone fromLindl. (Orchidaceae)[J]., 1982, 21(4): 386-387.
[48] 李玉鹏, 蒋金和, 刘莹, 等. 金钗石斛化学成分的研究 [J]. 时珍国医国药, 2010, 21(1): 39-40.
[49] 严慕贤, 魏刚, 刘康阳, 等. 金钗石斛水溶性多糖与碱溶性多糖对Hela细胞增殖的影响 [J]. 中药新药与临床药理, 2015, 26(2): 195-198.
[50] 安欣, 任建武, 李虹阳, 等. 金钗石斛生物碱对mcf-7细胞线粒体凋亡通路研究 [J]. 江西农业大学学报, 2015, 37(5): 920-926.
[51] 何沁嶷. 金钗石斛中生物碱积累规律及抗肿瘤活性研究 [D]. 雅安: 四川农业大学, 2016.
[52] Zheng S G, Hu Y D, Zhao R X,. Quantitative assessment of secondary metabolites and cancer cell inhibiting activity by high performance liquid chromatography fingerprinting in[J]., 2020, 1140: 122017.
[53] Lu T L, Han C K, Chang Y S,. Denbinobin, a phenanthrene from, impairs prostate cancer migration by inhibiting Rac1 activity [J]., 2014, 42(6): 1539-1554.
[54] 罗文娟, 王光辉, 张雪, 等. 金钗石斛茎提取物联苄类化合物对人肝癌高侵袭转移细胞株FHCC-98增殖的抑制 [J]. 中国临床康复, 2006, 10(43): 150-152.
[55] Denham H. Aging a theory based on free radical[J]., 1956, 11(3): 298–300.
[56] 宾捷, 胡余明, 尹进, 等. 金钗石斛对老龄小鼠抗氧化作用的实验研究 [J]. 实用预防医学, 2010, 17(6): 1063-1064.
[57] Liao L J, Schneider K M, Galvez E J C,. Intestinal dysbiosis augments liver disease progression via NLRP3 in a murine model of primary sclerosing cholangitis [J]., 2019, 68(8): 1477-1492.
[58] Nie X Q, Chen Y, Li W,. Anti-aging properties ofLindl.: From molecular mechanisms to potential treatments [J]., 2020, 257: 112839.
[59] Yang S, Gong Q H, Wu Q,. Alkaloids enriched extract fromLindl. attenuates tau protein hyperphosphorylation and apoptosis induced by lipopolysaccharide in rat brain [J]., 2014, 21(5): 712-716.
[60] Li L S, Lu Y L, Nie J,.Lindl alkaloid, a novel autophagy inducer, protects against axonal degeneration induced by Aβ25-35inneurons[J]., 2017, 23(4): 329-340.
[61] Liu B, Huang B, Liu J,.Lindl alkaloid and metformin ameliorate cognitive dysfunction in senescence-accelerated mice via suppression of endoplasmicstress [J]., 2020, 1741: 146871.
[62] Huang J, Huang N, Zhang M,. Dendrobium alkaloids decrease Aβ by regulating α- and β-secretases in hippocampal neurons of SD rats[J]., 2019, 7: e7627.
[63] 李艳萍, 李海燕, 纪晓婉, 等. 金钗石斛叶中总黄酮的提取分离及体外抗阿尔茨海默病活性研究 [J]. 中国药房, 2018, 29(3): 330-333.
[64] 熊庭旺, 吴芹, 刘波, 等. 金钗石斛总生物碱抗慢性应激诱导的大鼠焦虑作用及机制 [J]. 中国药理学与毒理学杂志, 2019, 33(6): 453.
[65] Liu J, Zhu T, Niu Q Q,.alkaloids protects against H2O2-induced neuronal injury by suppressing JAK-STATs pathway activation in N2A cells [J]., 2020, 43(4): 716-724.
[66] 龙艳, 魏小勇, 詹宇坚, 等. 金钗石斛提取物抗白内障的体外实验研究 [J]. 广州中医药大学学报, 2008, 25(4): 345-349.
[67] 魏小勇, 龙艳. 金钗石斛生物碱对糖性白内障大鼠诱导型一氧化氮合酶基因的调控 [J]. 解剖学研究, 2008, 30(3): 177-180,205.
[68] 周威, 夏杰, 孙文博, 等. 金钗石斛的化学成分和药理作用研究现状 [J]. 中国新药杂志, 2017, 26(22): 2693-2700.
[69] 马伟凤, 徐勤. 金钗石斛提取物对晶状体上皮细胞氧化损伤防护作用 [J]. 国际眼科杂志, 2010, 10(4): 650-652.
[70] 李菲, 黄琦, 李向阳, 等. 金钗石斛提取物对肾上腺素所致血糖升高的影响 [J]. 遵义医学院学报, 2008, 31(1): 11-12.
[71] Xu Y Y, Xu Y S, Wang Y,.Lindl. alkaloids regulate metabolism gene expression in livers of mice [J]., 2017, 69(10): 1409-1417.
[72] 黄琦, 廖鑫, 吴芹, 等. 金钗石斛生物总碱对糖尿病大鼠血糖及肝脏组织IRS-2 mRNA, IGF-1 mRNA表达的影响 [J]. 中国实验方剂学杂志, 2014, 20(19): 155-158.
[73] 税小红, 税璘, 牛曼思, 等. 金钗石斛破壁粉对环磷酰胺致免疫低下小鼠免疫功能的调节作用 [J]. 药物评价研究, 2018, 41(12): 2189-2194.
[74] Huang S, Wu Q, Liu H,. Alkaloids ofLindl. altered hepatic lipid homeostasis via regulation of bile acids[J]., 2019, 241: 111976
[75] 周金鑫, 张娅, 周少玉, 等. 金钗石斛生物碱对四氯化碳所致小鼠肝线粒体损伤的保护作用及机制 [J]. 中国药理学与毒理学杂志, 2019, 33(10): 833-834.
[76] 吴梦龄, 范艳, 杨榆青, 等. 金钗石斛多糖通过下调CYP2E1表达改善非酒精性脂肪肝病大鼠症状 [J]. 西部医学, 2020, 32(4): 505-509,514.
[77] 樊小宝, 吴雅岚, 王晶, 等. 金钗石斛多糖对多柔比星肾病大鼠肾纤维化及PI3K/Akt/HIF-1α通路的影响 [J]. 中国药师, 2019, 22(10): 1835-1840.
[78] Li Z R, Shi J, Hu D Y,. A polysaccharide found inLindl stimulates calcium signaling pathway and enhances tobacco defense against TMV [J]., 2019, 137: 1286-1297.
[79] Li Z R, Xiang J, Hu D Y,. Naturally potential antiviral agent polysaccharide fromLindl [J]., 2020, 167: 104598.
[80] Zhang S, Tu H Y, Zhu J M,.Lindl. polysaccharides improve follicular development in PCOS rats [J]., 2020, 149: 826-834.
[81] 江滢, 黄厚今. 金钗石斛研究进展 [J]. 云南中医中药杂志, 2015, 36(1): 77-78.
Research progress on chemical constituents and pharmacological effects of
LING-HU Chu, GU Rong-hui,QIN Li-kang
School of Liquor and Food Engineering, Guizhou University, Guiyang 550025, China
In this paper, the chemical constituents and pharmacological activity ofwere summarized based on the related articles from Web of Science, PubMed and CNKI databases. The results showed that the main constituents inincluded alkaloids, and the significant pharmacological effects were manifested as anticancer, hypoglycemic and neurological protective actions. In addition, the main types of compounds from, and its structure characters and spectroscopy regularity were concluded as well. This paper was benefit to know and guide the research in the chemicals and activities of, which provide a reference for the further development and utilization of this medicinal and edible plant.
Lindl; alkaloid; sesquiterpenes; phenanthrene; bibenzyls; anti-tumor
R286
A
0253 - 2670(2021)24 - 7693 - 16
10.7501/j.issn.0253-2670.2021.24.032
2021-06-06
贵州大学自然科学专项(特岗)科研基金项目(贵大特岗合字2020003号);贵州省科学基金项目(黔科合基础-ZK[2021]一般085);贵州大学培育项目(贵大培育[2019]39号)
令狐楚(1997—),女,硕士研究生,研究方向为药食两用资源评价与利用。Tel: 15085464171 E-mail: 825325811@qq.com
谷荣辉(1987—),男,讲师,博士,研究方向为药食两用资源评价与利用、植物代谢组学、民族植物学。Tel: 19185413589 E-mail: rhgu@gzu.edu.cn
[责任编辑 时圣明]
——青蒿素

