酶法水解牦牛皮蛋白制备抗氧化肽工艺的优化
李 露,张普香,韩朋岑,李金容,叶潇莹,蔡韬敏,Isaac Newton ODEI ASARE,龙晓燕
(西南科技大学生命科学与工程学院,四川绵阳 621010)
抗氧化肽是近年来被广泛研究的一类天然生物活性肽,作为一种天然抗氧化剂,其结构相对简单、易吸收、稳定性好、无免疫反应,不仅具有较强的抗氧化活性,还具有降血压和抗癌等其他保健功效,在食品和医疗保健品领域越来越受到人们的关注[1]。动物皮中含有的蛋白质是天然抗氧化肽的原料来源之一,目前已有较多通过酶法水解方法从猪皮[2]、鸭皮[3]、鸡皮[4]、鱼皮[5-6]、蟾蜍皮[7]等动物皮肤中提取出具有抗氧化活性多肽。我国是世界上牦牛饲养量最大的国家,饲养牦牛总数约1400多万头,主要分布于青海、西藏、四川等地,其中青海饲养量占30%以上,位居全国第一[8]。牦牛主要生活在高寒地区,能采食各种高原上的植物和多样名贵药材,因此牦牛皮相关的产品具有较高的营养价值,如牦牛奶中的蛋白质、脂肪、矿物质元素等营养物质是中国荷斯坦牛乳的2倍[9]。牦牛皮是牦牛相关产品加工的副产物,研究表明,牦牛皮中粗蛋白占牦牛皮干重的89.74%,而胶原蛋白占粗蛋白含量的85%,相比普通蛋白质,胶原蛋白具有更好的生物相容性、促凝血性、弱抗原性和可降解性,也更容易被人体吸收利用,因此,牦牛皮可以作为天然活性肽的原料[10-11]。但牦牛皮的加工利用大多集中在皮革行业,仅有少部分被用于提取牦牛皮胶原蛋白,再由酶法提取出胶原蛋白肽[12-13],不理想的抗氧化活性及复杂的工艺降低了牦牛皮蛋白的利用率。
因为清除DPPH自由基能力的测定方法能够涉及到单电子转移(SET)的直接还原和氢原子转移(HAT)的两种抗氧化肽清除自由基的机制来猝灭自由基[14],故将其作为评价牦牛皮蛋白水解物抗氧化能力的指标。本文采用碱性蛋白酶酶法水解制备牦牛皮抗氧化肽,先研究pH、水解温度、酶用量、底物浓度及水解时间对牦牛皮蛋白水解物的影响,再结合响应面(Box-Behnken)试验设计,根据牦牛皮水蛋白解度(DH)及DPPH自由基清除能力的IC50值筛选牦牛皮抗氧化肽的最佳制备工艺,为牦牛皮的开发和应用提供试验支撑和理论基础。
1 材料与方法
1.1 材料与仪器
牦牛皮 来自青海省某大型屠宰场;DPPH(1,1-Diphenyl-2-picrylhydrazyl Free Radical,1,1-二苯基-2-苦肼基自由基) 梯希爱化成工业发展有限公司;碱性蛋白酶(200 U/mg) 上海源叶生物科技有限公司;茚三酮 上海易恩化学技术有限公司;抗坏血酸、氢氧化钠、盐酸、硼酸、无水乙醇等分析纯试剂成都市科隆化学品有限公司。
AR124CN电子分析天平 奥豪斯仪器(上海)有限公司;UV-8000S紫外可见分光光度计 上海元析仪器有限公司;LGJ-12真空冷冻干燥机 北京松源华兴科技发展有限公司;DZRW-D-1型电热恒温水浴锅 北京市永光明医疗仪器有限公司;Dynamica Velocity 14R台式离心机 青岛浩赛科技股份有限公司;UDK129半自动凯氏定氮仪 VELP公司;雷磁PHS-3C电极PH计 上海仪电科学仪器股份有限公司;DHG-9030A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司。
1.2 实验方法
1.2.1 牦牛皮抗氧化肽制备工艺 除去牦牛皮上肉、筋膜、牛毛等物质,称取牦牛皮,以烘干后牦牛皮重量的质量体积比1:20与蒸馏水混合,用0.1 mol/L的NaOH调节溶液pH为8.5,根据不同底物浓度加入不同质量的碱性蛋白酶,调节相应的水解温度、水解时间,恒温水浴搅拌进行水解,90 ℃水浴灭活10 min,4 ℃、10000 r/min离心 10 min后得到牦牛皮抗氧化体,真空冷冻干燥后于-20 ℃下保存。
1.2.2 单因素实验 每次单因素实验称取5 g处理好的牦牛皮,以水解度(DH)和DPPH自由基清除能力为评价指标分别考察五个单因素对水解度及DPPH自由基清除率的IC50值影响。
1.2.2.1 不同pH对牦牛皮水解的影响 在酶用量10000 U/g、水解温度50 ℃、水解时间8 h、底物浓度 5%的水解条件下考察不同 pH(7、7.5、8、8.5、9、9.5、10)对水解度及DPPH自由基清除能力的IC50值的影响。
1.2.2.2 不同水解温度对牦牛皮水解的影响 酶用量10000 U/g、底物浓度5%、水解时间8 h、pH8.5的水解条件下考察不同水解温度(45、50、55、60、65 ℃)对水解度及DPPH自由基清除能力的IC50值的影响。
1.2.2.3 不同酶用量对牦牛皮水解的影响 在底物浓度5%、水解温度50 ℃、水解时间8 h、pH8.5的水解条件下考察不同酶用量(4000、6000、8000、10000、12000 U/g)对水解度及DPPH自由基清除能力的IC50值的影响。
1.2.2.4 不同底物浓度对牦牛皮水解的影响 在酶用量 10000 U/g、水解温度 50 ℃、水解时间 8 h、pH8.5的水解条件下考察不同底物浓度(3%、4%、5%、6%、7%)对水解度及DPPH自由基清除能力的IC50值的影响。
1.2.2.5 不同水解时间对牦牛皮水解的影响 在酶用量 10000 U/g、水解温度 50 ℃、底物浓度 5%、pH8.5的水解条件下考察不同水解时间(4、6、8、10、12 h)对水解度及DPPH自由基清除能力的IC50值的影响。
1.2.3 响应面试验 在单因素实验结果的基础上,运用软件设计专家(Design-Expert 8.0.6)中的响应面优化设计,选取三个单因素:A(水解温度,℃)、B(酶用量,U/g)、C(水解时间,h)为自变量,以牦牛皮水解物的水解度和DPPH自由基清除率的IC50值为响应值进行酶解工艺条件优化。响应面因素水平编码见表1。
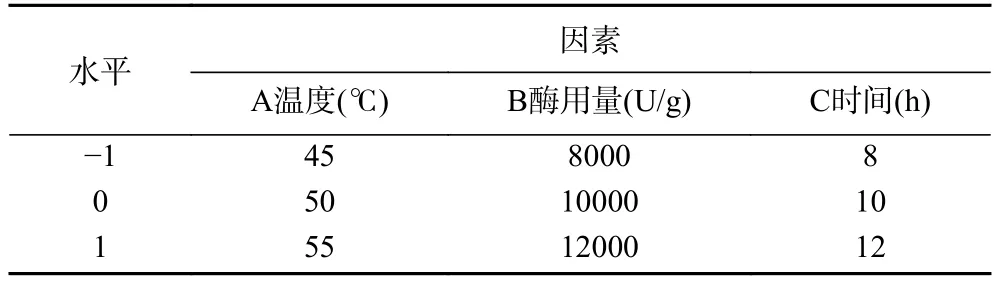
表1 响应面因素水平编码Table 1 Factor level coding of response surface
1.2.4 水解度(DH)测定 分别测α-氨基酸态氮含量(α-Aminonitrogen,AN)与总氮含量(Totalnitrogen,TN)来计算水解度,AN采用茚三酮显色法,用甘氨酸配制标准溶液绘制标准曲线来进行测量计算α-氨基酸态氮含量[15];TN采用中华人民共和国国家标准《食品中蛋白质的测定》(GB 5009.5-2010)中的凯氏定氮法测定计算总氮含量。
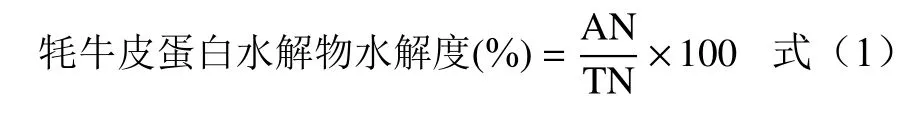
1.2.5 DPPH自由基清除能力的测定 采用文献[16-17]的方法并略微改进,将不同浓度的牦牛皮蛋白水解物溶液2.0 mL与0.1 mmol/L DPPH自由基溶液2.0 mL混合,充分振荡,避光孵育30 min(25 ℃),于波长517 nm测得混合溶液的吸光值Ai;对照组用2.0 mL蒸馏水替代酶解溶液测得吸光值A0;空白组以2.0 mL无水乙醇替代DPPH溶液测得吸光值Aj;VC作为阳性对照,并计算牦牛皮抗氧化肽对DPPH自由基清除率的IC50值。
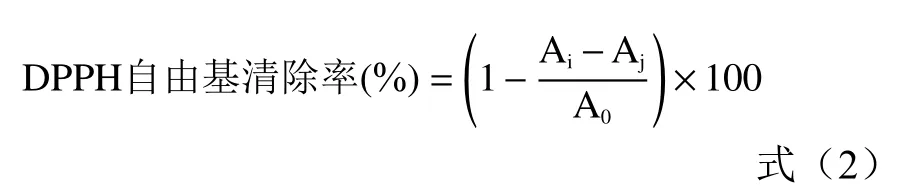
1.2.6 ABTS+自由基清除能力的测定 采用Yap等[18]的方法并略微改进,配制含有7 mmol/L ABTS和2.45 mmol/L过硫酸钾的ABTS试剂,在室温下孵育12~16 h。在734 nm下用无水乙醇稀释为吸收值为0.700±0.005。取ABTS自由基阳离子工作液3.9 mL与0.1 mL不同浓度的牦牛皮抗氧化肽溶液混合,充分振荡,23 ℃避光孵育6 min,测定混合溶液在波长734 nm处的吸光值Ai,无水乙醇做空白对照测得吸光值A0,VC作为阳性对照,并计算牦牛皮抗氧化肽对ABTS自由基清除率的IC50值。
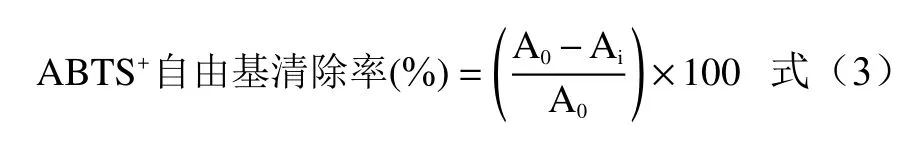
1.2.7 羟自由基清除能力的测定 采用文献[19-20]的方法做略微改进,2 mL不同质量浓度的牦牛皮抗氧化肽溶液置于10 mL具塞试管中,再加入2 mL的过氧化氢溶液(6 mmol/L)和2 mL硫酸亚铁(6 mmol/L)溶液,充分振荡后在避光处静置30 min,再向离心管中加入刚配制好的2 mL水杨酸溶液(6 mmol/L),振荡混匀,25 ℃环境下静置10 min,于510 nm处测定反应混合溶液的吸光度值Ai,空白对照用蒸馏水代替样品测得吸光度值A0,蒸馏水代替水杨酸溶液测得吸光度值为Aj,VC作为阳性对照,并计算牦牛皮抗氧化肽对羟自由基清除率的IC50值。
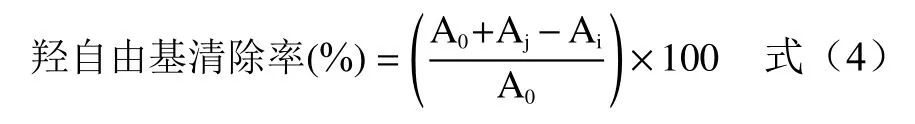
1.2.8 还原力测定 取0.2 mol/L磷酸盐缓冲液(pH6.6)2.5 mL、1%(w/v)铁氰化钾溶液 2.5 mL与不同浓度的牦牛皮抗氧化肽溶液1 mL混匀,充分振荡,50 ℃ 孵育 20 min,迅速冷却,加入 10%(w/v)三氯乙酸溶液2.5 mL混匀,充分振荡,5000 r/min离心10 min,取上层清液2.5 mL,加入蒸馏水2.5 mL及0.1%(w/v)三氯化铁溶液0.5 mL,振荡混匀,该混合物在室温下保持10 min,测定其在波长700 nm处的吸光度,VC作为阳性对照。吸光度值越大,表示水解物的还原能力越强。
1.3 数据处理
使用Design-Expert 8.0.6进行响应面设计,实验结果用Orgin 8.0和IBM SPSS Statistics 26软件进行统计分析,抗氧化活性实验中IC50值由IBM SPSS Statistics 26软件进行计算。其中P<0.05说明差异显著,P<0.01说明差异极显著。
2 结果与分析
2.1 单因素实验
2.1.1 pH对牦牛皮抗氧化肽制备的影响 如图1所示,随着pH的逐渐增加,水解度呈现出先缓慢上升后趋于平缓的变化趋势;不同pH条件下的牦牛皮抗氧化肽对DPPH自由基清除率的IC50值变化趋势与水解度相关,当溶液pH在处于7~8.5时,水解度由34.26%±0.52%增加到 35.99%±0.73%,但 pH进一步增加时,水解度不再上升、IC50值不再降低,这可能是由于碱性蛋白酶是一种一般在pH6~10时比较稳定,在低于6或高于11时会很快失活,最适作用pH范围在7~11的酶类[21]。结合图中两个指标的变化趋势说明水解度与DPPH自由基清除率的IC50值之间存在着一定的关系,一定程度上IC50值能随着水解度的增大而减小,在pH7.5~9.5的范围内,pH对牦牛皮抗氧化肽的制备没有显著性影响。在pH 8.5时,水解度能达到最大值35.99%±0.73%,IC50达到最小值为2.965 mg/mL,在牦牛皮抗氧化肽为浓度8 mg/mL时对DPPH自由基的清除率是93.83%±0.86%。故在后续实验选择pH8.5作为使用碱性蛋白酶水解牦牛皮蛋白的最佳pH。
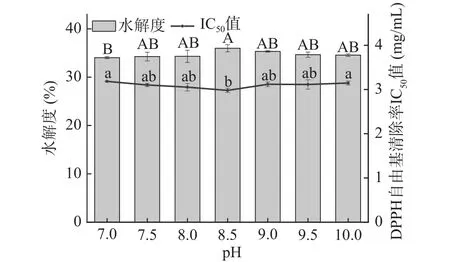
图1 pH对牦牛皮抗氧化肽的水解度及DPPH自由基清除率IC50值的影响Fig.1 Effects of pH on the DH of yak hide antioxidant peptides and the IC50 value of DPPH free radical scavenging rate
2.1.2 水解温度对牦牛皮抗氧化肽制备的影响 如图2所示,伴随水解温度逐步上升,水解度呈现出先上升后下降的变化趋势,当温度从45 ℃升高到50 ℃时,水解度随温度的升高出现最大值(P<0.05);DPPH自由基清除率的IC50值呈现出先减小后增加的变化趋势,当温度升高到50 ℃时,IC50值随温度的升高出现最小值(P<0.05)。本实验所用碱性蛋白酶的最适反应温度约为40~55 ℃,酶促反应中不同酶的最适温度不同,当低于最适温度时,酶的相关性质发生改变,催化活性受到抑制后使其对底物的水解作用降低;而当温度升到一定限度时,酶结构会发生不可逆的改变,从而失去催化活性[22]。所以在50 ℃之前,随温度增加,水解度也在显著增加(P<0.05),同时牦牛皮抗氧化肽清除DPPH自由基的IC50值也在降低,在50 ℃之后两者都出现不同程度的变化,并且大部分碱性蛋白酶多由微生物分泌的特点是耐热性不佳,加热可能会使酶活性受到损失[23]。结合图中两个指标的变化趋势说明温度在50 ℃时两个指标达到最佳,水解物在浓度8 mg/mL时,对DPPH自由基清除率为89.34%±0.82%,IC50值为3.172 mg/mL;牦牛皮水解度为30.36%±0.70%。结合实验结果,选择45 ~55 ℃作为后续响应面试验条件。
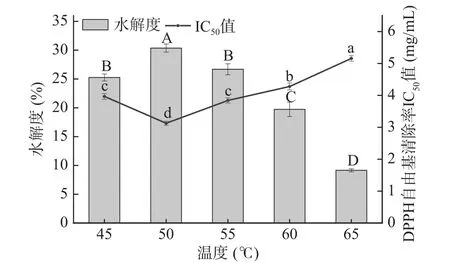
图2 温度对牦牛皮抗氧化肽的水解度及DPPH自由基清除率IC50值的影响Fig.2 Effects of temperature on the DH of yak hide antioxidant peptides and the IC50 value of DPPH free radical scavenging rate
2.1.3 酶用量对牦牛皮抗氧化肽制备的影响 如图3所示,随着酶用量从4000 U/g增加到12000 U/g,水解度呈现出先上升后趋于不变的变化走向,DPPH自由基清除率的IC50值呈现出先减小后不变的变化趋势。酶用量达到10000 U/g处,水解度出现显著提高(P<0.05)、IC50值出现显著降低(P<0.05),此时牦牛皮抗氧化肽在浓度为8 mg/mL时对DPPH自由基清除率是 95.88%±0.83%,IC50值为 3.061 mg/mL;水解度为36.82%±1.98%。在这之后随着酶用量增加到12000 U/g,对DPPH自由基清除率的IC50值和水解度趋于不变。由于在底物浓度一定的条件下,酶促反应速率会和酶浓度呈正比,伴随加酶量增加,水解反应速率加快,水不溶性的蛋白在蛋白酶的作用下逐渐被切割成小分子肽段[24]。但酶的用量超过其与底物充分反应所需数值时,随着酶用量的增加,蛋白质不发生更为强烈的水解,也不会产生更多的活性肽及活性官能团[25]。因此随着酶用量的增加,水解度呈现出先增后缓的变化趋势。结合图图中两个指标的变化趋势选择最适的酶用量为8000~12000 U/g进行后续响应面实验。
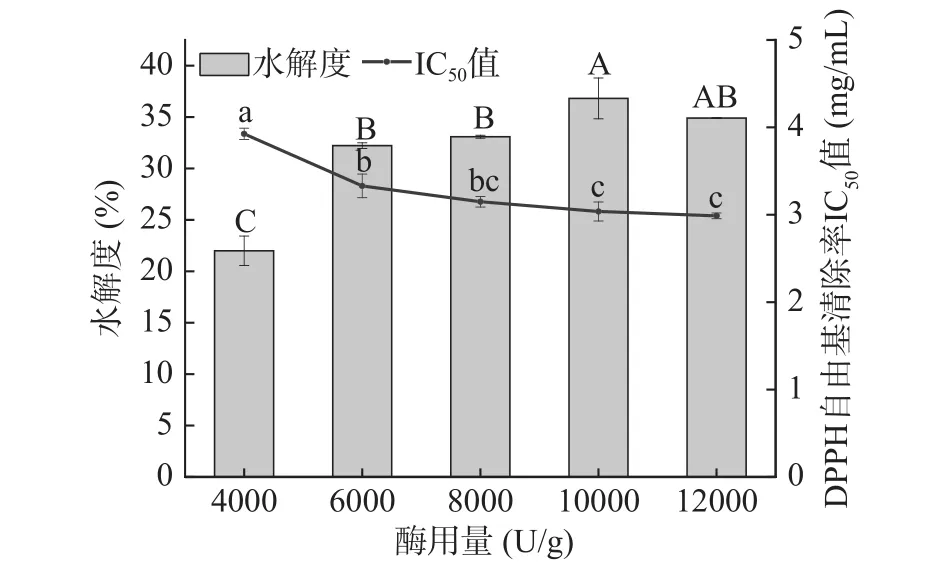
图3 酶用量对牦牛皮抗氧化肽的水解度及DPPH自由基清除率IC50值的影响Fig.3 Effects of enzyme dosage on the DH of yak hide antioxidant peptides and the IC50 value of DPPH free radical scavenging rate
2.1.4 底物浓度对牦牛皮抗氧化肽制备的影响 如图4所示,随底物浓度的增加,水解度呈现出缓慢增大后缓慢减小变化趋势,在4%~7%内差异不太明显;从图4中可以看出牦牛皮抗氧化肽在不同的底物浓度下,DPPH自由基清除率的IC50值呈现出先减小后趋于不变的走向。在底物浓度为5%时,两者都达到最佳,牦牛皮抗氧化肽在浓度8 mg/mL时对DPPH自由基清除率达到93.41%±0.86%,IC50值为2.936 mg/mL;水解度为35.25%±1.71%,但当底物浓度进一步增加时,两者趋于不变。可能是由于酶与底物的接触机率随底物浓度的增加可扩大,充分发挥碱性蛋白酶对牦牛皮蛋白的水解作用,产生数量更多的抗氧化物质;底物浓度不停增大时,在超越了酶的作用范围后,酶对牦牛皮蛋白的水解作用及水解程度均不同程度的受到限制而减弱,使得水解物的抗氧化活性及水解度出现降低现象[26]。结合图中两个指标的变化趋势,在底物浓度4%~6%范围内,对牦牛皮抗氧化肽的制备工艺无显著性影响(P>0.05),但在底物浓度为5%时水解度与IC50值能取得最佳值,故选择最佳底物浓度5%作为后续实验条件。
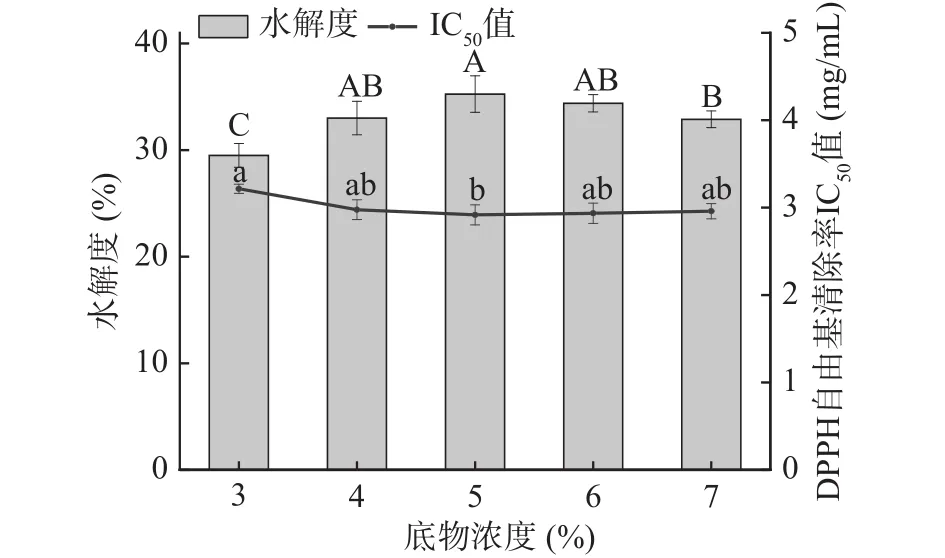
图4 底物浓度对牦牛皮抗氧化肽的水解度及DPPH自由基清除率IC50值的影响Fig.4 Effects of substrate concentration on the DH of yak hide antioxidant peptides and the IC50 value of DPPH free radical scavenging rate
2.1.5 水解时间对牦牛皮抗氧化肽制备的影响 如图5所示,随时间的增加,水解度呈现先增加后趋于不变的变化趋势,对水解度(DH)的影响比较显著(P<0.05);牦牛皮抗氧化肽在不同的时间下,DPPH自由基清除率的IC50值呈现出先减小后趋于不变的走向。水解时间从4 h增加到10 h时,两个指标随时间出现不同程度的变化,在此之后随时间的增加,两者趋于平缓不变。水解时间不断增加,酶对底物的水解作用更充分,会产生更多的肽片段和氨基酸残基,因此水解度会出现较大幅度的增加;同时水解物中产生了更多的抗氧化物质,故而呈现出更高的自由基清除活性。但是多肽的抗氧化活性与其肽段长度、构象以及氨基酸组成等因素有关[27]。随水解时间的增加,酶的持续水解会影响牦牛皮蛋白水解产物中的肽段氨基酸组成和构象,深度水解会破坏抗氧化肽的结构从而会影响到水解物的抗氧化活性[28]。结合图中两个指标的变化趋势,在水解时间为10 h时,两者都达到最佳值,牦牛皮抗氧化肽在浓度8 mg/mL时对DPPH自由基清除率达到95.62%±2.37%,IC50值为2.979 mg/mL;牦牛皮水解度为37.31%±0.23%。不同的水解时间对牦牛皮抗氧化肽的制备工艺影响较明显,因此,选取水解时间8~12 h进行后续响应面实验。
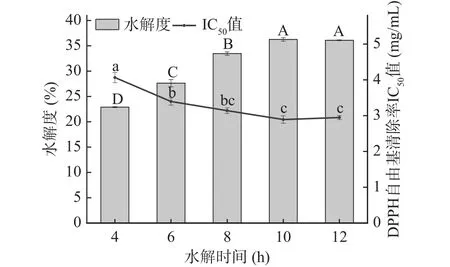
图5 水解时间对牦牛皮抗氧化肽的水解度及DPPH自由基清除率IC50值的影响Fig.5 Effects of hydrolysis time on the DH of yak hide antioxidant peptides and the IC50 value of DPPH free radical scavenging rate
2.2 响应面优化试验
2.2.1 响应面设计及结果 根据单因素的实验结果,选择A(水解温度)、B(酶用量)和C(水解时间)这3个单因素为自变量,酶解后的水解度(DH)和对DPPH自由基清除率的IC50值为响应值,使用Box-Behnken进行试验设计,相应的响应面试验设计方案及结果见表2。
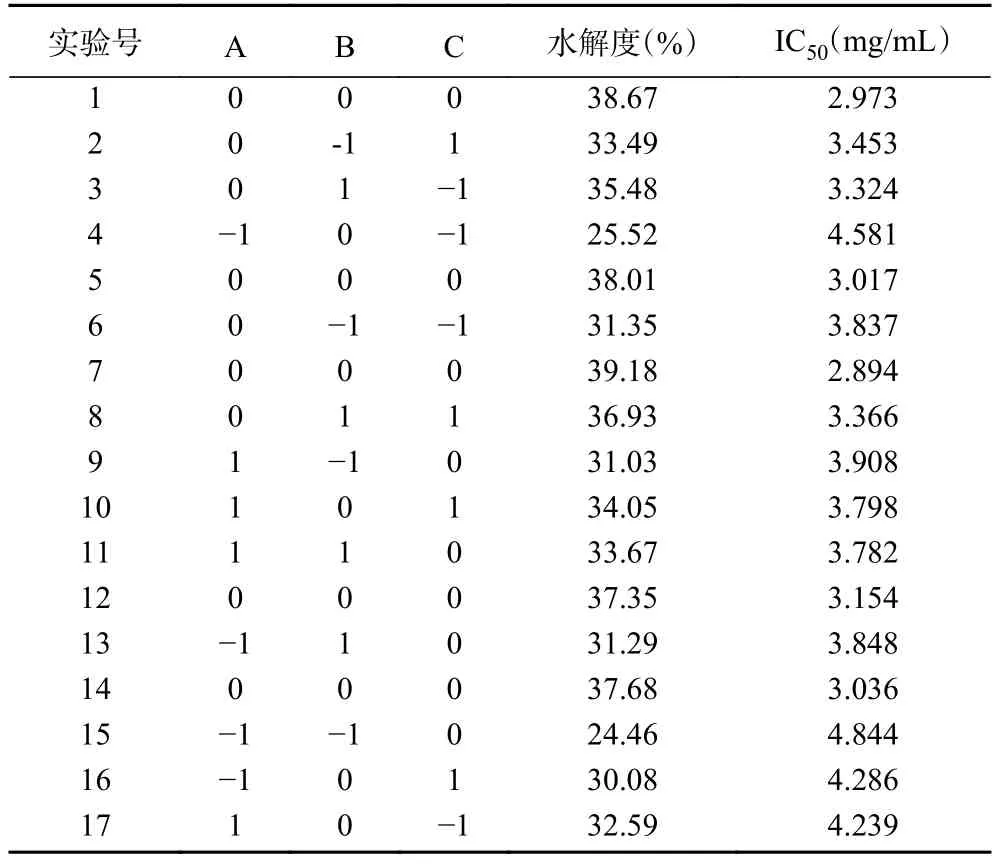
表2 响应面试验设计方案及结果Table 2 Experimental design and results of response surface analysis
2.2.2 响应面模型的建立与分析 运用Design Expert 8.06软件对数据分析并进行多元回归拟合,以温度、酶用量和时间三个单因素为自变量,以水解度为响应面响应值,得到的二元回归方程为:Y1=38.18+2.50A+2.13B+1.20C-1.05AB-0.78AC-0.17BC-5.91A2-2.16B2-1.71C2;以牦牛皮抗氧化肽清除DPPH自由基的IC50值为响应面响应值,得到的二元回归方程为:Y2=3.01-0.23A-0.22B-0.13C+0.22AB-0.036AC+0.11BC+0.91A2+0.17B2+0.32C2。方差分析结果见表3、表4。
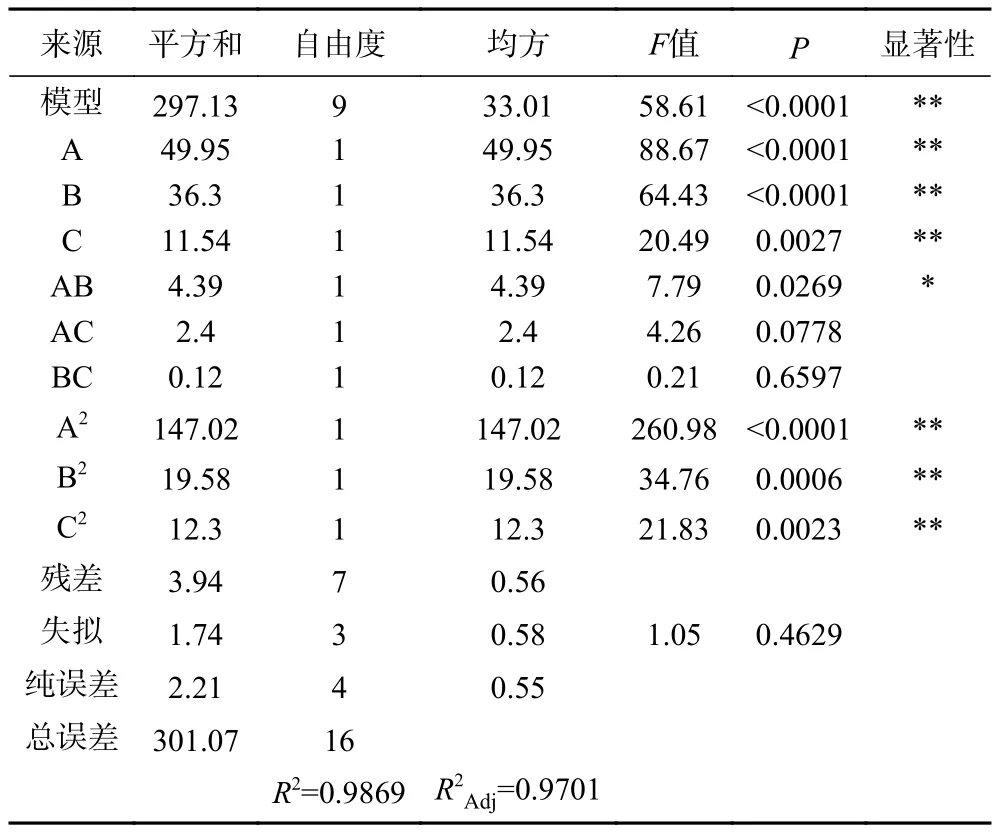
表3 水解度回归模型方差分析Table 3 Analysis of variance of hydrolysis degree regression model
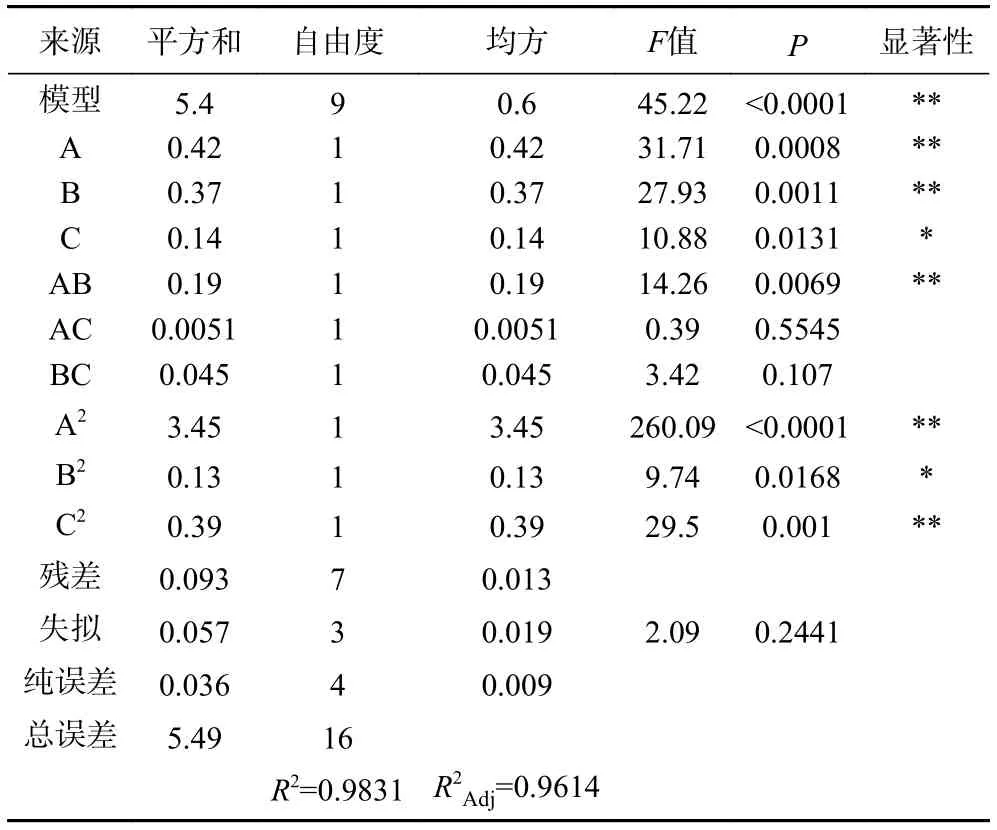
表4 DPPH自由基清除率IC50值回归模型方差分析Table 4 Analysis of variance of DPPH free radical scavenging rate IC50 value regression model
由表3可知水解度的回归模型F值为58.61,P<0.01,失拟项P=0.4629>0.05,说明所得模型极显著,模型失拟项不显著,得到的回归方程的拟合度较高;模型决定系数R2=0.9869,调整系数R2Adj=0.9701,说明该模型可以解释97.01%的响应值变化,该模型的水解度的实测值和预测值良好,回归方程可以用来分析与预测酶法水解制备牦牛皮抗氧化肽的工艺结果。同时模型中A、B、C、A2、B2和C2对水解度都有极显著的影响(P<0.01),AB对水解度的影响显著(P<0.05),其余不显著(P>0.05)。通过方差分析中F值的大小可评价各因素对指标的影响程度,F值越大影响越显著[29]。因此对工艺的影响顺序依次为:水解温度>酶用量>水解时间。
由表4可知牦牛皮抗氧化肽清除DPPH自由基IC50值的回归模型F值为45.22,P<0.01,失拟项P=0.2441>0.05,说明所得模型极显著,模型失拟项不显著,得到的回归方程的拟合度较高;模型相关系数R2=0.9831,调整系数R2Adj=0.9614,说明该模型可以解释96.14%的响应值变化,该模型的牦牛皮抗氧化肽清除DPPH自由基IC50值的实测值和预测值良好,所得的回归方程可以用于分析与预测酶法水解制备牦牛皮抗氧化肽的工艺结果。模型中A、B、AB、A2、C2对牦牛皮抗氧化肽清除DPPH自由基IC50值都有极显著的影响(P<0.01),C和B2对牦牛皮水解物的DPPH自由基清除率IC50值影响显著(P<0.05)。依据F值大小能够得出对工艺的影响顺序依次为:温度>酶用量>时间。
2.2.3 响应面各因素交互作用分析 响应曲面坡度和凹凸程度能够反映各因素对牦牛皮抗氧化肽提取的影响大小[30],三维响应面的坡度陡峭和曲率越大则说明两因素的交互作用对响应值的影响显著,如果坡度相对比较平缓,则表示当两因素的交互作用对响应值变化影响较小[31-32]。两因素之间的交互作用对响应值的影响如图6所示。由图6a~图6c可以看出,图6a响应曲面陡峭,等高线密集,说明温度与酶用量的交互作用对响应值的影响显著。在因素水平范围内温度和酶用量交互作用的显著程度大于时间与温度和时间与酶用量。从图6d~图6f响应面的坡度与等高线的密集程度可知,温度和酶用量的交互作用对响应值的影响相对于温度与时间、酶用量与时间的交互作用更为显著。
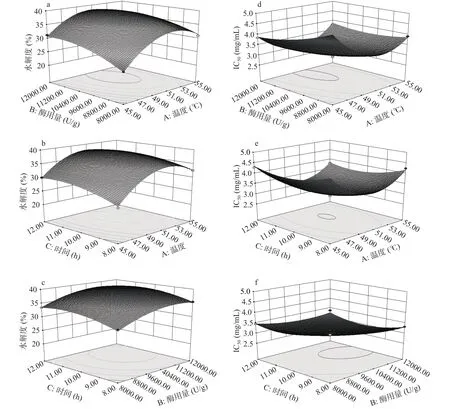
图6 各因素交互对水解度及对DPPH自由基清除率IC50值影响的响应面图Fig.6 Response surface diagram of the interaction of various factors on the degree of hydrolysis and the IC50 value of DPPH radical scavenging rate
2.2.4 最佳工艺条件确定及验证 利用Design-Expert 8.0.6软件分析回归模型,得到水解牦牛皮抗氧化肽的最佳工艺条件为:水解温度50.77 ℃,酶用量10889.68 U/g,水解时间10.59 h。为进一步确定最佳工艺,结合单因素实验结果对试验参数进行进一步优化,得到的实际最佳工艺为:水解温度51 ℃,酶用量 10890 U/g,水解时间 10.6 h,pH8.5,底物浓度5%。预测的水解度为39.02%、清除DPPH自由基的IC50值为2.953 mg/mL。进行三次验证试验,得到实际水解度为41.39%±0.69%,与预测值相差5.73%;牦牛皮抗氧化肽清除DPPH自由基的IC50值为2.884 mg/mL,与预测值相差2.34%,牦牛皮抗氧化肽浓度为8 mg/mL时,对DPPH自由基清除率达到92.73%±0.47%。两者实测值均接近预测值,说明该响应面模型得到的参数可靠。
2.3 牦牛皮抗氧化肽体外抗氧化活性
2.3.1 DPPH自由基清除能力 从图7a中可知,VC对DPPH 自由基有显著清除作用(P<0.05) ,VC水溶液在1~12 mg/mL范围内各浓度之间对DPPH自由基清除率无显著性差异(P>0.05);与VC相比牦牛皮抗氧化肽对DPPH自由基有较好的清除活性,在浓度为8~12 mg/mL时清除率比较接近VC,并且不再增加(P>0.05)。牦牛皮抗氧化肽浓度为8 mg/mL时达到最大DPPH自由基清除率,为92.73%±0.47%,其清除DPPH自由基的IC50值为2.884 mg/mL,根据从动物中提取的抗氧化肽清除DPPH自由基的IC50值来看,海参性腺水解物IC50为3.39 mg/mL[33]、南极磷虾多肽IC50为5.65 mg/mL[34]、猪肩胛骨酶解液IC50为4.59 mg/mL[35],对比结合本实验所得牦牛皮抗氧化肽的DPPH自由基清除率IC50值,可以表明其具有较好的抗氧化活性。
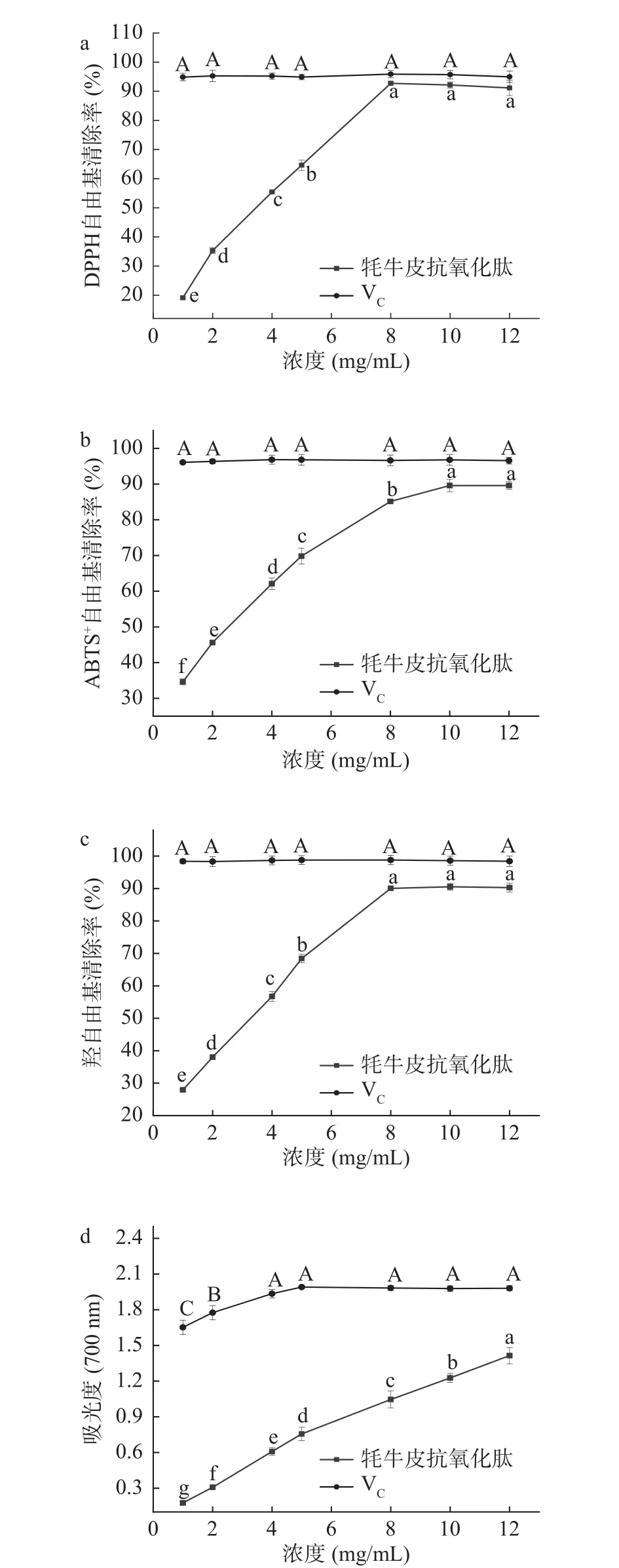
图7 不同浓度下牦牛皮抗氧化肽的体外抗氧化能力Fig.7 Antioxidant capacity of yak hide antioxidant peptides in vitro at different concentrations
2.3.2 ABTS+自由基清除能力 由图7b可知,VC对ABTS+自由基有显著清除作用,VC水溶液在1~12 mg/mL范围内各浓度之间对ABTS+自由基清除率无显著性差异(P>0.05);与VC相比,牦牛皮抗氧化肽对ABTS+自由基有较好的清除活性,在浓度为1~10 mg/mL时,清除率随浓度的增加出现明显增长(P<0.05),呈现出剂量-效应关系,并在浓度为 10~12 mg/mL 时清除率趋于平缓,不再增加(P>0.05),牦牛皮抗氧化肽浓度为10 mg/mL时,最大ABTS+自由基清除率为89.58%±1.11%,其清除ABTS+自由基的IC50值为2.110 mg/mL。
2.3.3 羟自由基清除能力 由图7c可知,VC对羟自由基有显著的清除作用,VC水溶液在1~12 mg/mL范围内各浓度之间对羟自由基清除率无显著性差异(P>0.05);与VC相比牦牛皮抗氧化肽对羟自由基有较强的清除活性,在浓度从1增加到8 mg/mL时清除率随浓度的增加出现显著增长(P<0.05),呈现出明显的剂量-效应关系,并在浓度为10~12 mg/mL时趋于不变,无显著性差异(P>0.05),在牦牛皮抗氧化肽浓度为8 mg/mL时达到最大清除率90.05%±0.13%,其清除羟自由基的IC50值为2.523 mg/mL。
2.3.4 还原能力 由图7d可知,VC水溶液在 1~5 mg/mL范围内的吸光度值出现显著上升(P<0.05),5 mg/mL之后吸光度值不再增加,各浓度之间无显著性差异(P>0.05);与VC相比牦牛皮抗氧化肽的还原能力,在浓度从1 mg/mL增加到12 mg/mL时吸光度值随浓度的增加呈现显著上升趋势(P<0.05),说明随浓度增加反应体系中普鲁士蓝的生成量在增多,也能说明牦牛皮抗氧化肽具有一定的还原能力。
3 结论
本实验以牦牛皮蛋白为原料,在单因素实验基础上,结合响应面法建立酶法水解牦牛皮蛋白制备抗氧化肽工艺的回归模型,所得到的模型显著,回归方程拟合度较好。并通过对回归方程的分析解决多变量问题,寻找最佳水解工艺,经分析两者对水解工艺的影响程度均为:温度>酶用量>时间。得到的最佳水解工艺为:水解温度51 ℃,酶用量10890 U/g,水解时间10.6 h,pH8.5,底物浓度5%,此工艺条件下的实际水解度为41.39%±0.69%、对DPPH自由基清除率IC50值为2.884 mg/mL,水解物浓度8 mg/mL时对DPPH自由基清除率达到92.73%±0.47%,与预测值接近,表明通过响应面分析得到的回归方程能较好地预测试验结果。
通过体外的抗氧化活性实验,牦牛皮抗氧化肽对DPPH·、ABTS+·和羟自由基的清除率的 IC50值分别为2.884、2.110、2.523 mg/mL,并且还原能力也较强,这可以表明提取的牦牛皮抗氧化肽具有良好的抗氧化能力,可以作为天然抗氧化肽的原料来源。

