点柄乳牛肝菌多糖的结构表征及其免疫调节活性的研究
祁嘉仪,曾冉华,陈忠正,林晓蓉,张玉婷,吴吉莉,高 雄 ,李 斌,
(1.华南农业大学食品学院, 广东广州 510642;2.广东省科学院微生物研究所, 华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室, 广东广州 510070)
免疫调节是机体识别和排除抗原性异物,维持自身动态平衡的生理功能,是各种药理作用的基础[1]。而巨噬细胞是免疫调节中重要的效应细胞,被认为是评价免疫调节活性的细胞模型[2]。大量研究证实,真菌多糖是天然的免疫调节剂,具有激活巨噬细胞,治疗免疫抑制小鼠的免疫调节活性[3-5],其生物活性与分子量、单糖组成、糖苷键、链构象等密切相关[6]。
点柄乳牛肝菌(Suillus granulatus)属牛肝菌目、乳牛肝菌科、外生菌根真菌,通常与油松共生,广泛分布于云南、吉林、黑龙江、西藏等地[7]。作为一种味道鲜美的食用菌,其富含多糖、蛋白质等营养成分,深受世界各地消费者的喜爱。据民间记载,其还有清热解毒,治疗感冒咳嗽、食积腹胀等功效[8]。现有的研究已发现,点柄乳牛肝菌具有抗肿瘤、抗氧化、抗HIV病毒等多种生物活性[9-12]。多糖的结构是其生物活性的基础,而普遍研究指出真菌多糖是天然的免疫调节剂,但点柄乳牛肝菌目前相关研究主要集中在生态学以及小分子化合物方面,而对其多糖的结构特性和免疫调节活性机制还鲜有报道。
为此,本研究从点柄乳牛肝菌中分离纯化出SGP3-1和SGP3-2两种多糖,表征其结构特性,并利用小鼠单核巨噬细胞RAW264.7模型,阐释其体外免疫调节活性,以期为点柄乳牛肝菌多糖开发、资源的综合利用提供一定的科学研究基础。
1 材料与方法
1.1 材料与仪器
点柄乳牛肝菌 黑龙江省宁安市北域珍奇山林食品有限公司,由广东省科学院微生物研究所胡惠萍高级工程师鉴定;小鼠单核巨噬细胞RAW264.7(活力>95%) 美国典型培养物保藏中心;杜氏磷酸缓冲液(DPBS)、杜氏改良高糖培养基(DMEM)、青霉素-链霉素溶液、胎牛血清(FBS)、中性红(0.33%)、BCA蛋白定量试剂盒、RIPA缓冲液、Bis-Tris预制胶、MOPS SDS电泳缓冲液(20×)、转印缓冲液(20×)、预染蛋白、脱脂奶粉、增强化学发光试剂美国Thermo Scientific公司;刚果红 中国北京索莱宝科技有限公司;Bradford蛋白浓度测定试剂盒(P006) 中国碧云天生物技术有限公司;5×蛋白上样缓冲液、10×TBST漂洗液 中国生工生物工程(上海)股份有限公司;CCK-8试剂盒、蛋白酶抑制剂、磷酸化蛋白酶抑制剂 美国MedChemexpress生物科技公司;一抗 TLR4、TLR2、p-NFκB p65、NFκB p65、p-JNK、JNK、p-p38、p38、p-Akt、GAPDH、辣根过氧化物酶标记的兔抗体 美国Cell Signaling Technology公司;一抗 ERK、p-ERK、Akt 美国Affinity Biosciences公司;IL-6、TNF-αELISA 试剂盒 中国深圳欣博盛生物科技有限公司;DEAE-琼脂糖凝胶(DEAE-Sepharose Fast Flow)、丙烯葡聚糖凝胶(Sephacryl S-300 HR) 美国 GE Healthcare Life Science公司;单糖标准品(鼠李糖、核糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、葡萄糖醛酸和半乳糖醛酸)、磺胺、牛血清蛋白、N-(1-萘基)乙二胺二盐碱、脂多糖(LPS) 美国Sigma公司。
BT25S电子天平 瑞士Mettle Toledo公司;Alpha 1-2LD plus 冷冻干燥机 德国Martin Christ公司;5804R冷冻离心机 德国Eppendorf公司;Omega-Lum G化学发光仪 美国Aplegen公司;BG-Power 600电泳仪 中国北京百晶生物技术有限公司;U-2910型分光光度计 日本日立有限公司;电转槽美国Bio-Rad公司;UV-2102C紫外可见分光光度计
中国上海尤尼科有限公司;HERA cell 150i CO2培养箱 美国Thermo Scientific公司;X射线多晶粉末仪 美国Rigaku公司;Vertex70光谱仪、核磁共振波谱仪(Avance II 600 MHz) 德国布鲁克公司;金属浴 中国杭州奥盛仪器有限公司;Milipore-Q超纯水机 德国Milipore公司;Agilent 1200高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 点柄乳牛肝菌多糖的制备
1.2.1.1 点柄乳牛肝菌多糖的提取 参考Yang等的方法[13],将点柄乳牛肝菌粉碎,称取100 g过筛80目的粉末,加入2 L 95%乙醇在75 ℃条件下提取2 h,重复 2次。滤渣干燥后,加入超纯水(1:20,w/v)在90 °C下提取2 h,重复3次。合并3次滤液,使用旋转蒸发仪在60 °C条件下减压浓缩,浓缩液用4倍体积的无水乙醇混匀后,在4 ℃下静置16 h后,6000 r/min、15 ℃条件下离心10 min,获得的沉淀用超纯水复溶,Sevage试剂(氯仿:正丁醇,4:1)除蛋白,将上层多糖溶液用3500 Da的透析袋透析72 h,冷冻干燥,获得点柄乳牛肝菌粗多糖。
1.2.1.2 点柄乳牛肝菌多糖的分离纯化 利用DEAE离子交换柱和葡聚糖凝胶析对点柄乳牛肝菌粗多糖进行分离纯化。用8 mL超纯水溶解180 mg粗多糖过DEAE-Sepharose fast flow层析柱(2.6 cm×30 cm),采用0~0.5 mol/L NaCl溶液洗脱,流速为2.5 mL/min,苯酚硫酸法检测洗脱液多糖含量。将0.2 mol/L的多糖组分进一步采用Sephacryl S-300 HR凝胶渗透柱(1.6 cm×50 cm)纯化,流速为 1.0 mL/min,苯酚硫酸法检测洗脱液多糖含量。
1.2.2 点柄乳牛肝菌多糖的结构表征
1.2.2.1 理化成分测定 碳水化合物含量用苯酚-硫酸法测定,取样品加入6%苯酚和浓硫酸中混匀,冰上静置3 min,沸水浴10 min,测定490 nm处的吸光值,以葡萄糖为标准[14]。蛋白质含量用考马斯亮蓝法测定,按照Bradford蛋白浓度测定试剂盒(P006)说明书进行测定,以牛血清白蛋白作为标准[15]。
1.2.2.2 重均分子量测定 参考Liao等的方法[16],用高效渗透凝胶色谱法分析多糖样品的重均分子量分布,将多糖样品与不同重均分子量的葡聚糖标准品(5.2、11.6、23.8、48.6、148、273、410和 668 kDa)用100 mmol/L NaNO3溶液溶解,设置柱温为35 ℃,流速为0.4 mL/min,分析SGP3-1和SGP3-2的重均分子量(Mw)。
1.2.2.3 单糖组成分析 参考Niu等的方法[17],取2 mg多糖样品,用1 mL三氟乙酸溶解,100 ℃下水解6 h,然后用0.5 mol/L PMP衍生化。PMP衍生物在Agilent 1200系列HPLC系统(G1322A脱气器,G1311A Quat泵,G1329A ALS 进样器,G1315D DAD检测器)上进行分析,单糖标准品(鼠李糖、核糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、葡萄糖醛酸和半乳糖醛酸)进行同样处理后上机检测。
色谱柱:Eclipse XDB-C18色谱柱(250 mm×4.6 mm×5 μm,美国 Agilent公司),检测温度:30 ℃,检测波长:250 nm,流速:0.8 mL/min,流动相:磷酸缓冲液(0.1 mol/L,pH6.5)和乙腈(84:16,v/v)的混合物。
1.2.2.4 傅里叶红外变换光谱分析 取适量多糖样品与溴化钾混合研磨压片,在Vertex 70光谱仪中进行红外扫描,扫描波数范围为4000~400 cm-1。
1.2.2.5 X-射线衍射分析 根据Schokker等的方法并加以改进[18],利用X射线多晶粉末仪分析多糖样品的X射线衍射图谱,设定条件为:管流40 mA,管压 40 kV,速率 5°/min,2θ 角扫描范围在 10°~90°。
1.2.2.6 刚果红实验 参考Hu等的方法[19],取0.25 mL多糖溶液(1 mg/mL)与 0.5 mL 刚果红(80 μmol/L)混合,滴加0.25 mL NaOH溶液,使其终浓度依次为0、0.05、0.10、0.20、0.30、0.40、0.50 mol/L,反应体系避光放置10 min后,U-2910分光光度计测定反应溶液的最大吸收波长,对照组以超纯水替代多糖溶液。
1.2.2.7 核磁共振波谱分析 取40 mg多糖样品溶解于0.5 mL氘代水中,使用600 MHz核磁共振光谱仪记录1H-NMR和13C-NMR。
1.2.3 SGP3-1和SGP3-2的免疫调节活性研究
1.2.3.1 细胞增殖活性测定 将RAW264.7细胞(2.5×105个/mL)接种到96 孔板,每孔200 μL,在37 ℃、5% CO2培养箱中培养24 h,小心弃去旧培养液,加入用含血清培养基溶解的不同浓度多糖溶液(5、10、20、40、80、160 μg/mL)及阳性对照 LPS(100 ng/mL),处理24 h后,弃去旧培养基,参考试剂盒说明书,每孔加入200 μL含CCK8的无血清培养基,37 ℃孵育2 h,酶标仪测量450 nm处的吸光值。
1.2.3.2 细胞吞噬活性测定 细胞培养、接种方式同1.2.2.1,在37 ℃、5% CO2的培养箱中静置培养3 h,加入不同浓度多糖溶液(5、10、20、40 μg/mL)及LPS(100 ng/mL)。处理24 h后,小心吸出旧培养基,加入100 μL DPBS配制的中性红溶液(0.1%),在37 ℃、5% CO2培养箱中培养1 h,吸除上清,DPBS洗板3次,加入100 μL冰乙酸-无水乙醇混合溶液(1:1,v/v)裂解细胞,25 ℃ 静置 2 h 后,酶标仪测量540 nm处的吸光值。
1.2.3.3 NO、TNF-α及IL-6含量测定 将RAW264.7细胞(5×105个/mL)接种到96孔板中,加样方式同1.2.2.2,与细胞共培养24 h后,收集细胞上清液,根据Griess试剂法测定细胞上清液中亚硝酸盐含量,反映NO的产生量,按照ELISA试剂盒说明书,测定细胞上清液中IL-6和TNF-α的含量。
1.2.3.4 Western blot检测免疫调节信号通路相关蛋白 将RAW264.7细胞(5×105个/mL)接种到60 mm的培养皿中,于37 ℃、5% CO2培养箱培养24 h,对照组仅加入培养基,其他各组分别加入SGP3-1(40 μg/mL)、SGP3-2(40 μg/mL)以及LPS(100 ng/mL)样品,37 ℃、5% CO2培养箱中孵育 30 min,加入RIPA裂解液(含蛋白酶抑制剂、磷酸化蛋白酶抑制剂)充分裂解细胞,14000 ×g离心10 min,吸取上清即为细胞总蛋白,按照美国Thermo Scientific公司的Pierce BCA蛋白检测试剂盒说明书测定总蛋白含量,将细胞总蛋白与上样缓冲液按4:1的体积比混合,金属浴95 ℃加热10 min,冷却后,取40 μg蛋白样品在Bis-Tris聚丙烯酰胺凝上电泳(200 V,50 min),将凝胶上蛋白转印至PVDF膜,PVDF膜置于含5%脱脂奶粉的TBST缓冲液中室温封闭1 h,置于一抗(p-NFκB p65、NFκB p65、p-JNK、JNK、p-p38、p38、p-ERK、ERK、p-Akt、Akt、GAPDH)中 4 ℃ 孵育过夜,洗膜后加入辣根过氧化物酶标记的二抗室温孵育1 h,最后通过ECL化学发光液显影,Omega Lum G成像系统拍照并记录结果。
1.3 数据处理与分析 所有实验平行3次,重复2~3次,图表数据以平均值±标准偏差表示,采用Origin 9.0软件绘图,FluorChem 5500进行蛋白条带光密度值分析,SAS 9.2统计软件进行ANOVA方差分析,P<0.05表示统计学差异显著。
2 结果与分析
2.1 点柄乳牛肝菌多糖的制备
经过系列提取分离后,利用Sephacryl S-300 HR凝胶柱进一步纯化SGP3,由图1可知,Sephacryl S-300 HR凝胶柱洗脱后出现两个多糖峰,依次命名为 SGP3-1、SGP3-2。
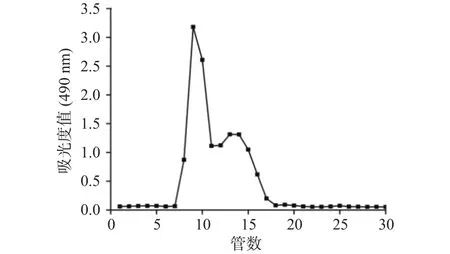
图1 SGP3-1和SGP3-2的Sephacryl S-300 HR柱洗脱图Fig.1 Elution diagram of Sephacryl S-300 HR column of SGP3-1 and SGP3-2
2.2 SGP3-1和SGP3-2的结构特性分析
2.2.1 SGP3-1和SGP3-2的理化成分及重均分子量分析 经苯酚硫酸法、考马斯亮蓝法测定分离得到的点柄乳牛肝菌多糖SGP3-1和SGP3-2的理化特性组成,经高效渗透凝胶色谱法测定SGP3-1和SGP3-2的分子量分布情况如表1所示。点柄乳牛肝菌分离纯化的SGP3-1和SGP3-2多糖含量相似,且其蛋白质含量极少,说明蛋白质几乎被去除。HPGPC法测得SGP3-1和SGP3-2的重均分子量分别为170.48和14.52 kDa,表明SGP3中含有两个不同重均分子量的均一多糖组分。
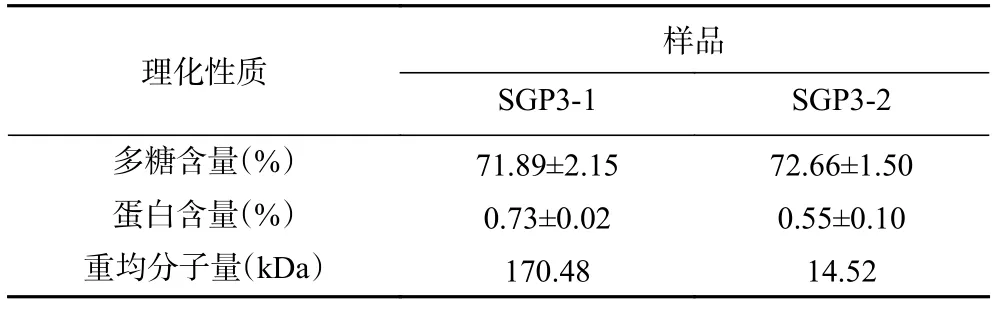
表1 SGP3-1和SGP3-2的理化性质Table 1 Physicochemical properties of SGP3-1 and SGP3-2
2.2.2 SGP3-1和SGP3-2的单糖组成分析 本实验利用PMP柱前衍生法测定2个多糖组分的单糖组成,从图2可以看出,SGP3-1主要由葡萄糖(55.47%)、甘露糖(20.63%)和半乳糖(14.04%)组成;SGP3-2主要由葡萄糖(82.43%)和甘露糖(7.45%)组成,表明SGP3-1和SGP3-2的主要单糖组成均为葡萄糖,但二者的单糖组成及其摩尔比存在差异。另外,SGP3-1和SGP3-2的葡萄糖醛酸含量分别为2.34%和5.28%,说明二者是酸性多糖。
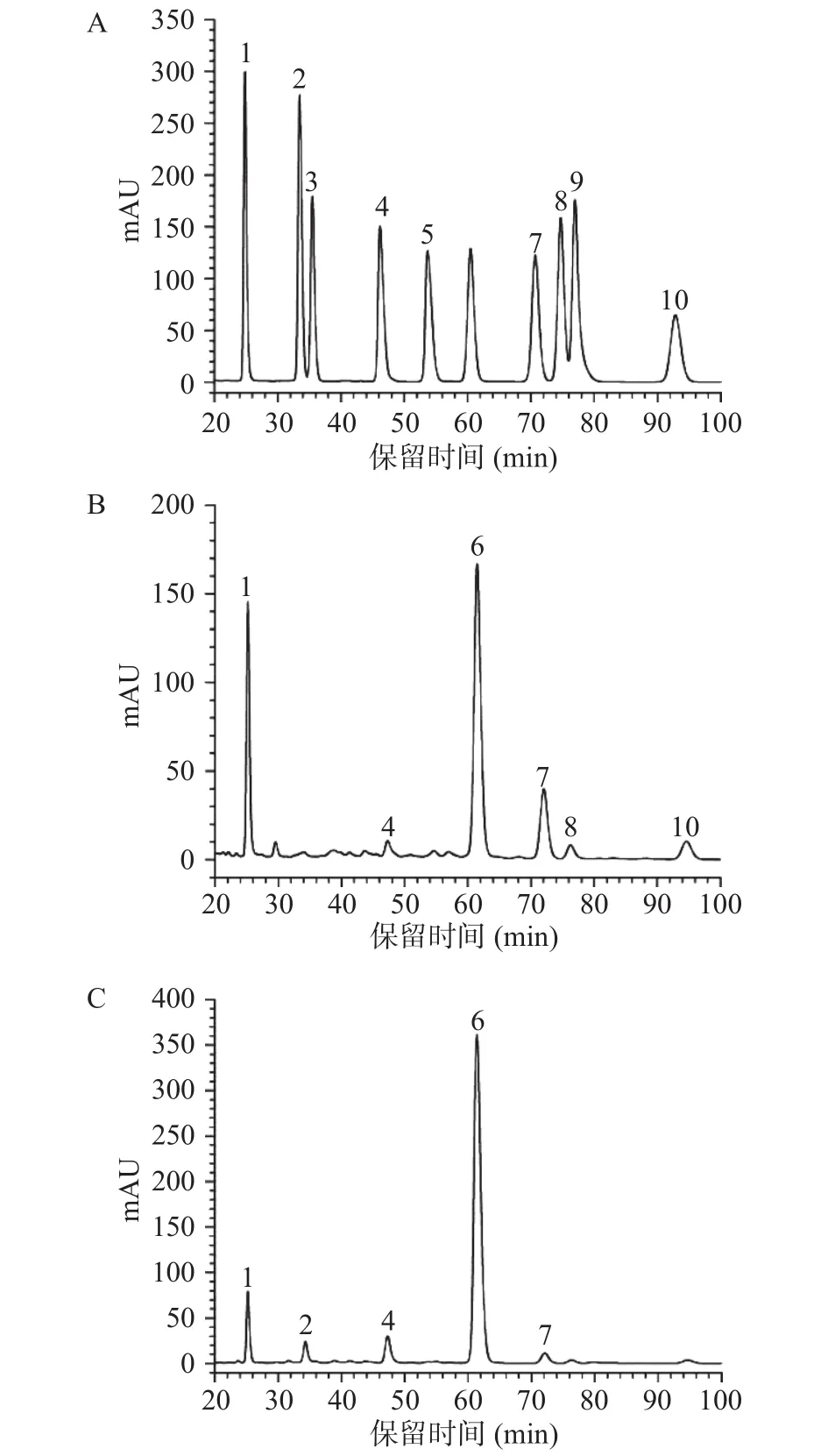
图2 单糖组成液相色谱图Fig.2 Monosaccharide composition liquid chromatogram analyzed by HPLC
2.2.3 SGP3-1和SGP3-2的红外光谱分析 利用傅里叶红外光谱分析多糖的官能团及糖苷键组成。如图3所示,SGP3-1和SGP3-2的主要特征吸收峰基本一致,3392.14 cm-1为氢键缔合的羟基伸缩振动吸收峰,2922.07 cm-1是由CH3或CH2的C-H键伸缩振动所致[20],1724.43和1615.14 cm-1可能分别为羧酸基和结合水的特征吸收峰[21-22],SGP3-2在1724.43 cm-1处的吸收强度高于SGP3-1,说明SGP3-2的糖醛酸含量高于SGP3-1,这与单糖组成分析结果一致。1000~1200 cm-1范围内的三个特征吸收峰1161.28、1074、1045 cm-1表明存在吡喃糖环结构[23-24],在 900.43和 825.43 cm-1分别为β-糖苷键和α-糖苷键的特征吸收峰,表明SGP3-1结构以α-糖苷键为主,而 SGP3-2以β-糖苷键为主[25-26]。上述官能团分析结果说明SGP3-1和SGP3-2具有典型的多糖结构特征。
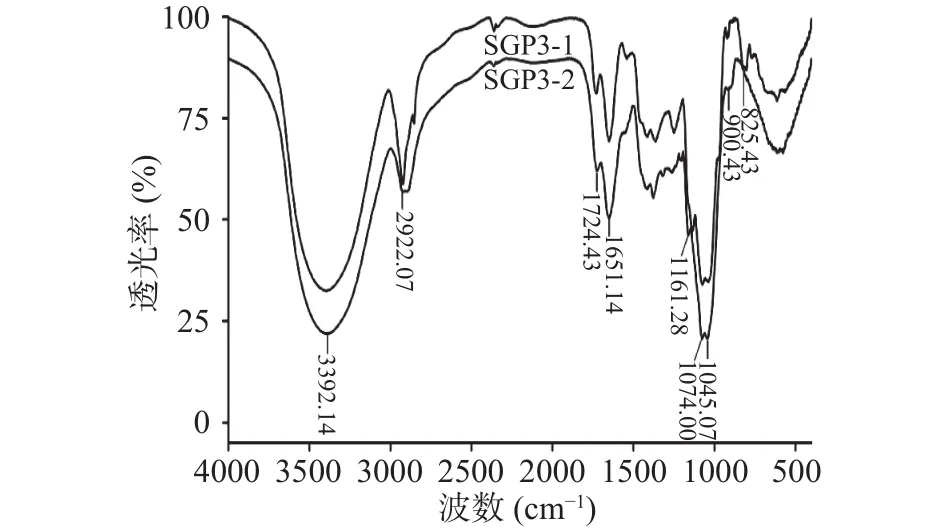
图3 SGP3-1和SGP3-2的傅里叶变换红外光谱图Fig.3 FT-IR spectra of SGP3-1 and SGP3-2
2.2.4 SGP3-1和SGP3-2的晶型分析 利用X-射线衍射分析多糖的晶体构型,结果如图4所示。SGP3-1和SGP3-2的X射线衍射强度曲线基本一致,在2θ角为20°附近出现较弱且峰型圆钝的衍射峰,说明这两种多糖均以非定型的结晶态存在。SGP3-1和SGP3-2的晶型结构推测是由于多糖结构属于柔性结构,因而不易形成单晶[27]。
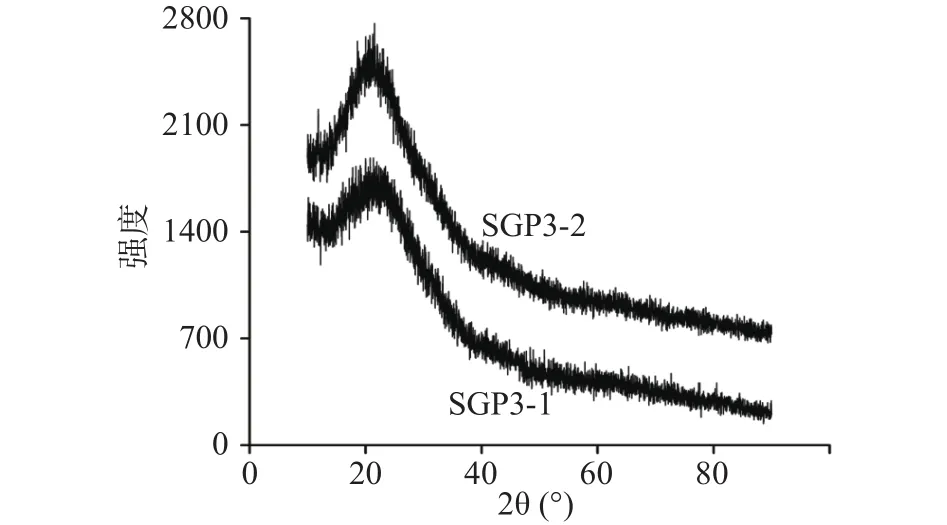
图4 SGP3-1和SGP3-2的X射线衍射图Fig.4 XRD spectra of SGP3-1 and SGP3-2
2.2.5 SGP3-1和SGP3-2的刚果红分析 利用刚果红试剂分析多糖的三螺旋结构,在一定NaOH浓度范围内,刚果红可与具有三螺旋结构的多糖形成络合物,与刚果红溶液相比,络合物的最大吸收波长发生红移,以此可鉴定多糖中是否存在三螺旋结构。如图5所示,随着NaOH浓度的增加,刚果红与SGP3-1或SGP3-2混合溶液的最大吸收波长均逐渐降低,与未添加多糖的刚果红溶液空白组下降趋势相同,说明这两种多糖与刚果红溶液反应后未发生红移现象,可推测SGP3-1和SGP3-2不存在三螺旋结构。先前研究者报道的猴头菇多糖、黑木耳多糖、杏鲍菇多糖等食用菌多糖中[24,28],同样不具有三螺旋结构,但仍具有较强的生物活性。
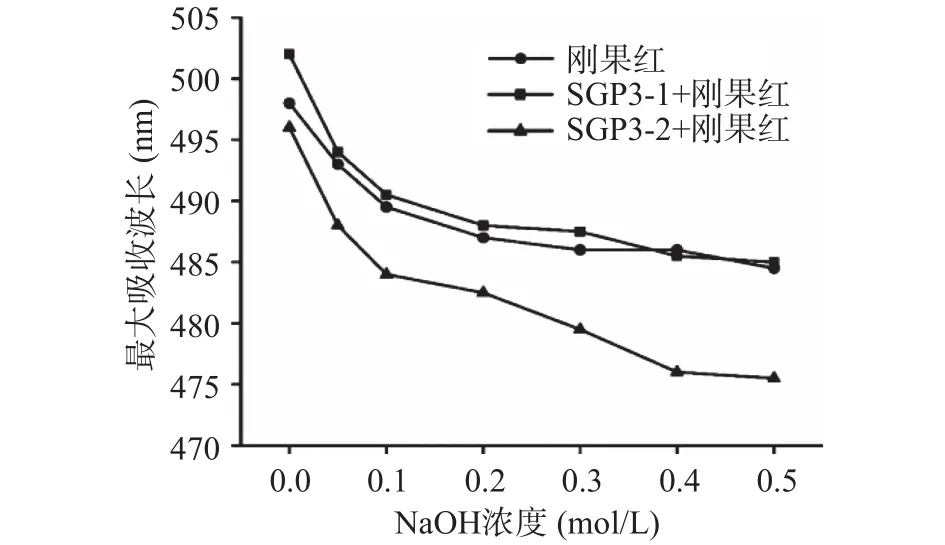
图5 刚果红及其多糖复合物在不同浓度NaOH下的最大吸收波长Fig.5 Maximum absorption wavelength of Congo redpolysaccharide complex and Congo red at different concentrations of NaOH
2.2.6 SGP3-1和SGP3-2核磁共振波谱分析 由图6可知,在SGP3-1和SGP3-2的一维核磁(1H和13C)光谱图中,化学位移主要集中在δH3.0~5.6和δC60.0~110.0 ppm,属于多糖信号峰。两种多糖在δH4.3~5.6和δC97.0~105.0 ppm出现的异头信号表明均存在α-和β-构型的糖苷键[21]。一般来说,不规则质子残留在5.00 ppm以上的质子,在α构型中有化学置换,而低于5.00 ppm的质子,在β构型中有化学置换[29]。从1H-NMR光谱图可以看出,SGP3-1在δH5.0~5.5 ppm出现的异头质子信号较强,而SGP3-2在δH4.3~5.0 ppm出现的异头质子信号较强,说明SGP3-1以α构型糖基为主,而SGP3-2以β构型糖基为主。从13C-NMR光谱图可以看出,两种多糖的糖苷键异头碳信号出现在δC97.0~103.5 ppm,糖苷键的其他碳信号出现在δC60~80 ppm,在δC170.0~180.0 ppm范围内均有一个糖醛酸信号吸收峰,说明SGP3-1和SGP3-2都是酸性多糖[30]。这些结果与红外光谱、单糖组成的结果相一致。两种多糖在δH1.1~1.3和δC16.0~18.0 ppm出现的信号属于甲基碳的化学位移。此外,δ2.06/22.46 ppm处的化学位移表明SGP3-2中存在N-乙酰基信号[31]。
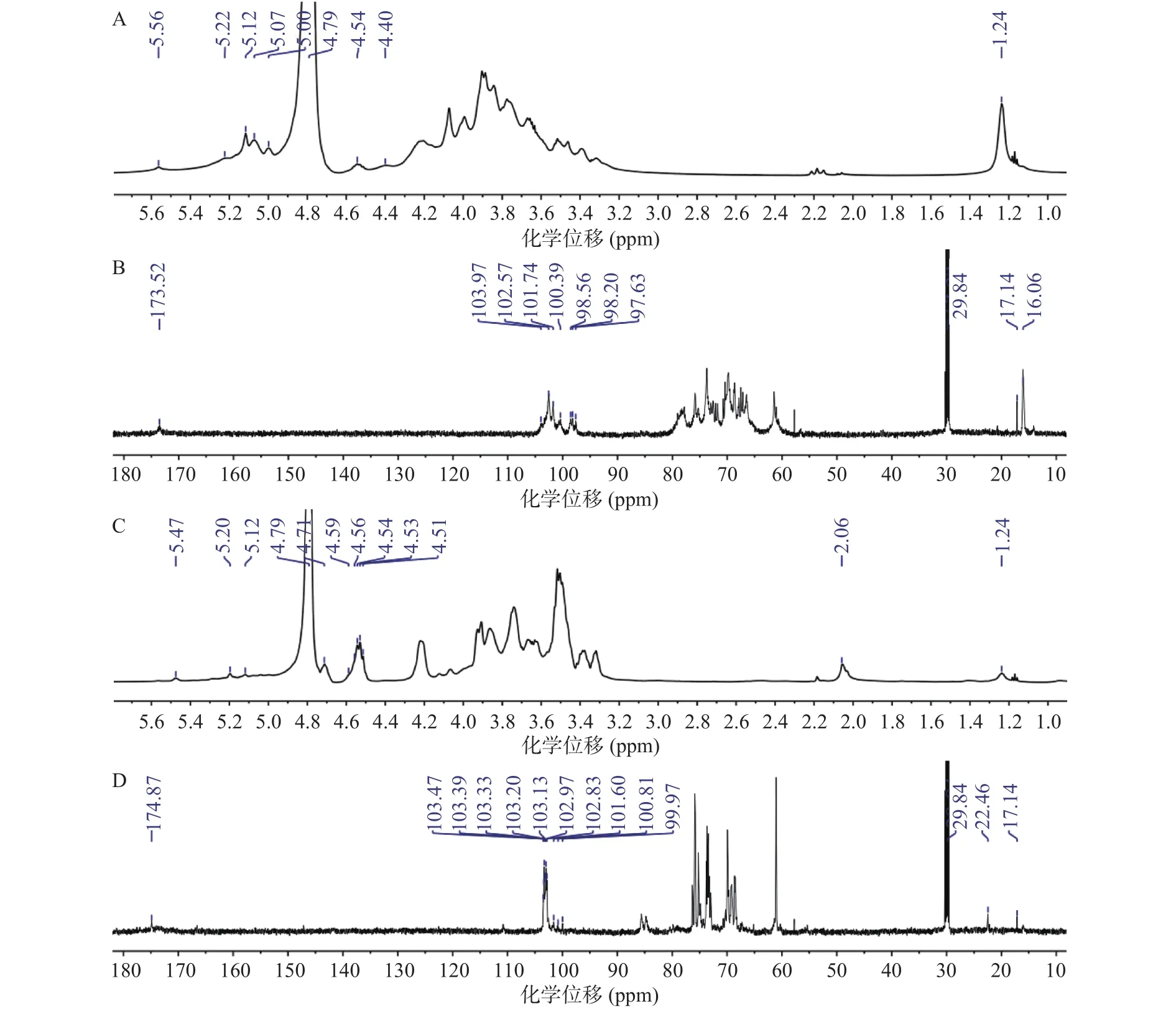
图6 SGP3-1和SGP3-2的核磁共振波谱Fig.6 NMR spectra of SGP3-1 and SGP3-2
2.3 SGP3-1和SGP3-2的免疫调节活性
2.3.1 SGP3-1和SGP3-2对RAW264.7细胞增殖能力的影响 为确定SGP3-1和SGP3-2对小鼠巨噬细胞RAW264.7增殖能力的影响,本研究采用CCK-8法测定多糖样品处理后的细胞存活率,结果见图7。与对照组相比,SGP3-1在5~40 μg/mL浓度范围内可促进RAW264.7细胞增殖,随着浓度增加,当其浓度高于80 μg/mL时,细胞存活率低于100%,有一定细胞毒性作用,而 SGP3-2在5~160 μg/mL浓度范围内均能促进RAW264.7细胞增殖,无细胞毒性。为对比SGP3-1和SGP3-2的免疫调节活性,选择5~40 μg/mL安全浓度范围开展后续实验。
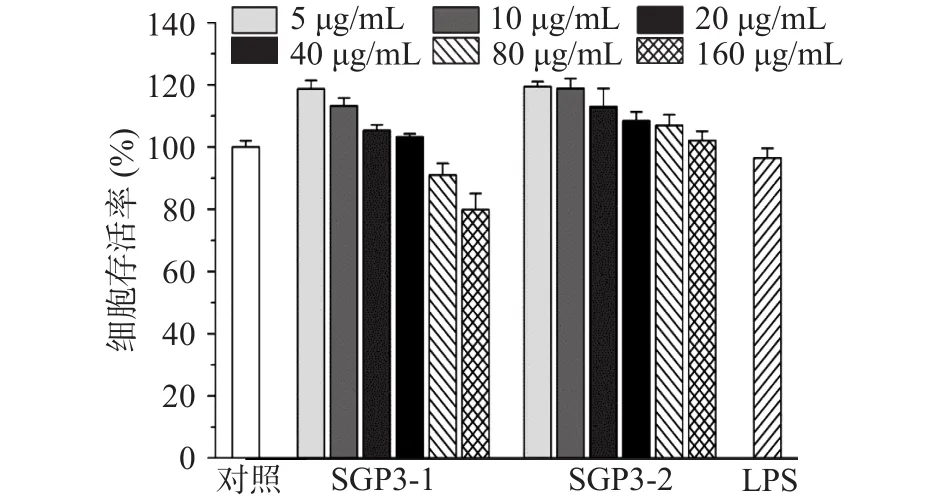
图7 SGP3-1和SGP3-2处理对RAW264.7细胞存活率的影响Fig.7 Effects of SGP3-1 and SGP3-2 treatment on the viability of RAW264.7 cells
2.3.2 SGP3-1和SGP3-2对RAW264.7细胞吞噬作用的影响 为评价SGP3-1和SGP3-2处理对RAW 264.7细胞吞噬作用的影响,本研究通过测定RAW264.7细胞对中性红的摄入量来反映吞噬能力。中性红是一种酸碱指示剂,通过胞吞作用摄入细胞内,因此能通过中性红摄入量的多少,反映巨噬细胞吞噬活性的大小[32],结果如图8所示。与对照组相比,SGP3-1和 SGP3-2在 5~40 μg/mL浓度范围内能显著促进RAW264.7细胞吞噬中性红的能力(P<0.05)。SGP3-1的促进作用随着处理浓度提高而增强,而SGP3-2 在 20 μg/mL 时,吞噬能力最强,40 μg/mL 浓度下吞噬能力则有所减弱,但与阳性对照LPS组相比没有显著性差异(P>0.05),表明SGP3-1和SGP3-2均能增强细胞吞噬能力,激活巨噬细胞RAW264.7。
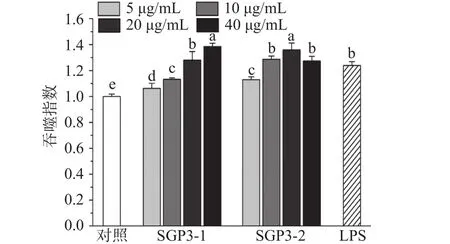
图8 SGP3-1和SGP3-2处理对RAW264.7细胞吞噬中性红能力的影响Fig.8 Effects of SGP3-1 and SGP3-2 treatment on the phagocytic capacity of neutral red in RAW264.7 cells
2.3.3 SGP3-1和 SGP3-2对 RAW264.7细胞产生NO、TNF-α及IL-6的 影响 为评价SGP3-1、SGP3-2处理对RAW264.7细胞产生NO、TNF-α及IL-6的影响,本研究采用Griess试剂法测定NO含量,ELISA试剂盒检测TNF-α、IL-6含量,结果如图9所示。NO作为一种重要的信号传导介质,参与多种生理活动和病理过程,在免疫调节方面是不可或缺的调节因子,TNF-α和IL-6的分泌可激活免疫细胞而发挥免疫调节作用,增强机体的抵抗力[33-34]。在5~40 μg/mL浓度范围内,SGP3-1和SGP3-2均可显著促进RAW 264.7细胞产生NO、TNF-α及IL-6,且随着多糖处理浓度的增加,产生量随之增加。在同一作用浓度下,SGP3-2对NO、TNF-α及IL-6产生的促进作用显著强于SGP3-1。说明SGP3-1和SGP3-2可通过刺激 RAW264.7细胞产生 NO,分泌 TNF-α、IL-6。
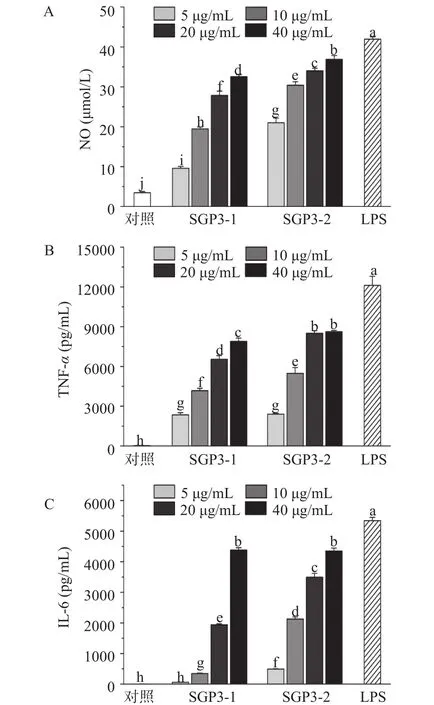
图9 SGP3-1和SGP3-2处理对RAW264.7细胞产生NO、TNF-α及IL-6的影响Fig.9 Effects of SGP3-1 and SGP3-2 treatment on the production of NO 、TNF-α and IL-6 in RAW264.7 cells
2.3.4 SGP3-1 和SGP3-2 对MAPKs、PI3K/Akt和NF-κB信号通路的影响 为探究MAPKs、PI3K/Akt和NF-κB这三条信号通路是否参与免疫反应,采用Western blot法检测通路相关蛋白磷酸化水平。如图10所示,与对照组相比,SGP3-1和SGP3-2处理能够显著提高p-Akt蛋白的表达量(P<0.05),分别为对照组的 3.29和 4.14倍。同样地,40 μg/mL的SGP3-1和 SGP3-2处理,能显著提高 JNK、ERK、p38蛋白的磷酸化水平,当SGP3-1处理后,p-JNK、p-ERK、p-p38蛋白表达量分别为对照组的4.30、4.70、7.37倍,SGP3-2处理后,p-JNK、p-ERK、p-p38蛋白表达量分别为对照组的5.48、6.27、9.06倍。而 SGP3-1和 SGP3-2分别显著提高了 p-NF-κB p65蛋白的表达量至对照组的2.67和3.79倍。
近年来,PI3K/Akt信号通路在免疫系统中起到的重要作用受到了广泛关注,它参与增殖、分化、吞噬、凋亡等多种细胞功能的调节,而Akt是该通路的中心和下游效应分子[35]。MAPKs家族主要包含三条信号途径:JNK、ERK和p38,前人研究指出LPS、细胞因子、多数真菌多糖可通过MAPKs信号通路,激活巨噬细胞[36-37]。另外,PI3K/Akt已被证实能够调控MAPKs信号通路[38]。在免疫调节和炎症反应方面,NF-κB是一个关键的转录因子,可诱导下游炎症介质产生,在巨噬细胞活化中发挥关键作用[39],PI3K/Akt和MAPKs信号途径被认为与转录因子NF-κB的活化有关。综上可知,SGP3-1和SGP3-2可通过活化MAPKs、PI3K/Akt和NF-κB信号通路而发挥免疫调节作用。
结合上述结果推测,SGP3-1和SGP3-2通过调控PI3K/Akt/MAPKs信号途径,活化转录因子NF-κB,促进细胞因子或NO产生,发挥免疫调节作用。另外,由图10可知,SGP3-2对 Akt、JNK、ERK、p38以及NF-κB p65蛋白的磷酸化作用均显著强于SGP3-1,这与 NO、细胞因子(TNF-α、IL-6)测定结果一致。Ferreira等[40]指出,多糖的免疫调节活性与其结构特性密切相关,由此推测,SGP3-1与SGP3-2免疫调节活性的差异可能与单糖组成、分子量以及糖苷键类型的不同有关[41]。推测其原因是SGP3-2的分子量小于SGP3-1,溶解度高,更有利于其在体内发挥活性,且SGP3-1以α-糖苷键为主,而SGP3-2以β-糖苷键为主,已有研究指出β-糖苷键的多糖具有更强的生物活性。
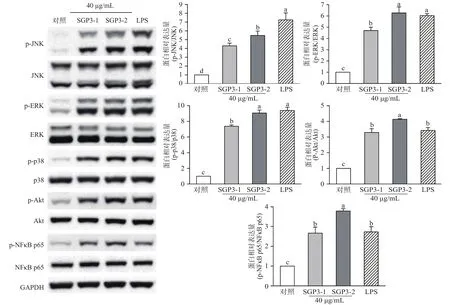
图10 SGP3-1和SGP3-2处理对RAW264.7细胞MAPKs、PI3K/Akt和NF-κB信号通路相关蛋白表达水平的影响Fig.10 Effects of SGP3-1 and SGP3-2 treatment on the protein expression level of MAPKs、PI3K/Akt and NF-κB signaling pathway in RAW264.7 cells
3 结论
SGP3-1、SGP3-2的重均分子量分别为170.48和14.52 kDa,具有典型的多糖官能团,不含三螺旋结构,且为无定形态。SGP3-1以α-糖苷键为主,单糖组成以葡萄糖(55.47%)、甘露糖(20.63%)及半乳糖(14.04%)为主;而SGP3-2以β-糖苷键为主,单糖组成以葡萄糖(82.43%)为主。SGP3-1和SGP3-2可通过激活MAPKs和PI3K/Akt信号通路,活化转录因子 NF-κB,增强 RAW264.7细胞吞噬活性,促进NO、TNF-α及 IL-6产生,发挥免疫调节作用,且SGP3-2的免疫调节活性强于SGP3-1。综上所述,SGP3-1和SGP3-2具有免疫调节活性,可用于开发功能性食品,作为免疫力低下人群的膳食补充剂。同时,本研究也为点柄乳牛肝菌的进一步开发提供理论依据和研究基础。

