糖代谢异常与Ⅰ期子宫内膜样腺癌临床病理及预后的相关性
刘畅浩,林海雪,吴妙芳,李 晶,王丽娟
(中山大学孙逸仙纪念医院妇科肿瘤专科,广东广州 510120)
近年来,子宫内膜癌(endometrial cancer,EC)的发病率在全国甚至全球范围都呈上升趋势。GLOBOCAN(全球癌症统计)2020年最新数据显示[1],全球子宫体癌新发病例为41.7万,年龄标准化发病率8.7/10万,较2018年上升(年龄标准化发病率8.4/10万),仅次于宫颈癌。我国子宫体癌新发病例为6.89万,发病率从3.94/10万(2003年)升至6.66/10万(2015年)[2]。早期子宫内膜样腺癌(endometrioid adenocarcinoma,EA)的预后良好,5年总生存率可高达95%[3]。因此,临床上较少关注预后较好的早期子宫内膜样腺癌患者。然而,据报道Ⅰ期患者的复发率是6.6%[4],复发的Ⅰ~Ⅱ期子宫内膜癌患者预后较差,5年总生存率仅约43.4%[5]。而实际上临床工作中,因为子宫内膜癌症状出现的时间较早,所以子宫内膜癌患者主要以Ⅰ期为主。因此,怎样把早期子宫内膜癌的复发相关的高危因素筛查出来并进行可能的干预,对于减少复发、改善预后非常关键。目前很多研究已证实代谢综合征(metabolic syndrome,MS)是Ⅰ型子宫内膜癌发病的高危因素,且影响其预后[6]。代谢综合征的核心异常是胰岛素抵抗(insulin resistance,IR),糖代谢异常是胰岛素抵抗的直接表现形式。但是目前,我们尚未检索到评估糖代谢异常与Ⅰ期EA临床病理特征及其预后关系的研究,且关于血糖控制情况与早期子宫内膜癌预后的相关研究较少。本研究拟探讨不同类型糖代谢异常与Ⅰ期EA患者临床病理特征及预后的相关性,并进一步明确合并糖尿病的Ⅰ期EA患者血糖控制情况对其预后的影响,为Ⅰ期EA患者是否进行糖代谢异常的早期临床干预提供参考。
1 材料与方法
1.1 研究对象
选取2015年1月至2019年12月期间在中山大学孙逸仙纪念医院妇科肿瘤科初治的Ⅰ期子宫内膜样腺癌患者387例,已获得伦理委员会批准,并已征得患者书面同意,分期依据国际妇产科协会(the International Federation of Gynecology and Ob⁃stetrics,FIGO)2009分期标准。参考2021年美国糖尿病协会(American Diabetes Association,ADA)糖代谢异常分组标准[7]将患者分为两组(糖代谢异常组、糖耐量正常组),其中糖代谢异常(impaired glucose metabolism,IGM)组分为三个亚组:⑴糖代谢异常组213例:①糖尿病(diabetes mellitus,DM)组127例:有典型的高血糖临床症状(多饮、多食、多尿、体重减轻)且随机血糖≥11.1mmol/L,或OGTT 2 h血糖≥11.1mmol/L,或空腹血糖≥7.0 mmol/L,或HbA1c≥6.5%,或既往有糖尿病者;②糖耐量异常(impaired glucose tolerance,IGT)组65例:OGTT 2小时血糖在7.8~11.0 mmol/L;③空腹血糖受损(impaired fasting glucose,IFG)组21例:5.6 mmol/L≤空腹血糖≤6.9 mmol/L但OGTT正常;⑵糖耐量正常(normal glucose tolerance,NGT)组174例:除去以上情况,且HbA1c<5.7%者。纳入标准:①在我院行全子宫切除±双附件切除±盆腔淋巴结切除术±腹主动脉旁淋巴结切除术的原发子宫内膜癌患者;②术后病理确诊为子宫内膜样腺癌Ⅰ期;③术前未进行任何治疗。排除标准:①临床或病理资料不完整;②其他病理类型的子宫内膜癌;③合并其他部位恶性肿瘤患者;④合并严重肝、肾等脏器功能衰竭者;⑤无随访数据或失访的患者。
1.2 临床及病理资料
收集一般临床指标:年龄、体质量、血压、身体质量指数(body mass index,BMI);血糖血脂生化指标:空腹血糖(fasting blood glucose,FBG)、稳态模型评估胰岛素抵抗指数(homeostasis model assess⁃ment-insulin resistance,HOMA-IR)、糖基化血红蛋白(glycosylated hemoglobin 1c,HbA1c)、甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,CHO)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)、乳酸脱氢酶(lactate dehydro⁃genase,LDH);妇科肿瘤标志物指标;免疫组化指标:雌激素受体(estrogen receptor,ER)、孕激素受体(progestron receptor,PR)、Ki-67蛋白、肿瘤抑制因子53(tumor suppressor p53,P53);术后辅助治疗指标:年龄≥60岁、中-低分化、淋巴脉管间隙浸润(lymph-vascular space invasion,LVSI)阳性、深肌层浸润等资料。
1.3 生存预后分析
通过电话及门诊复诊对患者进行随访,询问患者的复发、生存情况,随访至2020年12月,随访时间为5~62个月,生存期(overall survival,OS)随访平均随访时间为36个月,无进展生存期(progres⁃sion free survival,PFS)随访平均随访时间为35个月。本研究观察终点为死亡或复发。
1.4 统计学处理
应用SPSS 22.0统计软件进行数据分析,符合正态分布的计量资料用均数±标准差()描述,多组比较进行单因素方差分析(ANOVA);非正态分布计量资料用中位数及四分位距[M(P25~P75)]描述,多组比较采用秩和检验。成比(率)的比较采用卡方检验,并根据需要采用Bonferroni校正法或Fisher确切概率法。构建COX回归模型进行单因素及多因素分析。生存资料采用Log-Rank检验,并使用GraphPad Prism 9软件绘制K-M生存曲线。P<0.05表示差异有统计学意义。
2 结果
2.1 各组临床及病理相关指标
如表1所示,年龄之间差异无统计学意义,具有可比性。IGM组与NGT组相比较:收缩压、体质量、BMI、FBG、HOMA-IR、HbA1c、CHO、TG、LDLC、Ki-67、P53阳性表达强度及LVSI阳性率均较高,并具有统计学差异(P<0.05);HDL-C平均水平、ER及PR阳性表达强度均较低,并具有统计学差异(P<0.05)。在亚组分析中:DM组127名患者的平均收缩压为133.0(23.0)mmHg、体质量为63.0(12.0)kg、BMI为25.8(4.5)kg/m2、FBG为6.7(1.8)mmol/L、HOMA-IR为3.5(2.3)、HbA1c为6.1(1.7%)、CHO为6.0(2.2)mmol/L、TG为2.2(1.5)mmol/L、LDL-C为4.0(1.3)mmol/L、Ki-67阳性率为50(40)%、P53阳性率为70(10)%、LVSI阳性率为38(29.9%)均高于NGT组(P<0.05),HDL-C为1.0(0.5)mmol/L、ER阳性率为80(15%)、PR阳性率为75(15%)均低于NGT组(P<0.05)。IGT亚组65名患者的BMI为25.1(4.8)kg/m2、HOMA-IR为2.5(0.5)、HbA1c为5.7(0.8%)、CHO为5.5(1.4)mmol/L、LDL-C为3.7(1.3)mmol/L、Ki-67阳性率为50(40%)及P53阳性率为70(15%)均高于NGT组(P<0.05),其余结果与NGT组差异无统计学意义。IFG组21名患者的所有一般临床指标、血糖血脂指标及免疫组化表达强度与NGT组相比差异无统计学意义(P>0.05)。IGM组及其三个亚组与NGT组相比较,糖类抗原125(carbohydrate antigen 125,CA125)与人附睾蛋白4(human epididymis protein 4,HE4)的差异均无统计学意义。
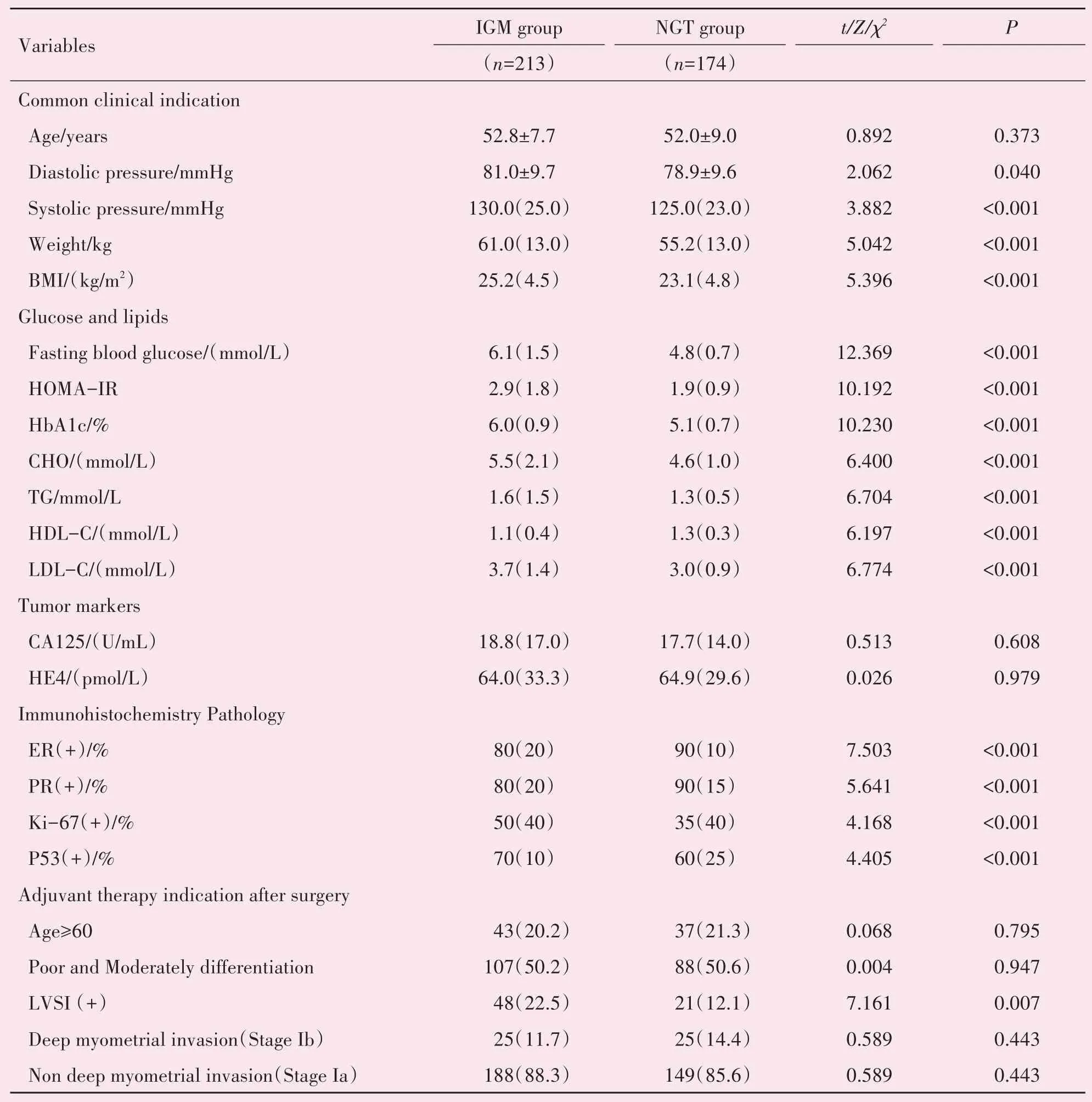
表1 两组临床及病理免疫组化相关指标Table 1 Immunohistochemistry pathology results and clinical indications in two groups
2.2 各组患者的预后分析
根据生存曲线(图1A),平均随访时间为36个月,IGM组死亡例数共12例,5年累积生存率为80.6%,NGT组死亡例数1例,5年累积生存率为99.1%,两者具有统计学差异(P=0.009)。
根据复发曲线(图1B),平均随访时间为35个月,IGM组复发例数19例,5年累积无进展生存率为85.8%,NGT组复发例数5例,5年累积无进展生存率为96.8%,两者具有统计学差异(P=0.018)。

图1 IGM组和NGT组患者累积生存率及无进展生存率曲线Fig.1 Cumulative survival and PFS curves for IGMand NGT groups
其他亚组分析结果:DM组、IGT组、IFG组的死亡例数分别是7例、4例、1例,DM组及IGT组患者的5年累积生存率分别是88.1%和46.4%,低于血糖正常(NGT)组(99.1%)(P<0.05),而IFG组的5年累积生存率(95.2%)与NGT组相比差异无统计学意义。DM组、IGT组、IFG组的复发例数分别是12例、6例、1例,DM组患者的5年累积无进展生存率(85.2%)低于NGT组(96.8%;P<0.05);IGT组的5年累积无进展生存率(84.8%)与NGT组(96.8%)相比差异无统计学意义(P=0.059),IFG组的5年累积无进展生存率(95.2%)与NGT组(96.8%)相比差异差异无统计学意义(P>0.05)。
图2为DM组血糖控制不同水平者的生存(A)及复发(B)曲线,参考《中国成人2型糖尿病患者糖化血红蛋白控制目标及达标策略专家共识》[8],以HbA1c=7.0%为界,将DM组的患者分为血糖控制达标亚组(HbA1c<7.0%)88例和血糖控制不达标亚组(HbA1c≥7.0%)39例,两组的死亡人数分别是2例、5例,复发人数分别是2例、10例。进行两亚组的生存分析,血糖控制不达标亚组的5年累积生存率和无进展生存率率均低于血糖控制达标亚组(82.2%vs.89.9%和67.7%vs.94.7%;P<0.05)。
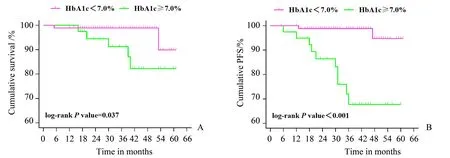
图2 DM组血糖控制不同水平患者累积生存率及无进展生存率曲线Fig.2 Cumulative survival and PFS curves for different level of HbA1c in DMgroup
2.3 影响患者预后的单因素和多因素COX回归分析
将糖代谢异常、年龄、BMI、HOMA-IR、高血压、脂代谢异常、CA125水平、HE4水平、肿瘤分化(高分化/中低分化)、肿瘤大小、LVSI状态和是否深肌层浸润这些可能影响Ⅰ期子宫内膜样腺癌预后的变量分别做单因素分析。分析发现糖代谢异常(HR=9.151,P=0.033)、脂代谢异常(HR=12.116,P=0.017)、CA125(HR=4.116,P=0.011)、LVSI阳 性(HR=2.254,P=0.001)与患者累积生存率降低有关(死亡风险增加相关)(P<0.05);糖代谢异常(HR=3.074,P=0.025)、胰岛素抵抗(HR=2.390,P=0.039)、高血压(HR=2.528,P=0.028)、脂代谢异常(HR=3.074,P=0.025)、CA125水平(HR=2.439,P=0.040)、HE4水平(HR=5.709,P<0.01)、LVSI阳性(HR=6.954,P<0.01)及深肌层浸润(HR=4.220,P<0.01)与患者累积无进展生存率降低有关(与复发风险增加相关)(P<0.05)。将单因素分析中具有统计学意义的预后因素以及临床工作中比较认同的对预后有影响的因素(年龄、肿瘤分化、肿瘤大小、是否深肌层浸润)纳入多因素COX回归模型,得出结果:CA125水平(≥35 U/mL)、LVSI阳性是影响患者累积生存率的独立危险因素;脂代谢异常、LVSI阳性、深肌层浸润是影响患者累积无进展生存率的独立危险因素(表2-3)。

表2 影响患者累积生存率的多因素回归分析Table 2 Multivariate analysis for cumulative survival rate

表3 影响患者累积无进展生存率的多因素回归分析Table 3 Multivariate analysis for cumulative progression free survival rate
3 讨论
3.1 糖代谢异常与子宫内膜癌患者累积生存率及无进展生存率的关系
一项纳入249例Ⅰ~Ⅱ期子宫内膜样腺癌患者的研究[3]根据临床分期及组织分化程度将其分为低危组、中危组和高危组,其5年OS率分别为97%、98%和85%。本研究中NGT组的5年累积生存率(98.6%)与该研究的低危组和中危组相似,而糖代谢异常组的5年累积生存率(80.6%)略低于该研究中的高危组。这说明,糖代谢异常对早期内膜样腺癌预后的影响,可能与分期较晚及分化较差有类似的影响。此外,本研究将糖代谢异常者分组分析后发现,DM组患者的5年累积生存率低于NGT组(88.1%vs.98.6%;P<0.05),与Saed等的结果有类似的趋势(68%vs.84%)[9],但Saed的对象是Ⅰ~Ⅲ期子宫内膜样腺癌,故两组生存率均比本研究的低。本研究中死亡占比为3.4%(13/387),其中因子宫内膜癌死亡8例(占61.5%),另外5例(占38.5%)死因不明确(家属不愿告知或不清楚)。DM组患者的5年PFS率低于NGT组(85.2%vs.96.8%;P<0.05),复发率为6.2%(24/387),略低于王莉等的研究(8.3%,10/120)[10],可能原因是其研究纳入的是Ⅰ~Ⅱ期子宫内膜样腺癌及浆液性癌患者,部分患者的期别和病理类型较本研究差。但将糖代谢异常者进行亚组分析后发现,DM组(12/127,9.4%)及IGT组(6/65,9.2%)的复发率较NGT组(5/173,2.8%)明显增高,其中83.3%(20/24)患者复发时间为术后3年内。这表明即使是预后较好的早期子宫内膜样腺癌患者,伴有糖代谢异常者仍有较高的复发率。
3.2 影响子宫内膜癌患者预后因素的分析
本研究结果显示:糖代谢异常、脂代谢异常、CA125水平大于35 U/mL、LVSI阳性与患者累积生存率降低有关,糖代谢异常、胰岛素抵抗、高血压、脂代谢异常、CA125水平、HE4水平、LVSI阳性及是否深肌层浸润与患者复发风险增加相关。其中CA125水平(≥35 U/mL)、LVSI阳性是影响患者累积生存率的独立危险因素;脂代谢异常、LVSI阳性、深肌层浸润是影响患者累积无进展生存率的独立危险因素。查阅既往多年研究表明这些因素基本都是EA患者预后的独立危险因素[11-12]。在本研究的亚组数据中我们还发现:存在更多胰岛素抵抗、超重、高血压及脂代谢异常的DM组及IGT组预后更差。高血糖水平与多癌种有关,例如结直肠癌、肾癌、膀胱癌和子宫内膜癌等[13]。一项纳入35例EC患者与健康人群对照的研究显示,HbA1c的水平明显高于健康人群[14]。一项纳入82例EC患者的临床研究表明[15],以7.5%作为HbA1c界值时,两组EA患者的生存率无差异。本研究以HbA1c 7.0%为界限分析,结果示DM组患者中血糖控制达标组的5年OS率和PFS率均优于血糖控制不达标组(P<0.05)。这表明,对于已经诊断为糖尿病的EA患者而言,控制良好的血糖水平仍然可以使患者获益。
ER、PR、P53等免疫组化指标的表达阳性率与子宫内膜癌的预后相关。有学者将免疫组化指标(PR、P53)表达阳性75%作为界限分析EC患者的预后[16],发现PR表达阳性率>75%者生存率显著高于PR阳性表达率<75%者的生存率,P53表达阳性率>75%者的生存率显著低于P53表达阳性率<75%者的生存率。本研究显示,糖代谢异常(DM和IGT)患者的P53阳性表达程度均高于NGT组(P<0.05),且5年OS率和5年PFS率亦低于NGT组(P<0.05)。但本研究中各组ER、PR阳性表达均>75%,而P53阳性表达均<75%,考虑原因可能是糖代谢异常(DM和IGT)有可能既影响患者的P53、PR和ER的表达又影响预后,但本研究的对象均为Ⅰ期子宫内膜样腺癌患者,预后确实较好,故影响强度并不显著。
与此同时,LVSI阳性是盆腔淋巴结转移的唯一高危因素[17]。同时在早期子宫内膜癌但是发生复发的病例中进行重复检查,会发现大部分的患者实际上是存在LVSI阳性的[18]。在临床工作中,LV⁃SI阳性是各个分期的子宫内膜癌患者的预后重要指标之一。本研究发现,在糖代谢异常组中存在更多的LVSI阳性者,尤其是DM组更显著。并且LV⁃SI阳性是预后的独立危险因素。与本研究结论相符。从而我们可以知道,LVSI阳性会导致子宫内膜癌Ⅰ期患者的复发风险增加,死亡风险增加。
在既往的研究中发现CA125水平与高级别的子宫内膜癌,淋巴结转移,深肌层浸润和肿瘤晚期有关,并且与预后相关[19]。本研究中患者的CA125平均18 U/mL,而在单因素和多因素分析中选取的截断值为35 U/mL,因此我们可以知道,早期的子宫内膜样腺癌患者一般CA125水平不超过35 U/mL,而当早期的子宫内膜样腺癌患者CA125水平超过35 U/mL的时候,预示着可能预后较差。
3.3 糖代谢异常与子宫内膜癌患者发生复发转移的关系
盆腔是EC患者最常见的复发转移部位,而远处转移的患者中较常见的是肺转移。在Mao等[20]的研究中,74 000余例的子宫内膜癌患者中约有1 048例发生肺转移,发生率约为1.5%,相对于肝脏、骨骼和脑转移来说是转移概率最高的部位。且有研究表明,远处复发的早期EC患者中位OS(1年)明显低于阴道复发者(14年)[5]。本研究中共有24例患者复发(糖代谢异常患者19例,血糖正常患者5例),最常见的远处复发部位为肺部(11例,其中合并有糖代谢异常患者占10例),局部复发部位主要为阴道残端(6例),尿道、直肠及盆腔淋巴结(5例)也是常见复发部位,其余还有双侧膈角(1例)、锁骨上淋巴结(1例)。我们的数据表明,糖代谢异常患者远处复发率高,其中肺部为最常见的远处复发部位,对于这类患者在术后随访过程中需要更加关注肺部情况。
3.4 糖代谢异常影响子宫内膜癌患者的临床病理与预后的可能机制
细胞实验证明,葡萄糖剥夺会诱导癌细胞的死亡,高糖环境可以促进癌细胞的增殖[21]。与生理水平(5 mmol/L)相比,高水平(25 mmol/L)葡萄糖培养的EC细胞系表现出更强的克隆形成性和粘附性,更高水平的上皮-间质标记包括:Twist蛋白,Snail蛋白,钙黏蛋白相关蛋白(catenin protein beta 1,CTNNB1)、雌激素受体α(ERα)和血管内皮生长因子受体(VEGFR),信号转导因子、转录激活因子3(STAT3)及其调节剂酪氨酸激酶1(JAK1)和2(JAK2),以及更低水平的叉形头转录因子1(FOXO1)和5′腺苷单磷酸激活的蛋白激酶(AMPK)[22-23]。以上结果表明,糖代谢异常可能有助于持续激活多种致癌信号通路,调节葡萄糖代谢,从而促进子宫内膜癌细胞的增殖和侵袭,影响患者复发风险和死亡风险。在研究结果中我们可以发现多种在日常临床病理中应用的指标(ER、PR、P53和Ki-67等)在糖代谢异常组和糖耐量正常组的比较中有统计学差异,并且血糖异常组通常拥有更多的提示预后不良的指标。我们考虑糖代谢的异常激活了多种致癌信号通路,在子宫内膜癌细胞侵袭的过程中,同时表现为临床病理指标出现异常,比如有相关研究提示高表达的Ki-67与患者的不良临床病理特点有关[24-25]。我们希望下一步可进行基础研究以了解糖代谢异常如何通过各种通路对子宫内膜癌的发生发展起作用。
3.5 本研究的优势与局限性
传统上认为,影响EC患者预后的高危因素有:非子宫内膜样腺癌、深肌层浸润、脉管间隙受累、宫颈转移、淋巴结转移、子宫外转移等。因此,通常认为子宫内膜样腺癌尤其是早期患者的预后很好,较少研究关注影响早期子宫内膜样腺癌预后的因素,并给予相应的处理。既往已有研究证实MS能影响子宫内膜癌的发生和预后[6],而糖代谢异常是MS的主要组成成分之一,却暂时没有对它与早期子宫内膜癌预后关系的深入研究。在本研究总样本量是387例患者,一定程度上可以说明MS与早期子宫内膜样腺癌患者预后的关系。研究中可以了解到除传统的影响预后的因素外,糖代谢异常还影响Ⅰ期子宫内膜样腺癌患者的预后,血糖的控制与预后相关。在临床工作中,血糖控制并不会非常困难和昂贵,而其带来的收益也远远不仅限于改善早期子宫内膜癌患者的预后,对患者的全身情况改善均有益处。所以血糖控制对早期子宫内膜癌患者来说是一个性价比非常高的治疗手段。
本研究作为回顾性研究,存在一定的不足:首先,随访时间有限,所得数据有一定的局限性;其次,由于糖耐量异常组和空腹血糖受损组的HbA1c数据不全,除了糖尿病组之外,未能统计糖耐量异常组和空腹血糖受损组血糖控制与否对预后的影响。未来将需要更大样本量的前瞻性试验进一步完善研究。
综上所述,大部分Ⅰ期子宫内膜样腺癌患者术后预后较好,但糖代谢异常通常会与多种影响EA预后的不良因素并存,合并糖代谢异常者,死亡率及复发率增高。良好的血糖控制,可以改善Ⅰ期子宫内膜样腺癌患者的预后。控制血糖比使用其他手段控制复发容易得多,并且不影响患者生活质量。应该重视糖代谢异常EA患者的血糖、脂代谢及相关不良因素的控制和管理,并对合并糖代谢异常者密切随访,控制血糖。

