Martin Kampmann团队揭示OMA1-DELE1-HRI介导的线粒体应激信号传递通路
郭 兴
(南京医科大学神经生物学系,江苏南京 211166)
线粒体作为真核细胞的必需细胞器,其包含约1 000~1 500种蛋白质,它不仅可以高效地合成ATP以供给细胞的能量需求,也参与调控众多的细胞信号通路[1-4]。线粒体蛋白主要来源于线粒体基因组和核基因组,其中,核基因组编码的蛋白占了绝大部分[5-6]。核基因组编码的线粒体蛋白在翻译后需要被输入,加工,折叠以及组装,任一步骤的失调都将导致线粒体蛋白质稳态的失衡,进而引起涉及衰老或众多人类疾病的线粒体功能障碍[7-8]。为了应对这些失调,真核细胞演化出了独特的线粒体质量控制机制,包括线粒体未折叠蛋白反应(mitochon⁃drial unfolded protein response,mt UPR)、线粒体受损的蛋白质输入反应(mitochondrial compromised protein import response,MitoCPR)和整合性应激反应(integrated stress response,ISR)等[9-12]。mtUPR主要响应于线粒体基质中的错位折叠或异常堆积的蛋白质,但也可以被线粒体DNA(mtDNA)突变,活性氧等诱导;MitoCPR是由核基因编码的线粒体蛋白的前体在线粒体转位酶(TOM以及TIM复合物)中堆积所激活;而ISR则是被报道能响应于多种线粒体应激。然而,细胞是如何感受到线粒体功能障碍以及线粒体是如何释放出危机信号的,这些仍未被充分阐述。
先前的研究表明在线虫以及哺乳动物中,mtU⁃PR的关键分子分别是ATFS-1和ATF5[13-14]。这两个分子都包含线粒体靶向序列,可以在生理情况下被输入线粒体而降解,但在线粒体基质内蛋白质错误折叠或异常堆积导致蛋白输入障碍时会滞留在胞质内,并因其氨基酸序列中的核定位序列而进入细胞核内促进mtUPR相关基因的转录。亦有研究报道,线粒体蛋白,如SSBP1[15],MNRR1(CHCHD2)[16]可以分别在线粒体蛋白质紊乱和线粒体输入应激的情况下定位于细胞核而参与基因转录的调控以诱导线粒体未折叠蛋白反应、自噬、线粒体生物发生等反应。此外,mTORC1也被确认是mt DNA异常的响应器,其可通过上调ATFs的表达,主要是ATF4和ATF5,激活阶段性的线粒体ISR以遏制线粒体紊乱[10,17]。虽然这些研究揭示了特定的线粒体应激所引起的细胞保护性反应以及其所涉及的独特分子机制,但细胞是如何响应于更普遍的线粒体损伤以及如何调控基因表达仍是未知的。
为了明确与线粒体损伤相关的基因,作者首先对HEK293T细胞进行线粒体毒性药物(强力霉素和寡霉素)处理并进行RNA测序,结果显示被显著上调的基因中有一部分为ISR的主要协调者ATF4的靶点[18-19]。ATF4作为ISR的主要协调者,其在生理情况下处于低表达的状态并参与正常代谢过程[20]。但当细胞处于不同的应激状态时,ATF4可因其上游分子eIF2α被激酶(GCN2,PERK,PKR,HRI)磷酸化后被优先翻译而作为ISR相关的转录因子以促进应激抵抗相关基因的表达[21-22]。为了确认线粒体在损伤后是如何将信号传给ATF4而上调ATF4靶向的基因,作者构建了基于ATF4翻译水平的荧光蛋白报告系统的细胞系。通过这一细胞模型以及配合基因敲除技术,作者发现ATF4的表达响应于多种原因导致的线粒体功能障碍,并且证明ISR中的eIF2α激酶HRI是介导ATF4响应于线粒体损伤的关键蛋白,该激酶的缺失将显著抑制线粒体损伤后ATF4的翻译增强。HRI是一种定位于细胞质内的代谢应激感应蛋白激酶,其被报道可以响应于血红素缺乏、氧化应激、渗透压休克、线粒体功能障碍和热休克而激活ISR[23]。
但细胞是如何将线粒体损伤的信号传递给HRI而激活ISR仍是未知的。为了解决这个问题,作者利用了全基因组CRISPR干扰(CRISPRi)结合流式细胞分选仪和荧光报告系统进行全基因组筛查。除了发现先前验证的激酶HRI外,作者还发现了一个先前被很少研究的基因D ELE1,其敲减将显著抑制线粒体受损情况下ATF4的翻译增强。通过生物化学方法,超高分辨率显微技术,构建片段缺失截短体和质谱分析等技术分析,作者确认DELE1是一种定位于线粒体内膜的蛋白,其在线粒体受损的情况下会在N端约142个氨基酸的位置被切割而产生可以定位于细胞质的短肽形式的DELE1,且其TPR重复结构域中前三个TPR重复对于ATF4的激活是至关重要的。鉴于DELE1发生了切割反应,作者又筛查了他们测序结果中28个线粒体蛋白酶对于线粒体损伤后DELE1切割及ISR激活的作用,发现只有OMA1的敲减会显著抑制DELE1的切割而逆转线粒体损伤应激后的ATF4激活。最后,作者通过免疫共沉淀技术和体外激酶活性分析证明了定位在细胞质内的短肽形式的DELE1可以选择性结合HRI,并促进其对底物eIF2α的磷酸化修饰而介导ISR,揭示了DELE1在OMA1依赖下切割形成的短肽形式可以在胞质内结合并激活HRI以激活下游转录因子ATF4(图1)。
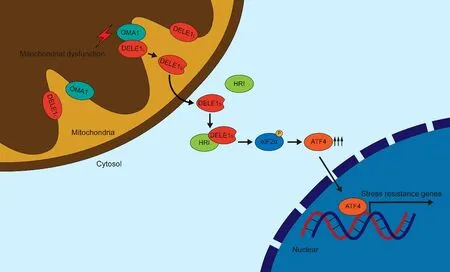
图1 OMA1-DELE1-HRI信号通路Fig.1 OMA1-DELE1-HRI signaling pathway
总的来说,Martin Kampmann团队的研究通过强有力的证据确认OMA1-DELE1-HRI这一信号通路的存在,以及其在响应于线粒体损伤后ISR激活中的关键作用。这项研究充实了人们对于线粒体和细胞核之间的交流的了解,并为治疗线粒体功能异常关联疾病提供了新的治疗策略。

