药物涂层球囊治疗下肢动脉硬化闭塞症效果观察
黄德良
(黄河中心医院介入科,河南 郑州 450000)
下肢动脉硬化闭塞症(ASO)是由于内皮细胞损伤引起平滑肌细胞向内膜迁徙、增殖、分泌细胞外基质,并吞噬脂质,最终形成动脉粥样斑块,引起下肢动脉狭窄、闭塞的血管病。ASO的发生多与高同型半胱氨酸血症、高凝状态、血液黏着性增高等有关,多见于中老年人。临床治疗多采用经皮腔内球囊扩张血管成形术,以普通球囊(POBA)扩张为主,可调节靶血管通畅效果,但对于动脉管腔直径的改善程度不高[1]。研究表明[2],药物涂层球囊(DCB)治疗ASO患者可调节踝肱指数(ABI)水平,改善靶血管通畅率。本文探讨DCB治疗ASO患者的效果及其对动脉管腔直径、踝肱指数的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择本院2017年10月至2019年9月收治的ASO患者127例,经彩色多普勒超声、磁共振血管造影等检查符合《临床血管外科学(第5版)》[3]中ASO的诊断标准,排除凝血功能异常、精神障碍等。根据治疗方法不同分为对照组63例和观察组64例。对照组男39例,女24例;年龄62~76(69.15±5.13)岁;病程3~6(4.54±1.22)个月;病变部位为股浅动脉上段15例,股浅动脉中段18例,股浅动脉下段19例,腘动脉11例。观察组男41例,女23例;年龄63~78(70.53±6.11)岁;病程3~6(4.56±1.31)个月;病变部位为股浅动脉上段19例,股浅动脉中段17例,股浅动脉下段16例,腘动脉12例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。研究经本院医学伦理委员会审核批准。
1.2 方法
术前2 d给予抗血小板聚集治疗(阿司匹林或氯吡格雷),依据患者术前CT血管成像等影像学结果以测定最小管腔直径及正常血管段直径,选择适宜大小的POBA。给予局部麻醉,常规消毒,铺手术巾,穿刺股动脉,将导管鞘插入,然后将2500 U肝素进行鞘内推注,采用高压注射器将造影剂注入,在数字减影血管造影下观察并对病变区域进行评估,导丝配合导管以通过病变段,用POBA进行预扩张,预扩张满意后 (狭窄小于70%,无限流性夹层),对照组用POBA(巴德公司Rival球囊)进行扩张,观察组在进行DCB扩张前选择较靶血管直径小0.5~1.0 mm的POBA进行预扩张,扩张时应缓慢匀速递增,DCB(北京先瑞达公司Orchid球囊)持续扩张3min,球囊长度需将病变部位全部覆盖,若实际应用的球囊较多,则需要确保球囊的交叉覆盖长度不小于10 mm,造影结果提示病变区域恢复正常的血流,残余狭窄不大于30%,即为手术成功。两组患者出院后均行抗血小板聚集治疗。术后随访12个月。
1.3 观察指标
(1)靶血管通畅率:参照《临床血管外科学(第5版)》[3]评估两组患者术后6、12月末的靶血管一期通畅率。若靶血管保持通畅,没有任何临床症状,并且不需要进行再次干预,即为靶血管一期通畅。
(2)动脉管腔直径:采用Siemens Sequia 512彩色多普勒超声诊断仪评估两组患者术前、术后12月末的最小管腔直径(MLD)。
(3)ABI水平:比较两组患者术前、术后12月末的ABI水平。嘱患者仰卧,用12 cm×40 cm气袖分别置于双侧踝部及上臂,用多普勒听诊器协助测取足背动脉及肱动脉收缩压,两者之比即为ABI。
(4)远期效果:比较两组患者术后6、12月末的远期效果。①晚期管腔丢失量(LLL)为术后MLD 与随访 MLD 之差。②靶病变血运重建(TLR)为临床需要的靶病变血管内介入或手术治疗。
(5)并发症情况:比较两组患者术后12月期间的并发症情况。包括血管再狭窄、远端末梢动脉栓塞、术后病变段血栓形成等。
1.4 统计学方法
2 结果
2.1 靶血管通畅率
观察组术后6月末、术后12月末靶血管一期通畅率均高于对照组,差异有统计学意义(P<0.05)。见表1。
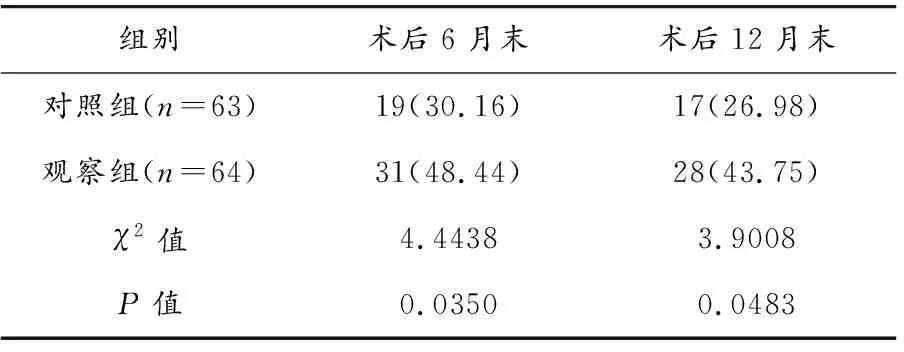
表1 两组ASO患者在术后6月末、12月末靶血管通畅率比较[n(%)]
2.2 动脉管腔直径
两组患者术后12月末MLD水平较术前均升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组术前、术后12月末MLD水平比较
2.3 ABI水平
两组患者术后12月末ABI水平较术前均升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组术前、术后12月末ABI水平比较
2.4 远期效果
观察组术后6月末、12月末LLL水平、TLR率均低于对照组,差异有统计学意义(P<0.05)。见表4。
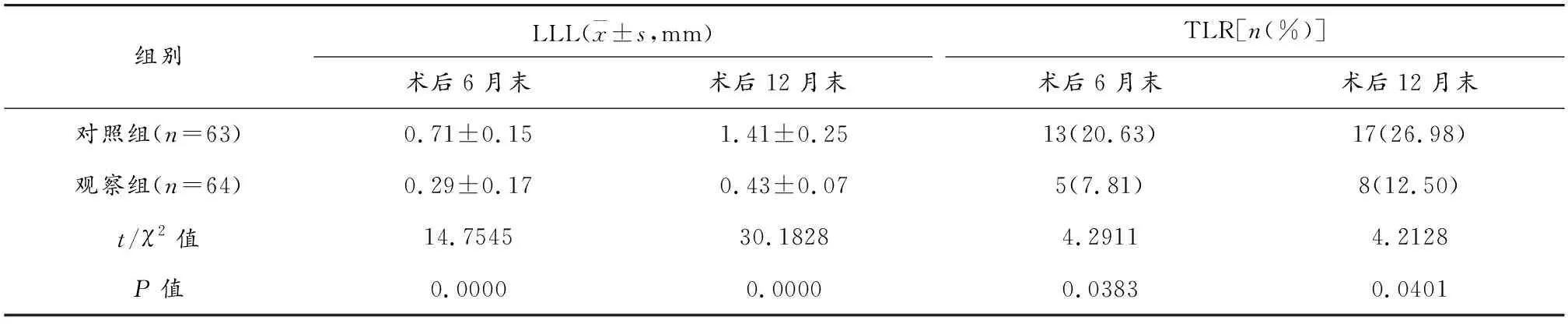
表4 两组术后6月末、12月末远期效果比较
2.5 并发症情况
对照组血管再狭窄2例,远端末梢动脉栓塞2例,术后病变段血栓形成1例,并发症发生率7.94%;观察组血管再狭窄1例,远端末梢动脉栓塞1例,并发症发生率3.13%。两组比较差异无统计学意义(χ2=0.6386,P>0.05)。
3 讨论
ASO患者早期可出现畏寒、发凉后逐,渐出现间歇性跛行,随着疾病进展,出现静息痛,常发生于平卧及夜间休息,严重者肢体可出现溃疡、坏疽。据流行病学调查显示[4],吸烟、糖尿病、高脂血症、高血压病及高龄等为诱发ASO的危险因素,其中吸烟与糖尿病的危害最大,可使周围动脉疾病的发生率增高3~4倍。临床多采用POBA扩张治疗ASO患者,可改善其ABI水平,但可能引起穿刺点血肿[5]。研究[6]表明,DCB扩张可改善ASO患者的靶血管通畅率,调控动脉管腔直径水平。
ASO患者长期存在高血脂、高血压、高血糖等,致使血浆中脂质在动脉内膜沉积,刺激结缔组织增生,引起动脉粥样硬化。本文结果显示,观察组术后6、12月末靶血管一期通畅水平均高于对照组;两组患者术后12月末MLD水平较术前均升高,且观察组高于对照组,表明DCB扩张治疗ASO患者可改善其靶血管通畅率和动脉管腔直径水平。POBA扩张因其没有药物涂层,不能充分扩张较硬病变动脉,对动脉管腔直径及病变动脉的远期通畅率改善程度不理想[7]。DCB表面涂层药物为紫杉醇,球囊扩张后其涂层上的紫杉醇被释放,血管壁和球囊壁紧密贴附,促使血管壁组织摄取紫杉醇,通过阻滞细胞信号通路或细胞分裂周期,引起细胞凋亡,抑制动脉内膜增生,降低脂质在动脉内膜的沉积,避免动脉管腔增厚狭窄,改善动脉管腔直径水平及病变动脉的远期通畅率[8]。
ASO患者下肢动脉发生动脉粥样硬化,引起下肢动脉狭窄、闭塞,致使下肢缺血、ABI水平异常,引起跛行。POBA虽能扩张病变血管,但对于较硬管腔的作用有限,也可能损伤血管,对ABI水平及远期效果的调节程度不高[9]。DCB扩张通过扩张闭塞血管复通病变位置,利用高度亲脂性促使血管壁组织快速吸收利用紫杉醇,且可以在病变动脉血管壁的成纤维细胞层及平滑肌细胞层发挥相对高浓度的药性,进而对血管内皮细胞发挥持续作用,改善组织异常增生或沉淀,在一定程度上避免动脉血管壁增厚甚至闭塞的风险,降低TIR的发生,避免LLL水平的异常增多;且术后应用降低血小板聚集的药物以避免微循环障碍,促进下肢运动尽快恢复,改善ABI水平[10]。本文结果显示,两组患者术后12月末ABI水平较术前均升高,且观察组高于对照组;观察组术后6、12月末LLL、TLR水平均低于对照组,表明DCB扩张治疗ASO患者可调节其ABI水平和改善远期效果。
ASO患者因患肢存在动脉粥样硬化斑块,可引起血栓。本文结果显示,两组并发症发生率差异无统计学意义(P>0.05),表明两种球囊扩张方案治疗ASO患者的安全性均较高,且DCB扩张不增加术后并发症发生风险。POBA可通过扩张病变血管,避免血管管腔的进一步狭窄,在一定程度上可降低远端末梢动脉栓塞的发生。DCB是一种表面覆盖抗血管增殖药物的新型球囊,通过腔内介入扩张治疗病变管腔,促使病变血管壁与涂层的紫杉醇充分接触,高浓度状态下持续作用于血管内皮细胞,对血管内皮细胞的增殖发挥拮抗作用,降低血管再狭窄的发生;亲脂性较高使涂层药物能被血管壁迅速吸收,使其吸收利用的时间较短,降低因药物的持续抗血管内皮增生作用所致使的血管内皮化延迟,降低术后病变段血栓形成[11]。
综上所述,DCB治疗ASO患者通过抑制动脉内膜的增生以改善动脉管腔直径水平,调节靶血管通畅率,调控ABI水平,改善远期效果,安全性较高,疗效优于POBA,值得临床推广应用。

