吡非尼酮通过下调TGF-β/Smad 通路中TGF-β3 的表达抑制兔Tenons囊成纤维细胞增殖
陈 旭,申 颖,赵海霞,郭文奇
1内蒙古医科大学附属医院近视眼激光治疗中心,内蒙古 呼和浩特 010059;2第二附属医院急诊科,内蒙古 呼和浩特 010091
抗青光眼滤过术后,结膜和结膜下组织的切口诱导了中性粒细胞、巨噬细胞等促炎性因子局部浸润、激活成纤维细胞大量增殖并促进弹性蛋白、胶原蛋白等加速合成,导致滤过道瘢痕化,手术失败[1]。纤维化过程由各类细胞因子如转化生长因子-β(TGF-β)、TNF-α(肿瘤坏死因子-α)、ⅤEGF(血管内皮生长因子)等共同参与完成[2]。TGF-β是参与纤维化进程的关键控制因子,在抗青光眼滤过术中可使小梁网(TM)皱缩、细胞外基质(ECM)沉积,并增加胶原蛋白、生长因子的表达[3]。纤维化过程中主要由细胞因子TGF-β及其下游的Smad蛋白共同参与调控目的基因的表达TGF-β/Smad 途径[4]。TGF-β在组织损伤修复过程中占主导地位,滤过性手术后眼组织促进成纤维细胞增殖活化并大量分泌生长因子会导致术后效果不理想[5]。目前寻找抗青光眼滤过术后抑制滤过道瘢痕化的药物对提高手术成功率尤为重要。吡非尼酮(PFD)是一种广谱抗纤维化药物,具有抗炎作用并可以通过多种途径抑制纤维化进程,包括抑制TGF-β、白介素-1β相关信号通路,调节脂质代谢途径并减少α-SMA、胶原蛋白和纤连蛋白的表达[6],从而减轻炎症反应,抑制成纤维细胞增殖以及ECM沉积[7]。有研究表明PFD可抑制TGF-β/Smad通路上胶原和细胞外基质的表达并抑制成纤维细胞增殖能力[8]。
吡非尼酮可降低血管通透性、减少炎症因子表达产生抗炎作用。作为一种小分子药物,它能抑制胶原合成,下调多种细胞因子的产生。吡非尼酮在眼科相关的纤维增生性疾病的应用,可抑制炎性因子迁移、细胞过度增殖,改善角膜、结膜、晶状体等眼部组织的纤维化进程[9]。吡非尼酮治疗眼部纤维增生性疾病的主要机制:涉及抗纤维化、抗炎、抗氧化和抗胶原合成等多个方面[10]。通过调节各促纤维化通路介质,降低TGF-β、TNF-α、ROS(活性氧)和CollagenⅠ等因子的表达能力,防止或消除组织过度纤维化沉积[11]。本实验选用PFD进行青光眼滤过术后抗瘢痕化的研究,通过抑制细胞信号通路TGF-β/Smad的表达情况及纤维蛋白的过分增殖,改善抗青光眼滤过术后滤过道的纤维化程度。本实验在分子生物学方面为PFD在临床眼科增殖性疾病的应用提供理论依据。
1 材料和方法
1.1 RYTF的原代培养
兔眼Tenons囊组织选材取自健康无眼疾青紫蓝兔2只(由内蒙古医科大学动物研究中心提供,普通级,批号20200083/20200084,具有实验合格证书),体质量为2.0~2.5 kg,月龄8~12周,常规饲养。无菌条件下取兔眼Tenons囊组织,在显微镜下尽量清除结膜上皮组织,充分浸洗在含青-链霉素的PBS液中,无菌显微组织剪剪碎组织块,向培养皿中加入10 mL完全培养液,吸出含小组织块和细胞成分的培养液接种于25 cm2培养瓶,置于37 ℃、5%CO2细胞培养箱。24 h后见细胞逐渐贴壁生长。
1.2 RYTF的免疫组化鉴定
取对数期生长细胞重悬,将细胞接种于无菌24孔板,4%多聚甲醛4 ℃预冷将细胞固定20 min。每孔加300 μL过氧化物酶阻断液(试剂A),室温孵育10 min,。封闭30 min,加入一抗,二抗孵育。每孔加SABC 300 μL,37 ℃,30 min。每孔加DAB显色液(试剂B)300 μL,20 min。苏木素复染,1 min;PBS液洗3次,每次5 min,光学显微镜下观察并拍照记录。
1.3 CCΚ-8 法检测
取对数期生长细胞重悬后计数,重悬至细胞密度约5×103/孔,以后实验均取此细胞密度。均匀接种于无菌96孔板中,在周边孔中各加入100 μL PBS,分为A-H共7组,每组至少3个复孔。I组为对照组(为细胞和培养液),H组为调零组(为基础培养液);B-G组(为细胞和不同浓度的吡非尼酮溶液),浓度分别为0.01、0.1、0.2、0.3、0.5、1 mg/mL,药物作用24 h后,吸弃孔内液体,分别加入CCΚ-8溶液100 μL,置于37 ℃、5%CO2培养箱内2 h后,检测490 nm 波长下酶联免疫检测仪的每孔吸光度A490nm值。如此重复实验至少5次,综合各组实验数据表明吡非尼酮抑制RYTF 增殖的起始作用浓度为0.1 mg/mL,吡非尼酮抑制RYTF增殖的最大无毒浓度为0.27 mg/mL。取各组吸光度均值并计算相应的抑制率:抑制率=(对照组-实验组)/(对照组-调零组)×100%;存活率=1-抑制率。
1.4 免疫荧光法检测起始作用浓度及最大无毒浓度吡非尼酮作用后TGF-β3、CollagenⅠ、Collagen Ⅲ表达情况
取对数生长期细胞,重悬后将细胞接种于无菌96孔板,待其贴壁生长后加入不同浓度吡非尼酮(0.1、0.27 mg/mL),以未加药孔作为对照组,置于37 ℃、5%CO2培养箱内培养,在药物作用24 h 后固定,通透,封闭。加入TGF-β3(1∶200)、CollagenⅠ(1∶200)、Collagen Ⅲ(1∶200)一抗稀释液100 μL/孔,4 ℃过夜。加入荧光二抗(1∶300,避光)100 μL/孔,37 ℃条件下孵育30 min。DAPI染核5 min,避光条件下用荧光倒置显微镜观察并拍照记录。
1.5 蛋白印迹法检测不同浓度吡非尼酮作用后TGF-β3、CollagenⅠ、Collagen Ⅲ蛋白表达变化情况
取对数期生长的细胞,重悬后将细胞接种于6孔板,对照组不加药,实验组分别加入不同浓度吡非尼酮溶液(0.1、0.27 mg/mL)作用24 h。提取可溶性蛋白,吸取可溶性蛋白上清液置于离心管。调整各组蛋白浓度一致,按上样量20 μg/孔取蛋白溶液,按1∶4比例将5×蛋白上样Buffer与样品混合置于离心管中盖紧,沸水浴加热10 min。SDS-PAGE电泳:配置10%分离胶:体积共15 mL(两块),配置5%浓缩胶:体积共6 mL(两块)加电泳缓冲液,将蛋白样品加入加样孔底部。120 Ⅴ恒压电泳后,全湿电转移后加入一抗TGF-β3、CollagenⅠ、Ⅲ(1∶1000),4 ℃过夜;TBST洗膜3次。加入抗生物素二抗(1∶1000)置于摇床,室温孵育1 h。TBST洗膜3次。避光条件下,滴加显影液和定影液在PⅤDF膜上,曝光、显影并拍照记录,GAPDH一抗(1∶5000)孵育,余同前。
1.6 RT-PCR 检测不同浓度吡非尼酮作用后TGF-β3、CollagenⅠ、Collagen Ⅲ表达情况
取对数期生长细胞,对照组不加药,实验组加入不同浓度吡非尼酮溶液(0.1、0.27 mg/mL),置于37℃、5%CO2培养箱作用24 h。提取总RNA,检测RNA样品的质量、浓度及其完整性,再将各组RNA浓度调整至基本一致。逆转录反应:根据试剂盒说明书步骤操作,用移液枪轻微混匀样品并短暂离心,置于冰上。配置PCR反应液,采用两步法设定反应条件,TGF-β3、CollagenⅠ、Collagen Ⅲ及内参的引物序列(表1)进行PCR反应,通过仪器配套软件记录各目的基因以及内参基因的Ct值,将各目的基因与内参基因相比较,利用2-△△Ct值,并进行半定量分析。

表1 PCR反应TGF-β3、CollagenⅠ、Collagen Ⅲ及内参的引物及序列Tab.1 Primers used for RT-PCR of TGF-β3,collagen I and collagen III
1.7 统计学方法
结果采用SPSS22.0统计学软件分析,计量资料采用均数±标准差表示,利用方差分析法分析结果,方差齐时采用LSD法进行多重比较,方差不齐采用Welch检验,将多个处理组与对照组相比时用DunnettT法,统计结果均以P<0.05 为差异有统计学意义。
2 结果
2.1 RYTF的体外培养
取兔眼Tenons囊组织块体外培养,细胞呈梭形贴壁生长,胞核饱满,细胞汇合度良好,生长走行呈羽毛状或涡旋状排列具有方向性(图1)。
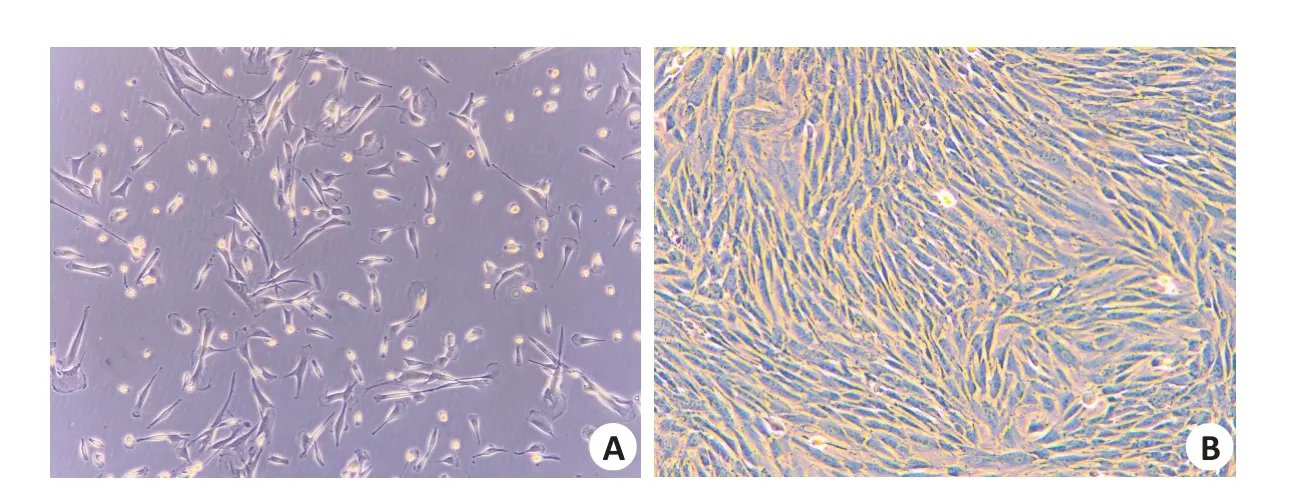
图1 显微镜下体外培养RYTFFig.1 Morphology of cultured rabbit tenon fibroblasts(RTFs)showing adherent cell growth (A) and tightly connected monolayer of the cells (B) (Original magnification:×100).
2.2 RYTF免疫组化鉴定结果
RYTF波形蛋白染色呈阳性,细胞浆染呈棕黄色,细胞核染呈蓝色。对照组细胞核和细胞浆均染呈蓝色(图2);RYTF的角蛋白染色呈阴性,细胞核和细胞浆均染呈蓝色(图3)。
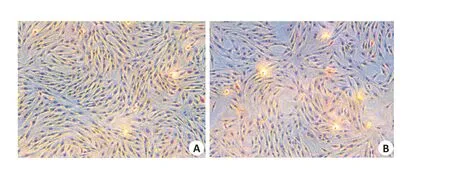
图3 RYTF角蛋白染色结果Fig.3 Keratin staining results of the RTFs(×100).A:Negative staining for keratin in RTFs,which is the same as the control cells.B:Blue staining in the nuclei and cytoplasm of the RTFs.
2.3 CCΚ-8法检测不同浓度吡非尼酮对RYTF增殖的抑制作用
重复CCΚ-8实验法5次,检测不同浓度吡非尼酮(0.01、0.1、0.2、0.3、0.5、1.0 mg/mL)作用24 h后,RYTF的吸光度A值(表2)。
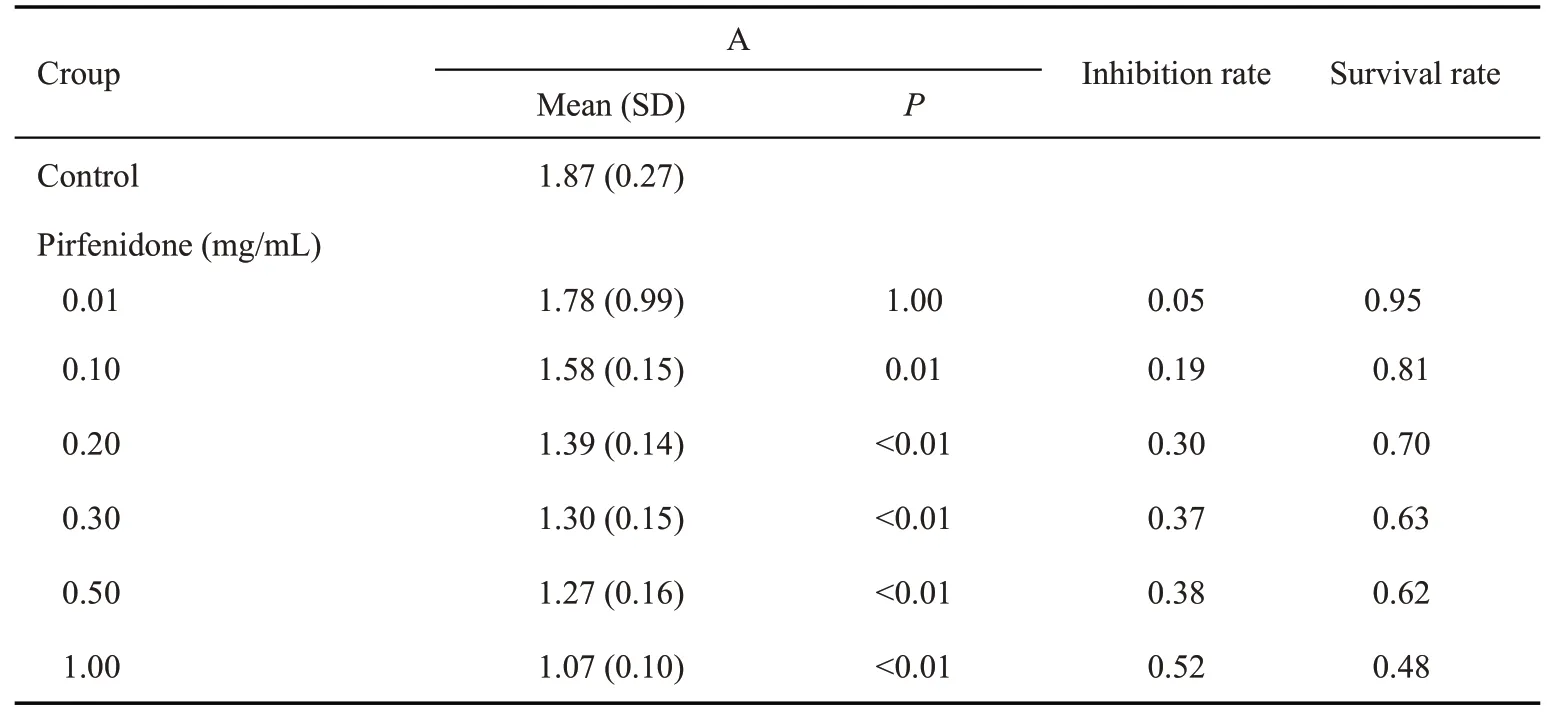
表2 不同浓度吡非尼酮作用RYTF 24 h后吸光度变化及抑制率Tab.2 Absorbance change and inhibition rate of RTFs treated with pirfenidone at different concentrations for 24 h
2.4 吡非尼酮抑制TGF-β3、CollagenⅠ和Collagen Ⅲ表达的免疫荧光结果
利用免疫荧光法检测起始及最适作用浓度吡非尼酮(0.1、0.27 mg/mL)作用于RYTF 24 h 后,各实验组TGF-β3、CollagenⅠ、Collagen Ⅲ的荧光表达量与对照组相比较均明显减少(图4)。
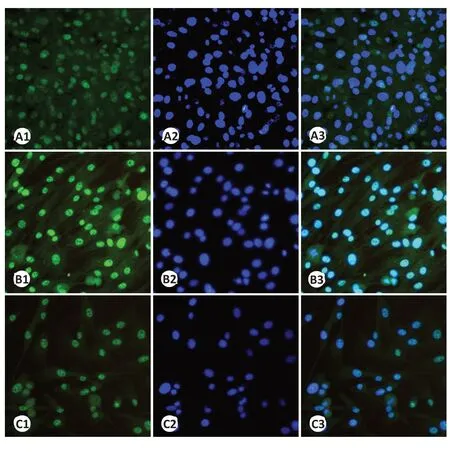
图4 不同浓度吡非尼酮作用于RYTF 后TGF-β3因子的表达变化Fig.4 Expression changes of TGF-β3 in RTFs after treatment with different concentrations of pirfenidone (Immunofluorescence staining,×200).A1:Control group stained by FITC.A2:Control group stained by DAPI.A3:Merged images of A1 and A2.B1:RTFs treated with 0.1 mg/mL pirfenidone and stained by FITC.B2:RTFs treated with 0.1 mg/mL pirfenidone and stained by DAPI.B3:Merged image of B1 and B2.C1:RTFs treated with 0.27 mg/mL pirfenidone and stained by FITC.C2:RTFs treated with 0.27 mg/mL pirfenidone and stained by DAPI.C3:Merged image of C1 and C2.
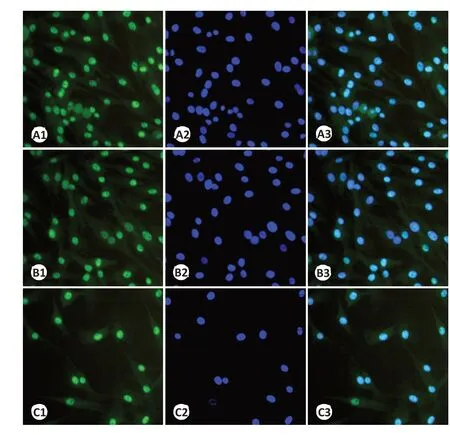
图5 不同浓度吡非尼酮作用于RYTF 后Collagen Ⅰ因子的表达变化Fig.5 Expression changes of collagen I in RTFs after treatment with different concentrations of pirfenidone (×200).A1:Control group stained by FITC.A2:Control group stained by DAPI.A3:Merged image of A1 and A2.B1:RTFs treated with 0.1 mg/mL pirfenidone and stained by FITC.B2:RTFs treated with 0.1 mg/mL pirfenidone and stained by DAPI.B3:Merged image of B1 and B2.C1:RTFs treated with 0.27 mg/mL pirfenidone and stained by FITC.C2:RTFs treated with 0.27 mg/mL pirfenidone and stained by DAPI.C3:Merged image of C1 and C2.
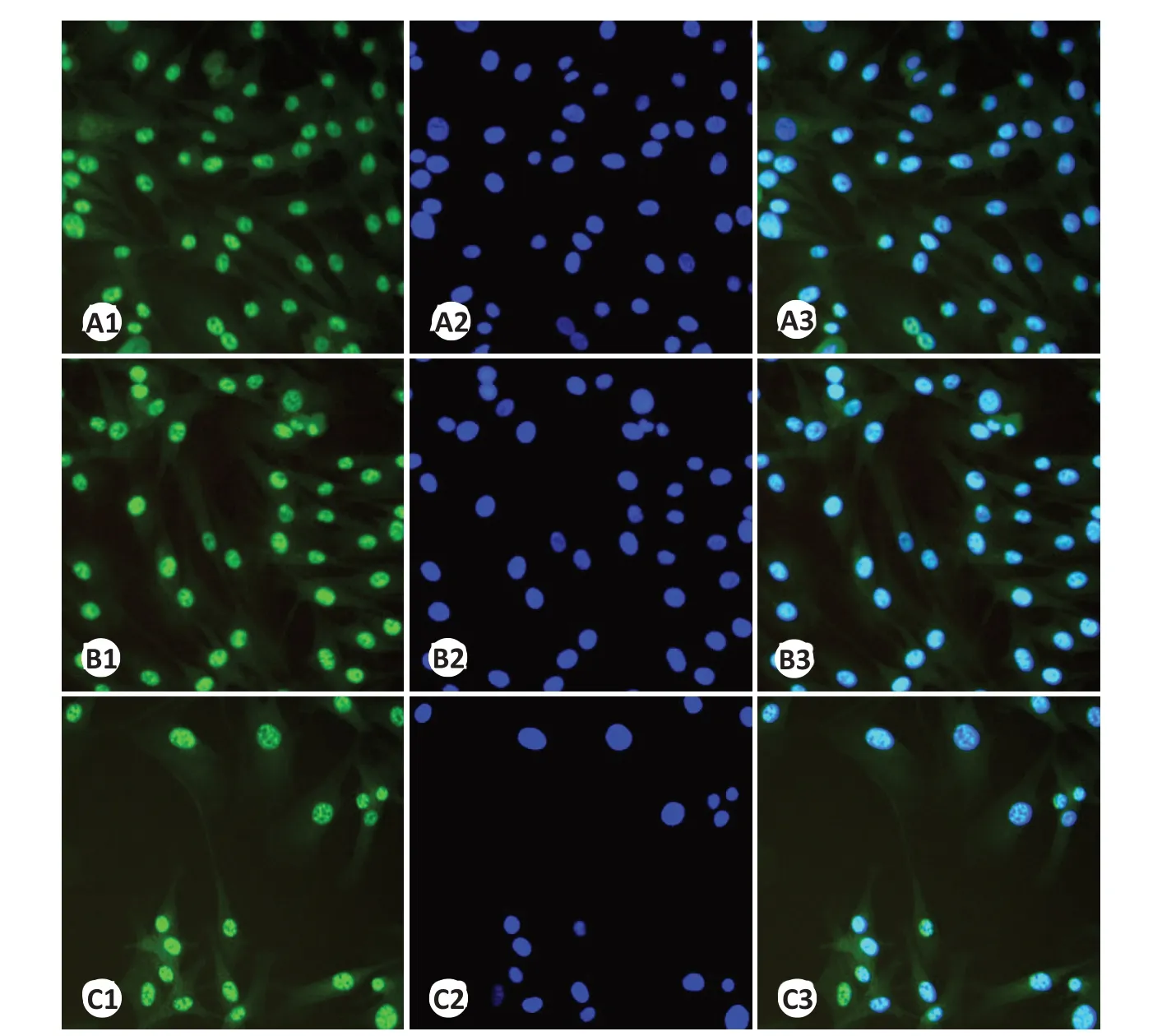
图6 不同浓度吡非尼酮作用于RYTF后Collagen Ⅲ因子的表达变化Fig.6 Expression changes of Collagen III factor after different concentrations of pirfenidone are treat with RYTF(×200).A1:Control group stained by FITC.A2:Control group stained by DAPI.A3:Merged image of A1 and A2.B1:RTFs treated with 0.1 mg/mL pirfenidone and stained by FITC.B2:RTFs treated with 0.1 mg/mL pirfenidone and stained by DAPI.B3:Merged image of B1 and B2.C1:RTFs treated with 0.27 mg/mL pirfenidone and stained by FITC.C2:RTFs treated with 0.27 mg/mL pirfenidone and stained by DAPI.C3:Merged image of C1 and C2.
2.5 吡非尼酮抑制TGF-β3、CollagenⅠ和Collagen Ⅲ蛋白表达的结果
利用Western blot法检测起始及最适作用浓度吡非尼酮(0.1、0.27 mg/mL)作用于RYTF 24 h后,各实验组TGF-β3、CollagenⅠ、Collagen Ⅲ蛋白表达量与对照组相比较均明显减少(P<0.05),差异有统计学意义(图7)。
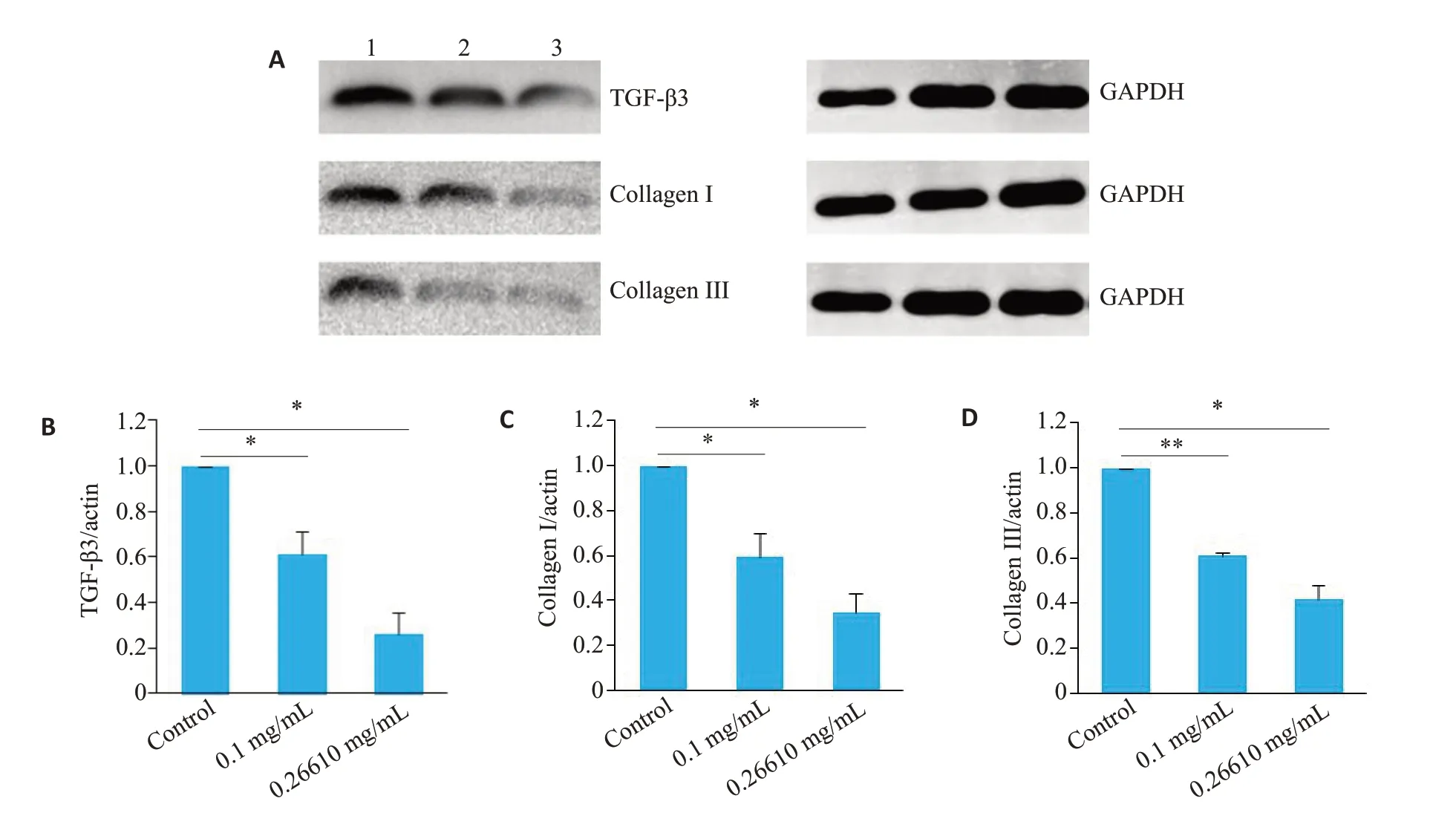
图7 不同浓度吡非尼酮作用于RYTF 24 h后TGF-β3、Collagen Ⅰ、Collagen Ⅲ因子的蛋白表达情况Fig.7 Protein expressions of TGF-β3,collagen I and collagen III in RTFs treated with pirfenidone at different concentrations for 24 h.A:Western blots of the proteins.1:Control group;2:RTFs treated with 0.1 mg/mL pirfenidone;3:RTFs treated with 0.27 mg/mL pirfenidone.B-D:Quantitative analysis of the expression levels of TGF-β3(B),collagen I(C)and collagen III(D)compared with the control group.*P<0.05,**P<0.01.
2.6 吡非尼酮对TGF-β3、CollagenⅠ和Collagen Ⅲ基因表达的影响
利用RT-PCR法检测起始及最适作用浓度吡非尼酮(0.1、0.27 mg/mL)作用于RYTF 24 h 后,各实验组TGF-β3、CollagenⅠ和CollagenⅢ的mRNA相对表达量与对照组相比较均明显减少(图8)。
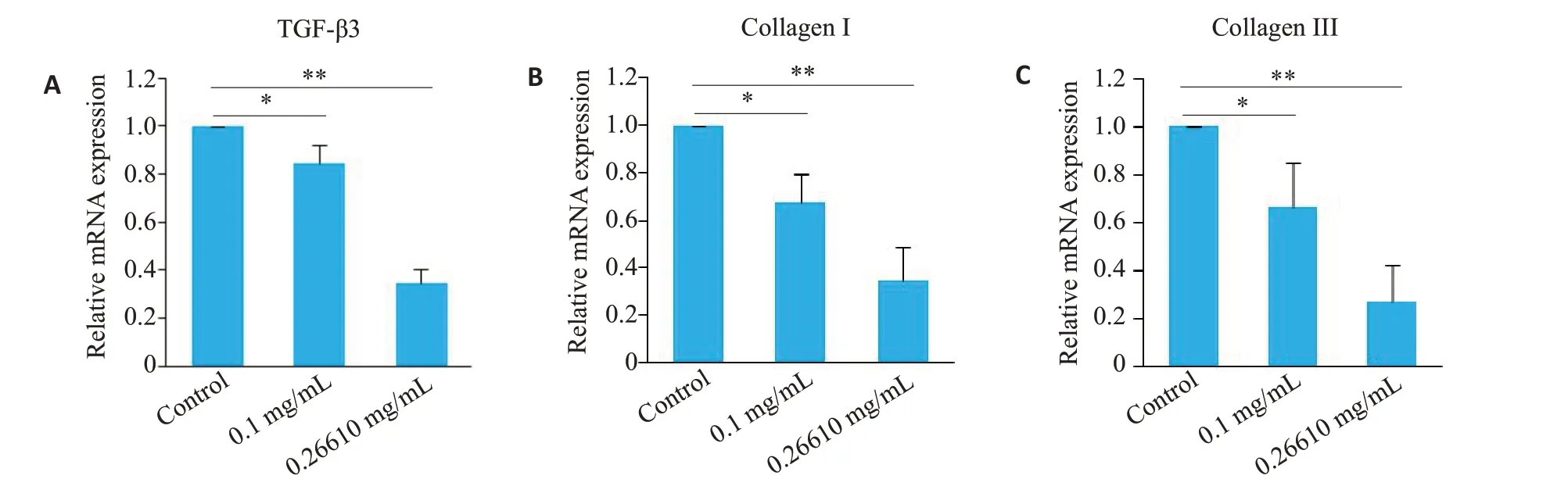
图8 不同浓度吡非尼酮(0.1、0.27 mg/mL)作用于RYTF 24 h后,TGF-β3、Collagen Ⅰ和Collagen ⅢmRNA相对表达量的半定量分析图Fig.8 Semi-quantitative analysis of mRNA expression levels of TGF-β3,collagen I and collagen III in RTFs treated with pirfenidone at 0.1 and 0.27 mg/mLfor 24 h.*P<0.05,**P<0.01.
3 讨论
非生理性的瘢痕形成过程,是由各种原因引起的组织损伤愈合后的病理性变化,其基质为结缔组织,主要成分为胶原纤维,表层为浅薄的瘢痕上皮结构,与成纤维细胞和ECM大量沉积有关,也是大多数炎症性疾病的特征性病理改变,这一过程可以发生于体内多种器官[12]。成纤维细胞过度增殖是导致青光眼滤过术后滤过区瘢痕化影响手术效果的主因。TGF-β作为参与纤维化过程调控的重要因子,其介导的TGF-β/Smad信号通路有望在眼组织抗纤维化进程中发挥效能[13]。胶原蛋白在伤口愈合的各个阶段都是关键性成分,创伤发生后,暴露的胶原与血液接触,促进血小板聚集,活化与创伤相关的趋化因子,而后胶原成为伤口内细胞外基质的基本成分,进入伤区的成纤维细胞合成并分泌CollagenⅠ、CollagenⅢ,构成伤口内基质[14]。所以阻断胶原蛋白的产生及传导通路有望抑制过分纤维化导致瘢痕形成。
持续的TGF-β过表达可引起纤连蛋白沉积于抗青光眼术后滤过道以及CollagenⅠ、Collagen Ⅲ增多,导致滤过道纤维化手术失败。在兔眼抗青光眼手术中,TGF-β可促使成纤维细胞转化为肌成纤维细胞并引起手术部位结膜下纤维化[15]。PFD发挥作用的机制在于抑制TGF-β诱导的细胞转分化过程以及细胞迁移、增殖和收缩能力[16]。在TGF-β家族中TGF-β3因子在各种纤维化疾病中均参与表达,是参与纤维化过程的关键因子,是参与调控修复创伤瘢痕化的主导因素[17]。研究发现在纤维化组织周围通过产生TGF-β3因子,促进成纤维细胞的增殖及分化,从而帮助组织修复及瘢痕形成[18]。通过TGF-β3因子参与诱导的成纤维细胞多数增殖能力变强,细胞体积增大,细胞排列不规整。TGF-β3因子通过诱导炎症刺激因子聚积,促使炎症反应加剧,刺激纤维化进程导致瘢痕产生[19]。吡非尼酮的抗纤维化作用在临床上某些领域已经得到了认可,目前在临床上已经应用于控制肝、肺脏等组织纤维化,但在眼科增殖性眼病中的应用研究较少。吡非尼酮可通过抑制TGF-β因子及其通路上蛋白的表达发挥抗纤维化能力[20]。本实验通过将吡非尼酮应用于体外培养兔眼Tenons囊成纤维细胞(RYTF)研究其抗纤维化的机制。
吡非尼酮抑制TGF-β3因子的表达,当有外界条件的刺激时,TGF-β3因子与靶细胞膜上的受体结合能力降低,使得细胞传导通路受到抑制,影响TβR-II-配体-TβR-I 异源三具体复合物聚合,并在Smad4 协助RSmads向细胞核转移过程被抑制,使其不能将信号转导至细胞内,从而抑制了成纤维细胞的增殖进程[21]。表明在纤维化疾病中TGF-β及其下游Smad信号通路对瘢痕的产生具有重大影响。本实验结果显示,实验组TGF-β3荧光表达量较对照组明显减少,随吡非尼酮药物浓度增加,TGF-β3 荧光表达量降低,表明吡非尼酮通过对TGF-β3因子的抑制作用,达到了抑制组织纤维化进程的目的。在蛋白印迹实验及RT-PCR中TGF-β3表达量与对照组相较均显著减少,随吡非尼酮药物浓度增加,TGF-β3表达量降低。这表明TGF-β3因子在吡非尼酮抑制纤维化过程中作为通路中的重要影响因子。纤维化过程中主要由细胞因子TGF-β及其下游的Smad蛋白共同参与调控目的基因的表达TGF-β/Smad途径[22]。吡非尼酮通过下调TGF-β/Smad通路信号传导,从而抑制兔眼RYTF增殖[23]。TGF-β3因子持续过表达可导致纤连蛋白大量沉积,并使CollagenⅠ、CollagenⅢ增多[24]。在创面修复早期,CollagenⅠ、Collagen Ⅲ在瘢痕形成过程中起主导作用,Collagen Ⅲ早期大量分泌,随后CollagenⅠ大量增殖,CollagenⅠ粗大且扩张能力强,使组织强度增高纤维化增强[25]。若CollagenⅠ、Collagen Ⅲ增殖远超过正常组织,则会造成胶原过度沉积,瘢痕疙瘩产生。本实验结果显示,实验组CollagenⅠ和Collagen Ⅲ的表达量均较对照组明显减少,表明吡非尼酮能有效降低胶原蛋白表达,起到抗纤维化作用。吡非尼酮可在转录及翻译水平抑制胶原活化因子产生及促进细胞外基质降解,从而降低CollagenⅠ和Collagen Ⅲ基因的表达,有效抑制瘢痕形成[26]。
实验结果表明吡非尼酮可通过抑制TGF-β3、CollagenⅠ和Collagen Ⅲ基因和蛋白的表达,影响TGF-β/Smad信号传导通路,作为吡非尼酮抑制RYTF增殖的可能机制。综上所述,吡非尼酮对体外培养的RYTF增殖具有抑制作用,且可通过抑制TGF-β/Smad介导的信号通路发挥作用,为今后吡非尼酮抗增殖作用在眼部疾病中的进一步应用提供分子生物学基础。
综上所述,本实验证明吡非尼酮抑制RYTF增殖作用的分子生物学机制可能是:通过抑制TGF-β3分子表达,影响TGF-β/Smad通路传导,从而降低CollagenⅠ、Collagen Ⅲ的表达,起到了抑制RYTF增殖的作用。生长因子、胶原蛋白表达下降可能作为抑制RYTF增殖、迁移的直接原因。

