线栓法制作大鼠大脑中动脉栓塞模型的改良技巧及效果研究*
赵舒蒙,王 丹,车文文,王松涛,邱继文△
(1.西安翻译学院健康与运动学院,陕西 西安 710105;2.天津中医药大学针灸推拿学院,天津 301617;3.天津中医药大学中医学院,天津 301617)
流行病学研究显示,脑卒中居人口死亡和致残因素的榜首,发病率有逐年增高的趋势,在不同程度上加重了社会、家庭及个人的生活和经济负担[1-2]。脑卒中分为缺血性卒中和出血性脑卒中,前者在临床上尤为常见(约占70%)[3],且好发于大脑中动脉(MCA)。
目前,对于缺血性脑卒中的主要实验研究模型为大脑中动脉栓塞(MCAO)模型。ÇANAKÇI等[4]认为大鼠因具有与人类相似的脑血管解剖结构与功能,易获取、价格低等特点,所以被用于缺血性脑卒中实验的病理生理学变化、发病机制和防治措施等相关机制研究。因此,对于建立能够模拟人类缺血性脑卒中且可信度高、稳定性好、操作性强的动物模型必不可少。本文通过建立大鼠MCAO模型,研究改良后制作方法建立模型的成功率和存活率。
1 材料与方法
1.1材料 选取健康清洁级雄性SD大鼠(购自北京维通利华实验动物技术有限公司)30只,体重250~280 g,鼠龄2.5~3.0 月。分笼饲养,每笼5只,饲养温度25 ℃,相对湿度60%,适应性喂养1周。
1.2方法
1.2.1自制石蜡线栓 将直径 0.22 mm 的尼龙鱼线切割成长 4.0 cm 的线栓,切面尽量平齐,避免形成锐利的边缘和斜面。将线栓的一端和中间 2.0 cm 处用黑色记号笔进行标记。加热熔化固体石蜡为液体,令石蜡液体逐渐冷却直至液体表面将要凝固,此时将线栓记号笔标记的一端快速垂直浸入石蜡,然后快速提起,使线栓标记端表面凝固一薄层石蜡后在显微镜下观察,筛选石蜡端光滑圆钝、直径约0.28 mm的线栓,去掉石蜡过短、粗糙、形状不规则、未包裹住头端的线栓。采用75%的乙醇对自制石蜡线栓进行消毒,将其浸泡于生理盐水中备用。
1.2.2建立模型 本研究采用线栓法建立大鼠MCAO模型,建立模型前所有大鼠禁食不禁饮1 d。具体操作如下:在室温条件下(25 ℃),采用3%异氟烷混合30%氧气和70%空气,通过小动物麻醉机(公司:Midmark,型号:Matrx VMR)进行诱导麻醉,见图1A。采用2%的异氟烷面罩维持麻醉,见图1B。麻醉后,将大鼠仰卧固定在自制鼠板上,剔除颈部正中皮毛,聚维酮碘消毒,剪开约3cm长切口,暴露颈总动脉(CCA),逐步剥离迷走神经及其周围小神经血管,剥离颈外动脉(ECA)、颈内动脉(ICA),见图1C。备线结扎CCA近心端和ECA近分叉口处,同时在ICA近分叉口处采用动脉夹夹闭,并在 CCA 分叉口处上方5mm 左右备线,打活结,用眼科剪在CCA上剪一45°斜向下切口,将线栓插入切口并将备线系紧,程度为切口处不出血为宜。松开动脉夹,缓慢、柔和地朝向 ICA 插入制备线栓,见图1D。在此过程中,应防止由于手法不当导致血管痉挛引起插入线栓困难,同时切勿牵拉过猛引起血管痉挛,避开翼腭动脉,若感觉遇到阻力无法插入线栓,则将线栓向外提拉,换方向继续插入,至标记1.8 cm处且接近 CCA 近分叉处时,停止,备线,结扎CCA,见图1E。剪断剩余线头,颈部伤口处加少量庆大霉素以防感染,缝合切口后聚维酮碘消毒,见图1F。将大鼠放入25 ℃恒温保温箱中,直至大鼠完全清醒。清醒后的大鼠单笼饲养,保持笼内干燥,并保证大鼠能够自由摄取食物和饮用水,见图1G。
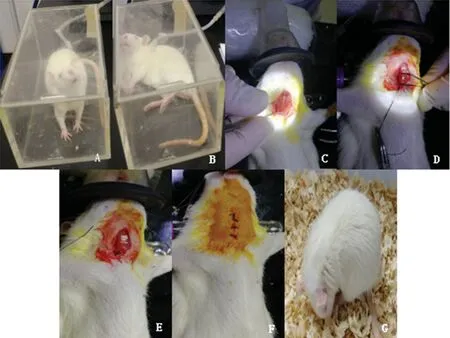
A:诱导麻醉;B:维持麻醉;C:暴露ECA和ICA;D:插入线栓;E:插入线栓后;F:缝合切口后;G:清醒后大鼠。
1.2.3指标评价
1.2.3.1TTC染色 建立模型24 h后,随机挑选符合神经功能5分制评分法(4分:意识低下甚至昏睡,不能行走;3分:向病灶对侧倾倒;2分:向病灶对侧转圈;1分:病灶对侧前肢不能伸展;0分:无神经功能缺失症状)[5]成功标准的3只大鼠进行形态学检测(TTC染色)。
1.2.3.2存活率 存活率=2、7 d内存活大鼠/制备成功大鼠模型数量×100%。
1.3统计学处理 采用SPSS20.0软件进行统计学数据分析。存活率和成功率属于计数资料,采用率或构成比表示。
2 结 果
2.1成功率 本实验30只大鼠中,符合神经功能5分制评分法标准即成功建模的大鼠28只,成功率为93.33%,形态学检测见图2。
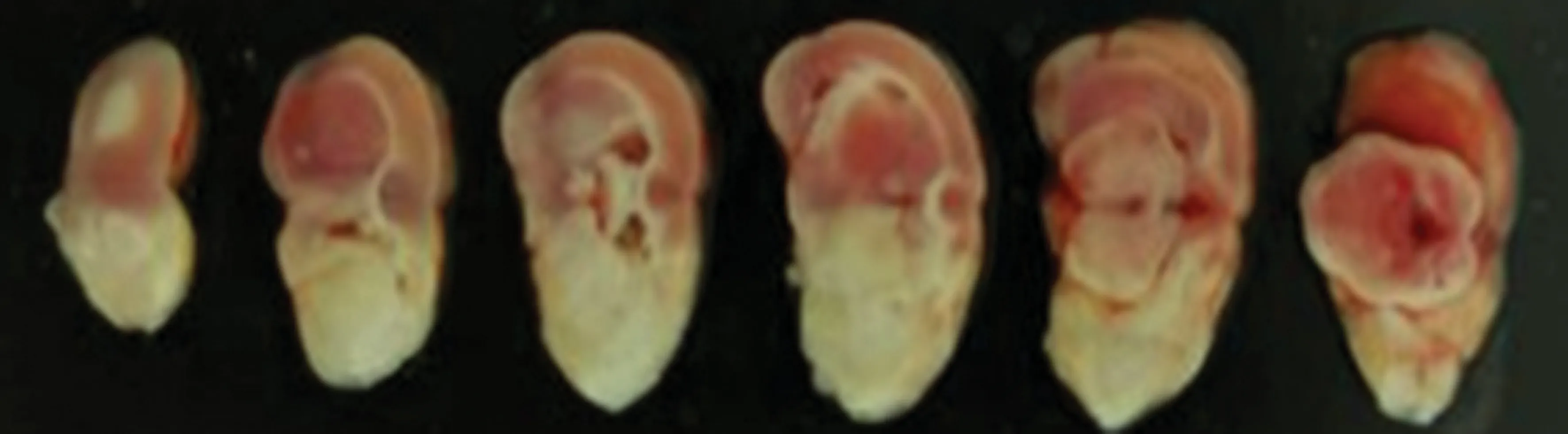
白色区为MCA供血区。
2.2存活率 模型制备后2、7d的存活率分别为100.00%(28/28)和82.14%(23/28)。
3 讨 论
3.1线栓法制备大鼠MCAO模型方法 线栓法制备的大鼠MCAO模型与人类缺血性脑卒中模型发病机制相似度高,因此线栓法在此类研究中最常见,应用最广泛。该模型以其不开颅、易操作、损伤小、缺血效果肯定、重复性好、可准确控制缺血及再灌注时间、大脑中动脉闭塞及再灌注效果好,以及对大鼠生理指标影响小等优点受到众多学者的高度认可[5-7]。
目前,评价模型制备是否成功及脑梗死测定的参考仅依据神经症状评分和TTC染色,前者不能避免主观评价,后者无法及时评价,影响实验研究的准确性。随着多数研究者对线栓法的不断改进和完善,提高了模型的成功率。改善的方面包括线栓制备、切口位置、是否结扎翼腭动脉、线栓插入的方法、线栓插入深度、造模后护理等[8-9]。
3.2麻醉方法对MCAO的影响 本实验中采用异氟烷对大鼠进行麻醉制备模型。通过阅读文献发现,动物实验中,水合氯醛和异氟烷均是常用的麻醉剂[10-11]。但研究显示,水合氯醛由于剂量及对呼吸道腺体的作用等,容易导致手术过程中、术后出现较多问题,如呼吸道阻塞、苏醒时间延长等,会对实验过程和结果产生影响[10,12]。由于制备模型时间长,麻醉剂量不足会导致大鼠手术中挣扎,影响手术;而再补加麻醉药物时,由于麻醉药物剂量不能确定,可能麻醉过量,造成呼吸抑制、大鼠死亡或清醒推迟影响神经功能症状评分;麻醉药物剂量过多,可能会导致大鼠术后出现肠梗阻、腹膜炎等多种不良反应,造成模型成功率降低,增加实验成本。
与水合氯醛相比,异氟烷属于吸入性麻醉剂,麻醉浓度和深度可控性较强,而且术后大鼠清醒时间缩短,更加方便安全。因此,作为动物实验麻醉药物的选择,异氟烷效果更优,可以稳定大鼠血氧分压、心率等,同时对于脑缺血再灌注、心血管系统和神经系统具有一定的保护作用[11,13]。本实验中,大鼠模型成功率为93.33%;且大鼠模型制备后2、7 d内,存活率分别为100.00%和82.14%,说明异氟烷作为麻醉剂对于模型制备的成功率和存活率作用较大。
3.3颈部神经、血管分离中的注意事项 本实验中,麻醉后分离大鼠颈部神经、血管时,应注意在两侧的鼓泡腺体之间进行,对于颈前肌群的充分暴露十分必要,且不会损伤腺体。首先充分暴露CCA,其次,逐步剥离迷走神经,剥离、暴露ECA和ICA。需要注意的是,在颈部血管分离过程中,应尽量保证剥离干净血管外膜,避免牵拉损伤ICA和ECA分叉处的交感神经节和迷走神经,因为牵拉损伤可能造成大鼠死亡或呼吸抑制,从而降低模型成功率和存活率。
3.4线拴插入过程中的注意事项 线栓进入ECA后,多数情况下能顺利插入至MCA,但有时插入时则会遇到明显阻力,难以进入,这时一定不能继续盲目反复插入,正确的做法是抽出较多线栓,调整线栓角度,重新进入。如果仍不能进入应及时更换新的线栓。插入线栓时很难进入是因为血管穿入颅骨时有一个狭窄或角度,这时若盲目插入,极易损伤血管。线栓不能在血管内反复用力提插,否则会引起线栓前端变形,导致插入时损伤血管或血管痉挛,造成颅内出血或线栓插入困难情况的发生,影响模型质量,延长造模时间。如出现此类情况,应将线栓稍向外退出,调整插入方向,再进行插入,若仍然出现插入困难,应及时更换线栓。
线栓插入深度也应注意。线栓插入浅会造成制备模型失败,线栓插入深易引起蛛网膜下腔出血;若线栓插入时大鼠出现颤动,说明线栓误插入至翼腭动脉。线栓插入切勿过深,过深易损伤血管造成蛛网膜下腔出血,神经功能症状过重且造成大鼠生存周期短。本实验前期大量制备模型时发现,线栓插入深度18 cm时,大鼠术后神经功能评分稳定且成模率高,张成英等[14]报道,线栓插入深度为17~19 cm。因此,本实验线栓插入深度为18 cm。
3.5术后感染的预防 术前对手术器械、大鼠手术切口都要进行严格的消毒,术后缝合前在伤口周围喷少量庆大霉素以防感染,缝合后伤口部位用聚维酮碘消毒,可降低模型死亡率,有助实验顺利进行。
3.6术后护理和营养支持 在室温条件下(25 ℃)进行手术,对大鼠进行白炽灯照射以维持大鼠正常体温。术后将大鼠放入25 ℃恒温透明保温箱中,直至大鼠完全清醒。前期实验发现,术后部分大鼠出现进食、便溏、消瘦等症状[8-11]。因此本实验术后采用1%的蔗糖水3~5 mL添加至饮用水中,给予大鼠营养支持。
综上所述,在动物实验研究中,应根据研究方向和观察指标选择不同的造模方法,这是进行动物实验的首要条件。同时,不同大鼠MCAO模型制备方法各有利弊,适用范围不尽相同。作者认为,成功的大鼠MCAO模型应至少满足以下条件:(1)成功率、存活率高;(2)梗死灶位置固定,梗死范围和程度可控;(3)与人类缺血性脑卒中生理病理发生、发展变化过程一致,以此有利于对各种继发性损害及诱发因素的研究;(4)重复性高,稳定性和可操作性强,成本低。然而,目前尚缺乏高质量的MCAO模型,仍存在许多不可控因素,因此,科研人员仍需要在实践中不断探索,最大限度地复制与人类局灶性脑缺血发病过程近似的动物模型及控制相关影响因素,建立更加科学合理的模型制备方法,规范化MCAO模型的制备,这将更有利于深入研究缺血性脑卒中的发生和发展机制。

