ABCG2、VEGF及miRNA-23a与乳腺癌术后同侧锁骨上淋巴结转移的关系
刘平贤 张浩 王征 李伟汉 陆佳团
作者单位:河南省南阳市中心医院乳腺分泌腺外科,河南,南阳473009
乳腺癌是临床上妇科常见的一种恶性肿瘤,具有高发病率、死亡率的特征。乳腺原位癌不致命,但若治疗不及时,易发生转移而侵袭心、脑、肺等重要器官,其中同侧锁骨上淋巴结转移是导致患者预后不良的因素之一[1-2]。临床相关报道显示,初诊伴有同侧锁骨上淋巴结转移总发病率较高,对女性生命健康造成严重危险[3]。外科根治术是目前临床治疗乳腺癌的主要方法,可有效切除肿瘤细胞,防止癌细胞扩散,但仍有部分患者因病情恶化而发生淋巴结转移,因此预测其淋巴结转移逐渐受到关注与重视[4]。近年来,相关研究发现,ATP 结合膜转运蛋白超家族G 成员2(ATP-binding cassette superfamily G member 2,ABCG2)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)及微小RNA-23a(miRNA-23a)等因子均与乳腺癌发生、发展及治疗、预后关系密切[5],但关于其与乳腺癌术后同侧锁骨上淋巴结转移的关系报道鲜为少见。对此,本研究将探讨ABCG2、VEGF及miRNA-23a水平与乳腺癌术后同侧锁骨上淋巴结转移的关系。现报道如下。
1 资料与方法
1.1 一般资料
选取本院2018年6月至2020年10月收治的79 例乳腺癌行根治术患者纳为研究组。纳入指标:①所有患者均符合乳腺癌诊断标准[6];②术前均未接受放化疗、抗氧化等治疗;③影像学资料和病理资料完整;④年龄>18 岁,且无手术禁忌症。排除标准:①过敏体质;②合并血液、神经等系统疾病;③合并心、肝、肾等严重原发性疾病;④二次手术者。
79 例均为女性,平均年龄为(53.98±6.28)岁,伴同侧锁骨上淋巴结转移者43 例(转移组),未伴同侧锁骨上淋巴结转移者36 例(未转移组)。另选取同期进行健康体检的49 例健康女性作为对照组,平均(52.78±5.71)岁,各组资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准通过,受试者均签署知情同意书。
1.2 方法
1.2.1 S-P 免疫组化染色法检测ABCG2、VEGF
主要试剂:兔抗人ABCG2 单克隆抗体、兔抗人VEGF 多克隆抗体、链酶菌抗生物素蛋白-过氧化物酶连接(SP)试剂盒、胰蛋白酶及二氨基联苯氨酶底物显色试剂盒,均购自福州迈新生物技术开发有限公司。
标本准备:手术切除的病理组织均经4%福尔马林固定,石蜡包埋,4 μm 连续切片后脱蜡、水化。使用S-P 免疫组化染色法对ABCG2、VEGF 蛋白进行检测,检测过程严格按照说明书进行。一抗阴性对照使用PBS(磷酸盐缓冲液)进行代替。
结果判断[7]:根据阳性细胞百分比、染色强度判定。阳性细胞百分比:0 分:无阳性细胞;1 分:阳性细胞<10%;2 分:10%~50%;3 分:50%~75%;4 分:>75%。染色强度:0 分,无色;1 分,淡黄色;2 分,棕黄色;3 分,棕褐色。总积分:上述2 项评分的乘积。阳性:总积分>4 分。
1.2.2 荧光定量PCR 检测miRNA-23a
研究组于术前、对照组于体检当日空腹抽取受3 mL 外周静脉血,以4 000 r/min 离心10 min,分离血清,置于-20℃低温保存。根据总RNA 提取试剂说明书提取总RNA,水溶解后采用分光光度计测定RNA 浓度与纯度,吸光度在1.8~2.1 之间可用于后续逆转录。miRNA-23a 茎环逆转录反应引物:5′-CGTCGCTACATCcAG7AGCATATGCGACGCTrC-CAGT-3′。反应条件:42℃15 min,85℃5 s,4℃10 min。反应产物置于-20℃保存。应用SYBR Green rQ-PCR 试剂盒检测实时荧光定量PCR。miR-23a:上游引物(F):5′-ITIHCAGA CCCCAGGCAG-GCACA-3′;下游引物(R):5-TCCATCAGCGTCAA-CACCATCA-3′。本实验设置复孔3 个,采用u6基因作为内参,每个样品测定3 次,PCR 循环参数:95℃3 min;95℃12 s,62℃40 s,共40 个循环。
1.3 统计学方法
采用统计软件SPSS 22.0 进行分析,计量资料以()表示,行t检验;计数资料以n(%)表示,行χ2检验;采用ROC 曲线分析ABCG2、VEGF及miRNA-23a 对乳腺癌术后同侧锁骨上淋巴结转移的预测价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 对照组与研究组ABCG2、VEGF及miRNA-23a 表达情况比较
研究组ABCG2、VEGF 阳性表达率明显高于对照组,miRNA-23a水平明显低于对照组,差异均有统计学意义(P<0.05)。见表1、图1。
表1 对照组与研究组ABCG2、VEGF及miRNA-23a 表达情况比较[n(%),(±s)]Table 1 Comparison of ABCG2,VEGF and mirna-23a expression between control group and Study Group[n(%),(±s)]
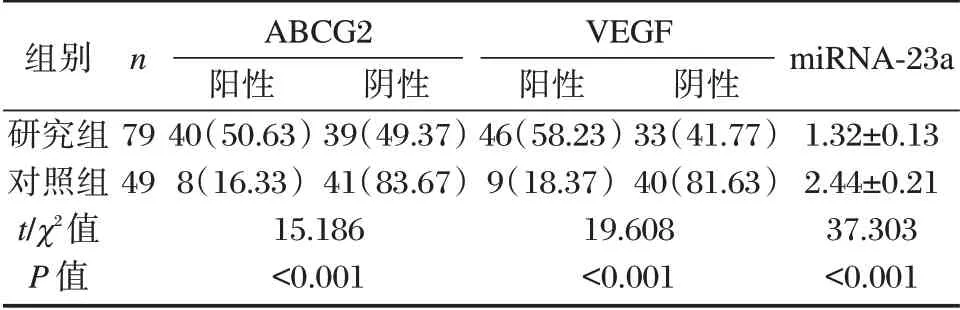
表1 对照组与研究组ABCG2、VEGF及miRNA-23a 表达情况比较[n(%),(±s)]Table 1 Comparison of ABCG2,VEGF and mirna-23a expression between control group and Study Group[n(%),(±s)]
组别研究组对照组t/χ2值P 值n 79 49 ABCG2阳性40(50.63)8(16.33)15.186<0.001阴性39(49.37)41(83.67)VEGF阳性46(58.23)9(18.37)19.608<0.001阴性33(41.77)40(81.63)miRNA-23a 1.32±0.13 2.44±0.21 37.303<0.001
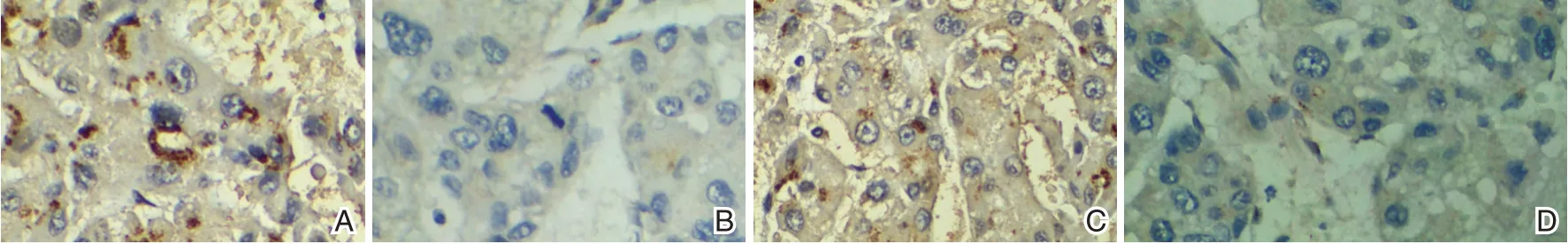
图1 免疫组化染色图(SP,×400)Figure 1 immunohistochemical staining(SP,×400)
2.2 转移组与未转移组ABCG2、VEGF及miRNA-23a 表达情况比较
转移组ABCG2、VEGF 阳性表达率明显高于未转移组,miRNA-23a水平明显低于未转移组,差异均有统计学意义(P<0.05)。见表2。
表2 转移组与未转移组ABCG2、VEGF及miRNA-23a表达情况比较[n(%),(±s)]Table 2 Comparison of ABCG2,VEGF and mirna-23a expression between metastasis group and non metastasis group[n(%),(±s)]

表2 转移组与未转移组ABCG2、VEGF及miRNA-23a表达情况比较[n(%),(±s)]Table 2 Comparison of ABCG2,VEGF and mirna-23a expression between metastasis group and non metastasis group[n(%),(±s)]
组别转移组未转移组t/χ2值P 值n 43 36 ABCG2阳性28(65.12)12(33.33)7.919 0.005阴性15(34.88)24(66.67)VEGF阳性36(83.72)10(27.78)25.213<0.001阴性7(16.28)26(72.22)miRNA-23a 0.43±0.08 1.16±0.12 32.256<0.001
2.3 不同临床病理参数乳腺癌患者ABCG2、VEGF及miRNA-23a 表达情况
不同年龄、肿瘤直径、月经状态及肿瘤类型的乳腺癌患者ABCG2、VEGF及miRNA-23a 表达比较差异无统计学意义(P>0.05)。不同临床分期的患者VEGF 阳性表达率比较差异无统计学意义(P>0.05)。临床分期Ⅰ~Ⅱ期者ABCG2 阳性表达率显著低于Ⅲ期者,miRNA-23a水平高于Ⅲ期者,差异均有统计学意义(P<0.05)。见表3。
表3 ABCG2、VEGF及miRNA-23a与乳腺癌临床病理参数的关系[n(%),(±s)]Table 3 the relationship between ABCG2,VEGF and mirna-23a and clinicopathological parameters of breast cancer[n(%),(±s)]
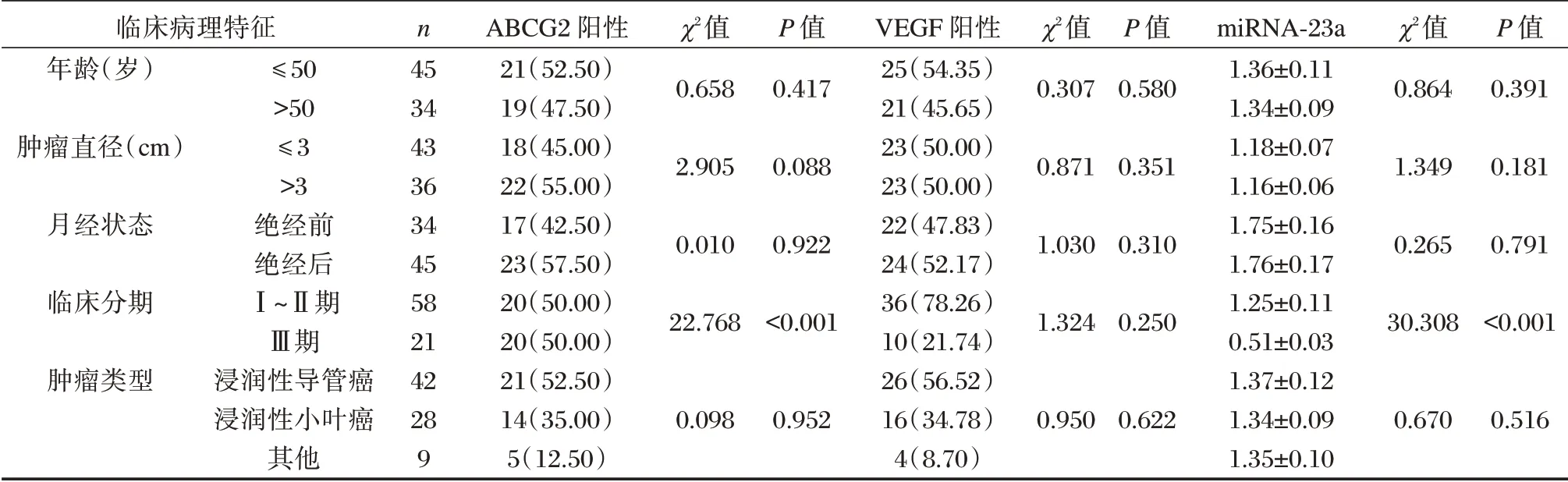
表3 ABCG2、VEGF及miRNA-23a与乳腺癌临床病理参数的关系[n(%),(±s)]Table 3 the relationship between ABCG2,VEGF and mirna-23a and clinicopathological parameters of breast cancer[n(%),(±s)]
临床病理特征年龄(岁)肿瘤直径(cm)月经状态临床分期肿瘤类型≤50>50≤3>3绝经前绝经后Ⅰ~Ⅱ期Ⅲ期浸润性导管癌浸润性小叶癌其他n 45 34 43 36 34 45 58 21 42 28 9 ABCG2 阳性21(52.50)19(47.50)18(45.00)22(55.00)17(42.50)23(57.50)20(50.00)20(50.00)21(52.50)14(35.00)5(12.50)χ2值0.658 2.905 0.010 22.768 0.098 P 值0.417 0.088 0.922<0.001 0.952 VEGF 阳性25(54.35)21(45.65)23(50.00)23(50.00)22(47.83)24(52.17)36(78.26)10(21.74)26(56.52)16(34.78)4(8.70)χ2值0.307 0.871 1.030 1.324 0.950 P 值0.580 0.351 0.310 0.250 0.622 miRNA-23a 1.36±0.11 1.34±0.09 1.18±0.07 1.16±0.06 1.75±0.16 1.76±0.17 1.25±0.11 0.51±0.03 1.37±0.12 1.34±0.09 1.35±0.10 χ2值0.864 1.349 0.265 30.308 0.670 P 值0.391 0.181 0.791<0.001 0.516
2.4 ABCG2、VEGF及miRNA-23a 对乳腺癌术后同侧锁骨上淋巴结转移的预测价值
ROC 曲线分析结果显示,ABCG2、VEGF及miRNA-23a 三者联合预测乳腺癌术后同侧锁骨上淋巴结转移的ROC 下曲线面积(AUC)为0.737,明显高于各项单独检测(P<0.05)。见表4、图1。
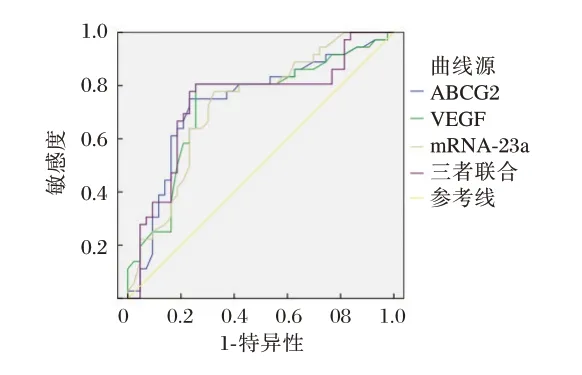
图1 ROC 曲线Figure 1 ROC curve
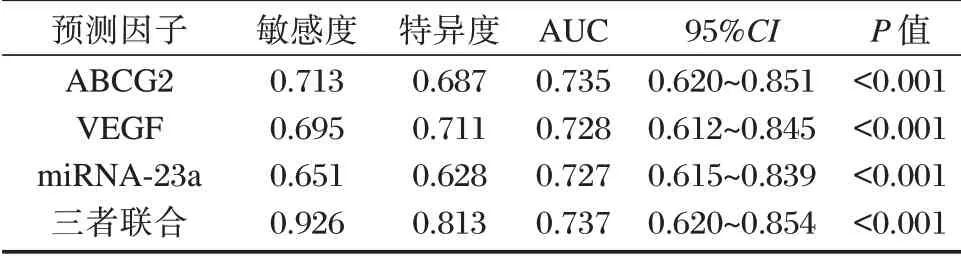
表4 ABCG2、VEGF及miRNA-23a 对乳腺癌术后同侧锁骨上淋巴结转移的预测价值Table 4 the predictive value of ABCG2,VEGF and mirna-23a in ipsilateral supraclavicular lymph node metastasis after breast cancer surgery
3 讨论
对于乳腺癌患者而言,术后同侧锁骨上淋巴结转移的发生率较高,是乳腺癌预后不良的重要指标[8]。因此如何有效评估患者术后淋巴结转移是医学工作者关注的热点。
相关研究显示,ABCG2 是肿瘤细胞株中分离的ABC 转运蛋白家族之一,被认为与肿瘤耐药有关,尤其是在乳腺癌多药耐药中发挥重要作用[9]。Kim 等[10]研究发现,ABCG2 是参与肿瘤生长、分化、侵袭与转移等生物学行为的重要因子,且在乳腺癌中呈高表达。Kumari 等[11]研究则指出,ABCG2 过表达者,其生物学行为具有特殊性,表现为化疗效果差、患者预后不佳等。本研究发现,ABCG2 在乳腺癌中呈高表达,阳性率为50.63%,其与患者年龄、肿瘤直径等无明显关系,但与临床分期有关,且合并淋巴结转移者ABCG2 阳性表达率显著高于无淋巴结转移者。上述研究结果均提示ABCG2 在乳腺癌发生、转移过程中具有一定作用。
Kazakydasan 等[12]发现,乳腺癌侵袭与转移是一个涉及多方面因素的过程,其中肿瘤细胞的过度增殖及新生血管生成是重要影响因素。VEGF为作用于血管内皮细胞的血管内皮生长因子,是重要的血管生成正性调节因子,可促进血管内皮细胞分裂。肿瘤的生长依赖肿瘤新生血管的形成,血管生成对肿瘤的发生、侵袭和转移至关重要[13]。本研究中,转移组VEGF 阳性表达率显著高于无转移组,与国外研究结果相符[14]。提示VEGF 表达增高有利于乳腺癌细胞发生淋巴结转移。VEGF 可促进肿瘤血管内皮细胞增殖,增加肿瘤血管数量,为乳腺癌细胞转移提供通道。另外,本研究发现,VEGF 表达与肿瘤分期、病理类型均无关,与Choi 等[15]结果报道不符。推测可能与本研究样本量纳入偏少有关,亦可能与VEGF 的表达在不同类型肿瘤变异及发展过程中所起作用不明显有关。
miRNA-23a 是存在脊椎动物基因组中的一种抑癌因子,参与基因转录表达,具有调控细胞增殖的作用,其过表达可能可抑制肿瘤细胞的生长并促进肿瘤细胞凋亡,从而起到抑制肿瘤细胞增殖、侵袭的作用。本研究中,研究组miRNA-23a水平显著低于对照组,尤其是伴有淋巴结转移组miRNA-23a水平更低,且该因子表达与乳腺癌临床分期有关。周永安等[15]报道通过分析影响乳腺癌患者术后复发转移的危险因素亦发现,miRNA-23a低表达是患者术后复发转移的独立影响因素,与本研究报道相符。表明miRNA-23a 低表达可能提示患者伴有淋巴结转移,预后较差。此外,本研究ROC 曲线结果显示,ABCG2、VEGF及miRNA-23a 均可有效预测乳腺癌患者术后淋巴结转移,是评估患者术后淋巴结转移的重要指标,且联合检测的诊断价值最佳。
综上所述,ABCG2、VEGF表达增高,miRNA-23a表达下降对乳腺癌术后同侧锁骨上淋巴结转移有促进作用,推测上述因子可能是防止乳腺癌术后淋巴结转移的靶点。